原花青素對β羥丁酸致牛子宮內膜細胞氧化損傷的保護作用
王競晗
(山東省臨沂市沂南縣動物疫病預防控制中心,山東 臨沂 276300)
0 引言
圍產期的奶牛因為乳汁分泌和胎兒的發育,全身需要大量能量,但該時期的奶牛飲食減退,能量匱乏。為了補充能量,奶牛的脂肪開始消耗,這使得游離脂肪酸(NEFA)在體內產生,并在一定程度上與血液混合,發生高NEFA血癥。肝內的NEFA是酮體的主要來源,主要成分β羥丁酸占78%,乙酰乙酸占20%,丙酮占2%。β羥丁酸是酮體的主要成分,可以對圍產期奶牛的健康狀況做及時的監測,避免出現能量負平衡、脂肪異常動員而出現的臨床酮病或亞臨床酮病。先前的研究已經廣泛證明了血漿中的游離脂肪酸(NEFA)和β羥丁酸(BHBA)與臨床酮癥和移位性腹股溝等產后疾病的發病率之間存在密切的關聯。因此研究高NEFA血癥與高BHBA狀態對肝臟細胞的應激響應和致死效果,分析NEFA和BHBA使肝臟細胞死亡的信號通路的機理,對臨床酮癥的發病原因和治療方案有借鑒意義。
臨床酮癥發病時,奶牛的發情時間推后,胚胎成型時間變長,胚胎成活率明顯下降,嚴重影響奶牛的繁殖效果。而β羥丁酸是引發奶牛酮病的主要致病成分之一,約占NEFA的78%,β羥丁酸在血漿中過多會導致奶牛身體細胞氧化凋亡,如果發生大量損害,則影響奶牛的身體正常運轉。這種生理適應性的挑戰在現代高價值繁殖奶牛中加劇,并且由于營養和環境條件的差異而變得復雜。
所用的牛子宮內膜細胞(BEND)在體外培育,分組加入BHBA和PC,研究牛子宮內膜細胞受BHBA的氧化作用,分析原花青素保護其免受氧化的作用機理,對臨床酮病影響奶牛生產的內在原因提供參考數據。
1 材料與方案
1.1 材料
試驗試劑采用市面隨機采購方式,遵循數理統計隨機性[1-2],試劑見表1。
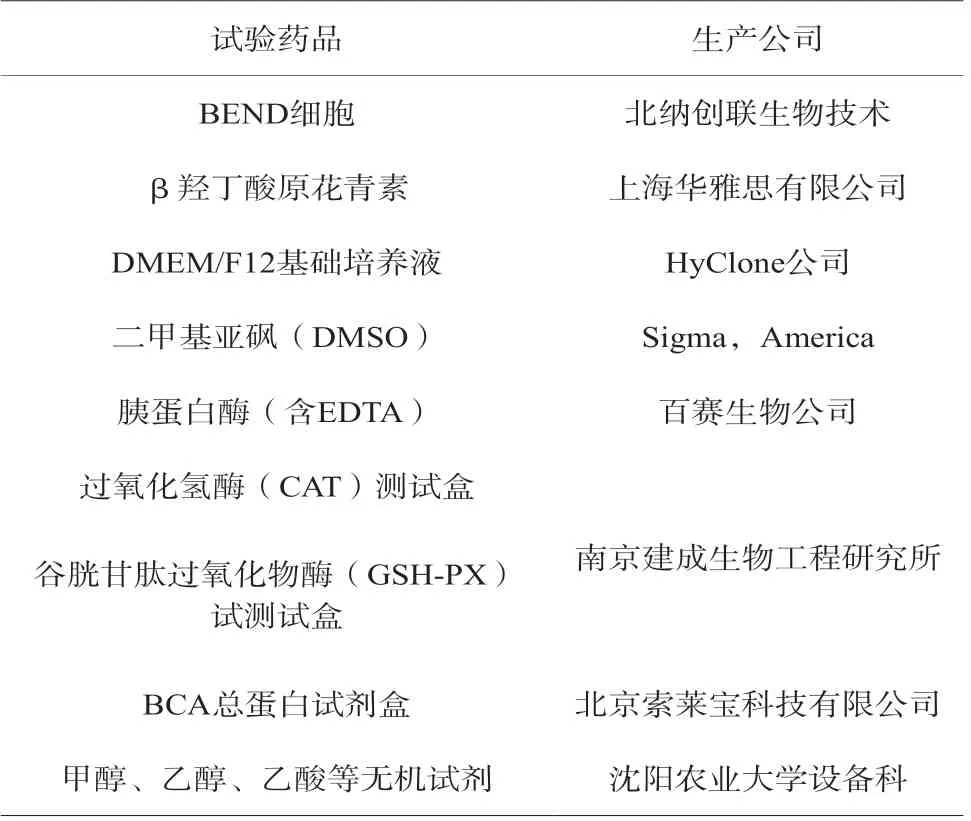
表1 試驗試劑
1.2 試驗方案
選取β羥丁酸的濃度分別為A1:0.6 mmol/L、A2:1.2 mmol/L、A3:2.4 mmol/L,選取原花青素濃度為10 umol/L,作用時間為24 h。試驗環境統一采用DMEM/F12基礎培養液配置的完全培養基,試驗方案中不再詳述[3]。將試驗分為8組,各組做3復孔,見表2。
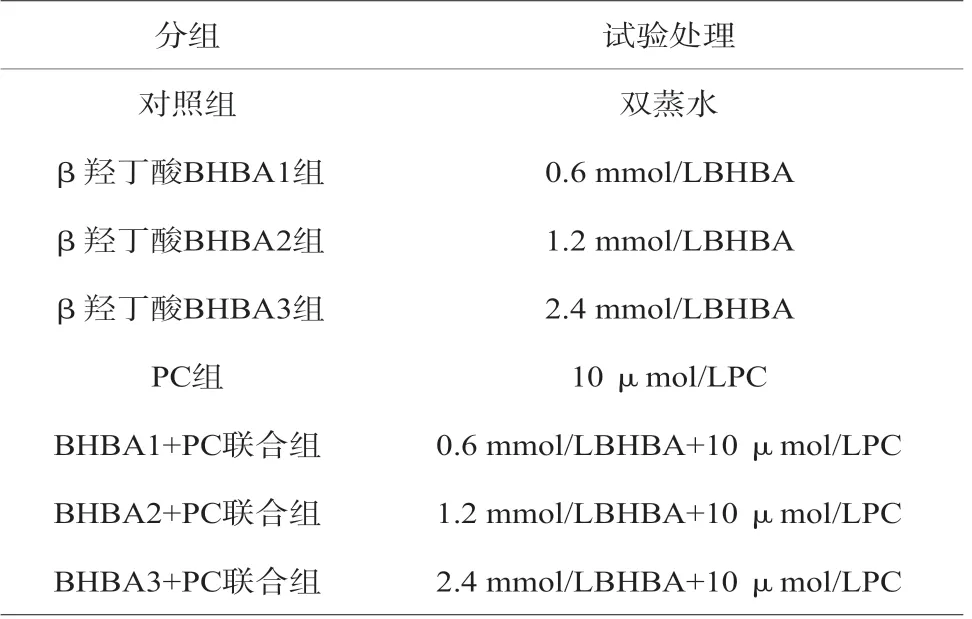
表2 試驗方案
將細胞瓶內的細胞傳代至6孔板中,待貼壁穩定生長后(約7 h)向6孔板中加入不同濃度的藥物,即8組,3個復孔,培養24 h后取上清用于氧化指標的CAT試劑盒測定與GSH-PX試劑盒測定。
2 試驗方法
2.1 CAT試劑盒測量
試劑1,100 mL液體;試劑2,10 mL底物液體;試劑3,10 mL液體。試劑統1在4 ℃放置6個月。
BEND細胞經過培養并稀釋,1 d后離心得到上清液。首先,做預實驗,測量樣品的稀釋程度。在正式試驗中,從8組中取出16個10 mL離心管,分為對照管與測量管。將1.0 mL試劑1和0.1 mL試劑2加入對照管中,然后放入37 ℃的水浴鍋中充分浸泡1min,最后分別加入1.0 mL試劑3、試劑4和上清液;將對應管得到的0.1 mL液體加入到測量管中,并加入1.0 mL試劑1,0.1 mL試劑2,放入37 ℃的水浴鍋中充分浸泡1 min,再添加1.0 mL的試劑3。充分搖動均勻對照管和測量管,轉移到酶標平板上,每孔200 μL,每組重復3次。將試管放置到酶標儀中,將其波長調整為405 nm,并在96孔板中觀察OD值。細胞上清中CAT活性的計算[4]:

2.2 GSH-PX試劑盒的測定方法
試劑,2 mL儲備液。試劑2,包括甲粉,放入雙蒸水溶解,乙液50 mL,使用時將甲、乙兩溶液摻混使其產生晶體,后加熱溶解。試劑3,粉劑1瓶。試劑4,粉劑1支。試劑5,粉劑4支。試劑6,GSH標準品,12.28 mg。試劑統一在4 ℃放置6個月。
BEND細胞經過培養并稀釋,1 d后離心得到上清液。首先,做預實驗,測量樣品的稀釋程度。取8支非酶管,向各管加入0.2 mL 1 mmol/L GSH,在37 ℃條件下保持5 min,加入0.1 mL試劑1,在37 ℃條件下保持5 min,最后加入3 mL試劑2和0.2 mL上清液。取8個酶管,向各管加入0.3 mL 1 mmol/L GSH和0.2 mL上清液,在37 ℃條件下保持5 min,加入0.3 mL試劑1,在37 ℃條件下保持5 min,最后加入3 mL試劑2,取上清液顯色。各取8個對照管和標準管。向對照管加入2 mL試劑3、0.5 mL試劑4、2 mL GSH溶液,0.05 mL試劑5。向標準管加入1 mL 20 μmol/L GSH溶液、2 mL試劑3、0.5 mL試劑4。將1 mL上清液分別轉移至酶管和非酶管中,并加入2 mL試劑3、0.5 mL試劑4。充分搖動均勻后,轉移到酶標平板上,每孔200 μL,每組3~5個復孔。將試管放置到酶標儀中,將其波長調整為412 nm,并在96孔板中觀察OD值。細胞上清中GSH-PX活性的計算[4]:

3 結果與分析
3.1 BHBA與PC聯合培養對BEND細胞CAT活性的測定結果
與空白組相比,單獨加BHBA組的BEND細胞隨BHBA濃度的升高CAT活性整體呈下降趨勢,其中BHBA濃度為0.6 mmol/L時BEND細胞的CAT活性顯著下降(P<0.05),BHBA濃度為1.2 mmol/L和2.4 mmol/L時BEND細胞的CAT活性極顯著下降(P<0.01),PC組和BHBA+PC組的CAT活性均上升。見圖1。
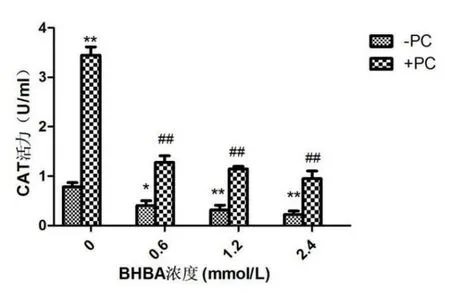
圖1 BEND細胞CAT活性
3.2 BHBA與PC聯合培養對BEND細胞GSH-PX活性的測定結果
與空白組相比,單獨加BHBA組BEND細胞隨BHBA濃度的升高GSH-PX含量整體呈下降趨勢;單獨加PC組BEND細胞的GSH-PX含量則呈現極顯著上升(P<0.01)。BHBA+PC組和其與之對應的BHBA組相比,BEND細胞的GSH-PX活性整體呈上升趨勢,其中BHBA濃度為0.6mmol/L時加PC呈現極顯著上升(P<0.01),見圖2。
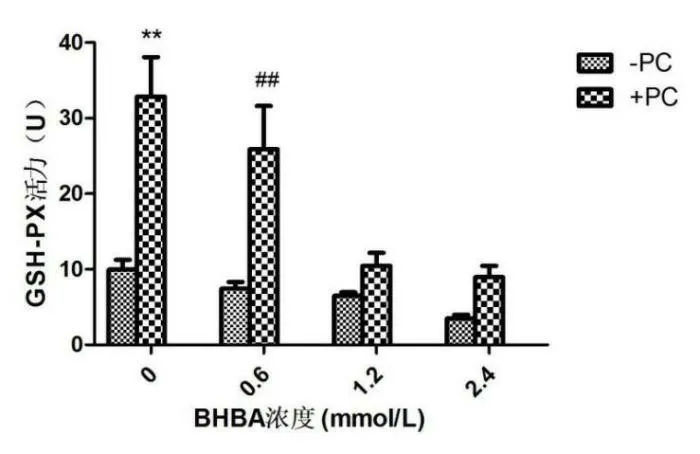
圖2 BEND細胞GSH-PX活性
3.3 測定結果分析
通過向牛子宮內膜細胞(BEND)中加入不同濃度的β羥丁酸(BHBA)及原花青素(PC),通過前期實驗確定添加藥物濃度及作用時間,測定CAT、GSH-PX等各項指標。在BHBA作用下產生的氧化產物和氧化基團使BEND發生一系列的氧化損傷[5],造成細胞的活性喪失和凋亡,PC可消除氧化產物和氧化基團,達到“中和”效果,在關鍵時刻上避免BEND發生氧化損傷。OH自由基氧化特性極為活潑,它與多種有機物都會發生快速反應,可以破壞糖、氨基酸、磷脂、核苷酸和有機酸等,因此在生物體內有較廣的反應面。抗氧化酶CAT能分解OH自由基,從而直接保護生物體細胞不受氧化作用而產生損傷,維持生物體的正常運轉和生理機能,測定CAT含量對研究生物體細胞狀態有重要意義[6-7]。
谷胱甘肽過氧化物酶(GSH-PX)是生物體內大量存在的可以分解氧化物的抗氧化酶,它特異地催化還原谷胱甘肽(GSH)的還原反應。Se的生物功能通過至少13種硒蛋白介導,作為谷胱甘肽過氧化物酶(GSHPX)的重要組成部分,它對抗氧化劑防御很重要,其補充直接影響酶的活性,測定GSH-PX活性可以作為衡量機體硒水平的一項生化指標。
4 結論
將BHBA與PC加入牛子宮內膜細胞,并測定CAT、GSH-PX等氧化指標,分析氧化指標的變化特征,研究BHBA與PC的作用機理,得出以下結論。
(1)BHBA可使牛子宮內膜細胞的活性下降,使細胞更容易氧化,發生凋亡。
(2)PC可使牛子宮內膜細胞的活性上升,清除細胞內氧化成分,保護細胞免受氧化物的損害。
(3)BHBA和PC的同時加入使牛子宮內膜細胞的活性處于單獨添加BHBA和單獨添加PC之間,說明原花青素可拮抗β羥丁酸誘發的氧化損傷,對BEND細胞起到保護作用。

