消融指數在房顫導管消融中的應用價值分析
楊明 郝應祿 梁梅 王鵬宇
隨著醫學的不斷進展,房顫的治療手段也越來越多樣化,在節律控制方面,導管消融經過多年實踐的驗證,奠定了房顫一線治療領域中的重要地位[1]。盡管消融導管等工具不斷改進,晚期肺靜脈電位恢復傳導依然是房顫復發的主要因素[2,3]。如何在安全的前提下實現肺靜脈前庭透壁性損傷、減少房顫復發[4],依然是電生理術者一直在不斷努力解決的問題。消融指數(Ablation Index,AI)是預測消融損傷質量的一個新的參數,其在加權公式中整合了貼靠壓力、功率、消融時間這3 個對消融損傷產生主要效果的參數信息,在臨床前期的研究中被發現可以準確估計消融損傷深度[5]。AI 被整合在了Carto3 三維標測系統中,房顫導管消融采用功率模式、逐點消融的方法,每個消融點均能計算出獨立的AI 值。從理論上講,設置恰當的AI 目標值可以形成足夠的消融深度,提高肺靜脈單圈隔離成功率并減少遠期肺靜脈電位傳導恢復[6],因此,本研究前瞻性探索預設的AI 目標值是否能夠在不增加手術并發癥的同時提高肺靜脈單圈隔離成功率,并減少遠期肺靜脈電位傳導恢復。
1 資料與方法
1.1 一般資料 選擇2018 年1 月~2019 年6 月就診于玉溪市人民醫院并首次行導管消融的100 例非瓣膜性陣發性房顫患者,采用隨機數字表法分為研究組和對照組,每組50 例。所有患者均簽署知情同意書。兩組一般資料比較差異無統計學意義(P>0.05),具有可比性。見表1。
表1 兩組患者一般資料比較[±s,n(%)]
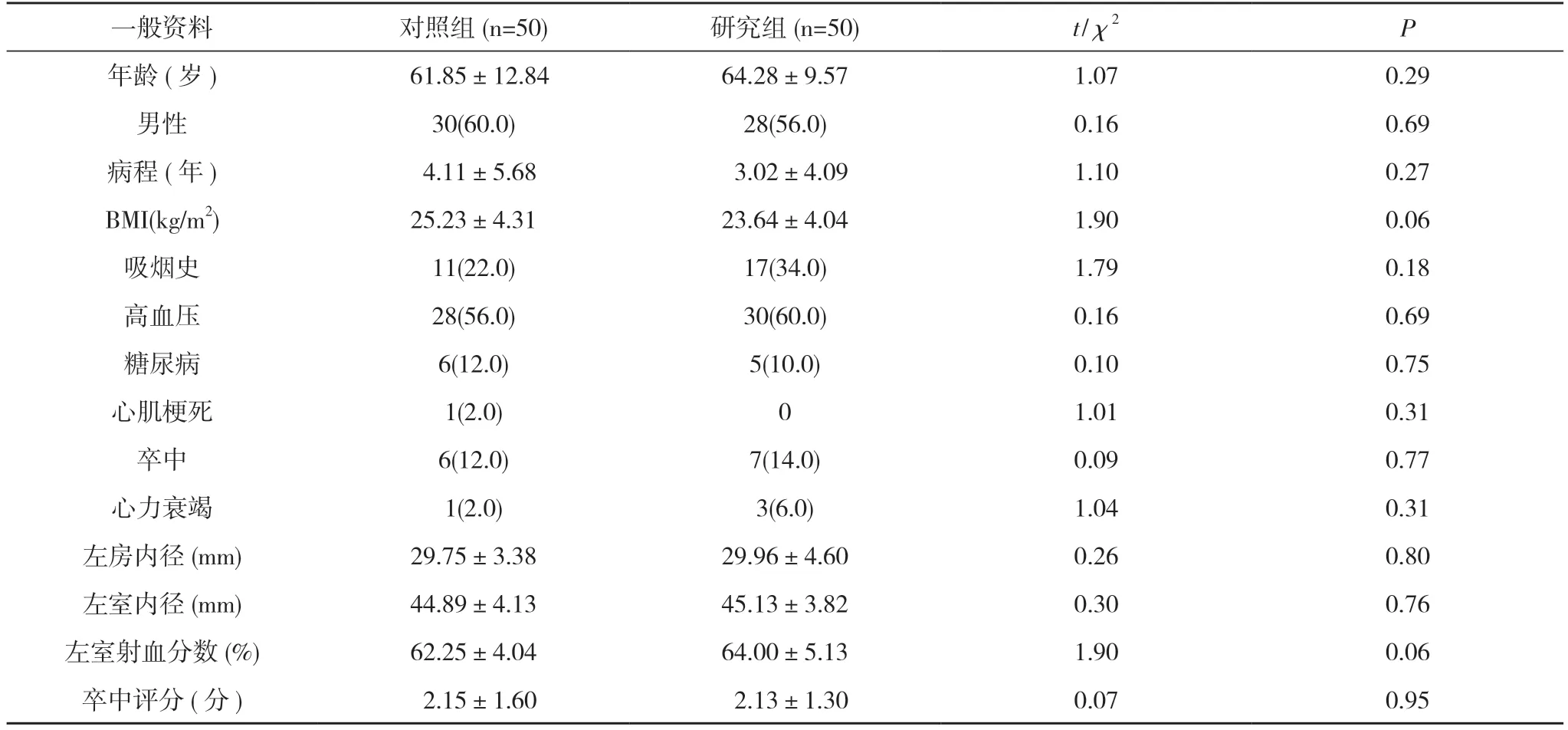
表1 兩組患者一般資料比較[±s,n(%)]
注:兩組比較,P>0.05
1.2 方法 術前48 h 行食管超聲排除左房血栓。研究組根據AI 目標值指導進行導管消融,對照組采取常規方法進行導管消融。具體如下。
所有導管消融均在局部麻醉下進行,依據患者個體條件,穿刺部位包括頸內靜脈、鎖骨下靜脈及股靜脈。在Carto3 三維標測系統指導下,使用壓力監測射頻消融導管(ThermoCool SmartTouch?,Biosense Webster),設置建模分辨率為14,直接使用消融導管在FAM 模式下構建左房及肺靜脈建剖模型。設置消融功率30~35 W,冷鹽水導管灌注流速17~30 ml/min,消融溫控43℃,導管貼靠壓力5~20 g,行雙肺靜脈前庭電隔離。消融線均應用VisiTag 模式進行標記,VisiTag采點設置為穩定時間8 s、導管位移2 mm、平均貼靠壓力5 g,關閉FOT。手術終點為Lasso 環形標測電極(Lasso,Biosense Webster)不能在肺靜脈前庭記錄到肺靜脈電位[7]。
研究組采用逐點消融的方法,VisiTag 標記消融點(VisiTag 采點設置同對照組),預設右肺靜脈前壁AI 值450,頂部及底部均為400,右上肺靜脈后壁400,右下肺靜脈后壁350,左肺靜脈頂部450,嵴部500,底部400,左下肺靜脈后壁350。見圖1。對照組亦采用逐點消融的方法,VisiTag 標記消融點,消融過程中不顯示消融點AI 值。
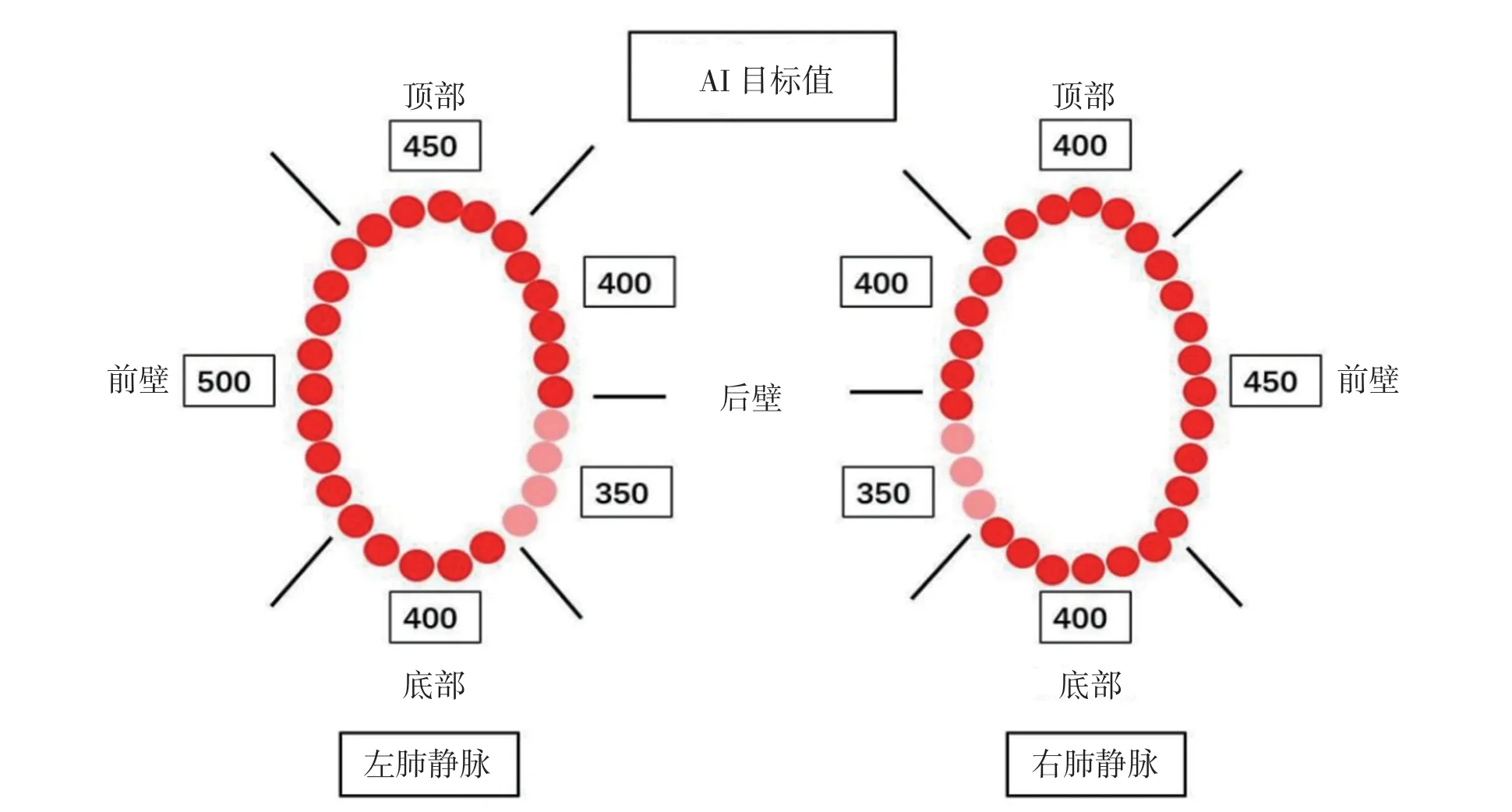
圖1 顯示雙側肺靜脈隔離消融環每個區域所使用的AI 目標值
1.3 術后隨訪及研究終點 所有患者術后6 h 均皮下注射1 次低分子肝素抗凝,其后橋接華法林或直接啟用新型口服抗凝藥,維持抗凝至少2 個月,服用華法林患者門診隨訪維持國際標準化比值(INR)在2.0~3.0 之間。術后服用β 受體阻滯劑或胺碘酮,胺碘酮至多服用3 個月。之后對患者進行門診、電話、微信等方式隨訪,要求患者術后3、6、12 個月復查心電圖及動態心電圖,期間若有心悸癥狀及時就近復查心電圖或動態心電圖。手術成功標準為導管消融術3 個月的消隱期后,無持續時間>30 s 的癥狀性或無癥狀性房性快速性心律失常發作[8]。
1.4 觀察指標及判定標準 比較兩組患者手術情況(手術時間、消融時間、放射劑量、肺靜脈完全隔離、上腔靜脈隔離、三尖瓣峽部線性消融)、術中和術后并發癥(急性心包填塞、腦梗死、食管心房瘺、肺靜脈狹窄、膈神經損傷)發生率、竇性心律維持率。
1.5 統計學方法 采用SPSS22.0 統計學軟件對研究數據進行統計分析。計量資料以均數±標準差(±s)表示,采用t檢驗;計數資料以率(%)表示,采用χ2檢驗;生存分析采用Kaplan-Meier 曲線表示。P<0.05表示差異具有統計學意義。
2 結果
2.1 消融結果 兩組患者術中均成功實現肺靜脈完全隔離;術前或術中電生理檢查發現合并三尖瓣峽部依賴典型房撲患者,一并行三尖瓣峽部線性消融;術中電生理檢查明確上腔靜脈起源房顫患者,同時行上腔靜脈隔離;兩組上腔靜脈隔離、三尖瓣峽部線性消融發生率比較差異無統計學意義(P>0.05)。研究組手術時間(88.3±27.6)min、放射劑量(24.7±12.3)mGy 與對照組的(92.7±23.1)min、(23.5±14.8)mGy 比較差異無統計學意義(P>0.05);研究組消融時間(52.8±12.6)min短于對照組的(58.9±16.4)min,差異具有統計學意義(P<0.05)。見表2。
表2 兩組患者手術情況比較[ ±s,n(%)]
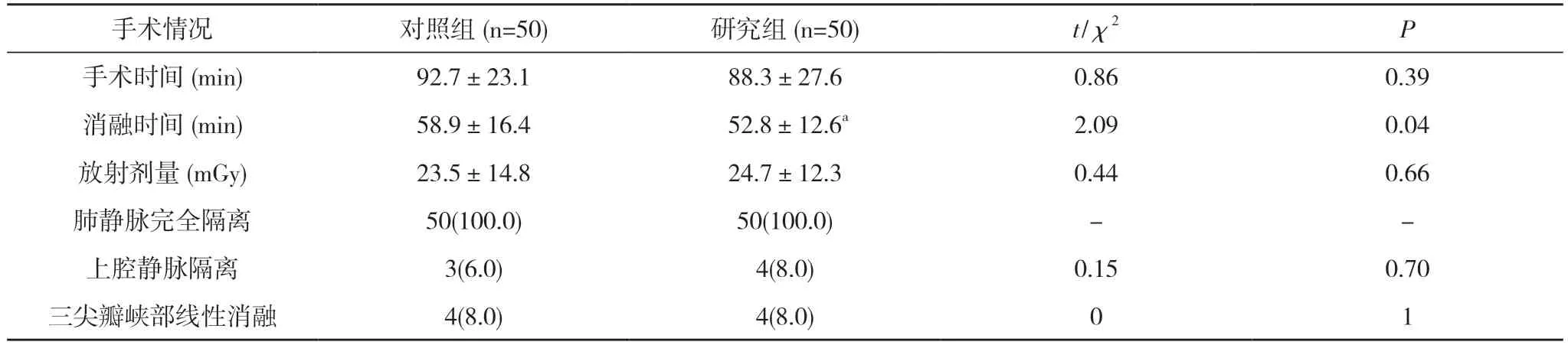
表2 兩組患者手術情況比較[ ±s,n(%)]
注:與對照組比較,aP<0.05;“-”表示無數據
2.2 并發癥 所有接受導管消融的房顫患者中,急性心包填塞發生率為1.0%(1/100),心包穿刺引流后血流動力學恢復穩定,術后24 h 拔除心包引流管。未觀察到腦梗死、食管心房瘺、肺靜脈狹窄、膈神經損傷等消融相關并發癥。兩組患者急性心包填塞發生率比較差異無統計學意義(P>0.05)。見表3。
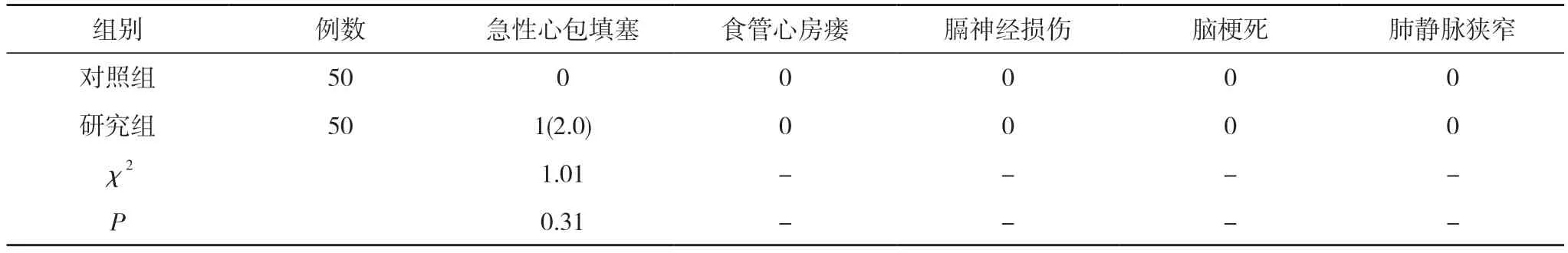
表3 兩組患者并發癥發生率比較[n(%)]
2.3 隨訪結果 經過12 個月的隨訪,對照組有44 例(88.0%)維持竇性心律,研究組有43 例(86.0%)維持竇性心律。兩組患者竇性心律維持率比較差異無統計學意義(χ2=0.09,P=0.77>0.05)。兩組患者術后12 個月隨訪中無心律失常生存的Kaplan-Meier 曲線見圖2。
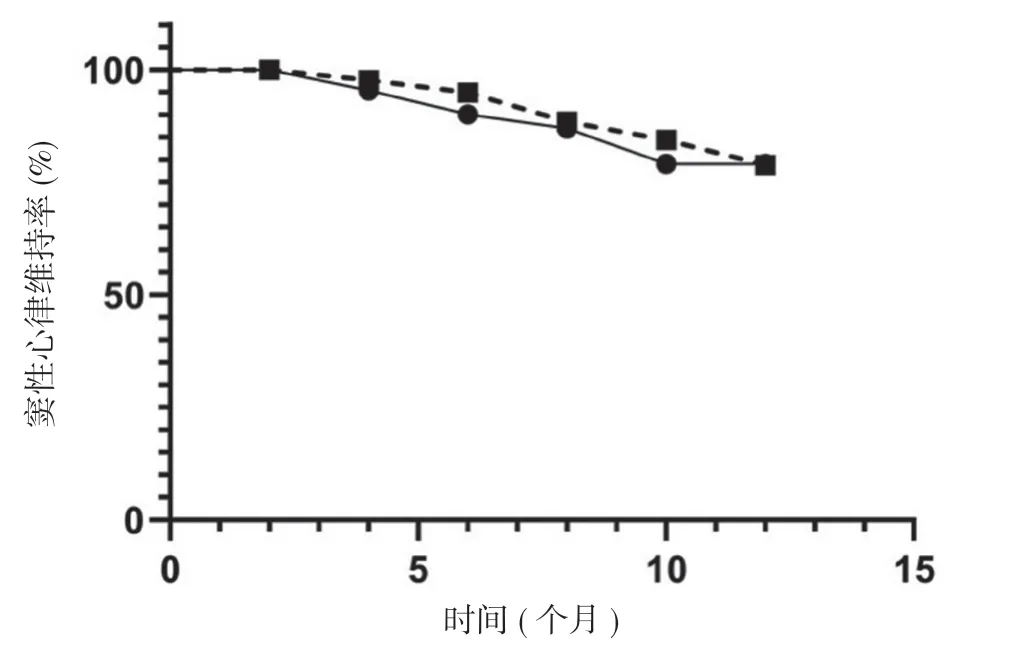
圖2 兩組術后12 個月隨訪中無心律失常生存的Kaplan-Meier 曲線
3 討論
本研究目的在于探究使用預設的AI 目標值是否能在不增加并發癥的前提下提高術后竇性心律維持率,經過1 年的隨訪發現,使用本研究預設的AI 目標值并沒有提高術后竇性心律維持率。盡管一些研究顯示形成一定深度的消融損傷需要足夠的導管貼靠力[9,10],但是僅依靠壓力貼靠這一指標并不一定能改善結果,因為消融損傷深度不僅僅取決于導管與組織的接觸,還取決于能量施加和能量輸送的持續時間[11-14]。AI以加權方程的方式將壓力貼靠、消融功率以及消融時間結合在一起,在動物模型中顯示AI 值與消融深度相關[15]。
眾所周知,左房各部位厚度有較大差異,左肺靜脈嵴部較厚,而頂部和后壁稍薄[16],因此,如何預設合適的AI 值,既能保證消融的透壁性,又避免臨近臟器的損傷,不同電生理中心方法和經驗都有差異。國內大部分電生理中心大多根據經驗預設左房不同消融部位的AI 值,不同術者根據長期實踐再進行調整。若手術中發現預設的AI 值不能實現阻滯,則在接下來的實踐中逐漸增加該部位的AI 值,直到取得理想的消融結果。以往的實踐中,術者通過局部電位變化來判斷消融效果[17],相當一部分病例術中雖然實現了肺靜脈電位的隔離,但是在隨訪過程中房顫復發,晚期肺靜脈電位傳導恢復被認為是一個主要的原因[18]。要實現肺靜脈電位的永久性隔離,那么就必須達到足夠深度的消融損傷[19,20]。AI 作為一種判斷消融深度的方法,隨著個人實踐的不斷拓展,數據的不斷積累,在手術操作中逐漸增加AI 目標值,就有可能達到更理想的消融結果。
當然,從應用中也體會到,對于不同的術者、不同的患者而言,其預設的AI 值也有差異。首先,肺靜脈前庭隔離的消融線偏肺靜脈或者偏心房,不同術者就存在差異。消融線偏肺靜脈,心房壁較薄,那么較低的AI 值就能實現阻滯,若選擇的消融線偏心房,由于心房壁較厚,就需要更高的AI 值才能實現阻滯。因此,不同術者應該根據自己的操作經驗逐漸摸索、調整合適的AI 預設值。另外,由于沒有較合適的工具進行左房不同部位的心房壁厚度測量,對不同年齡、性別、體重的患者均采用相同的AI 預設值是否恰當也值得探討。本研究發現,部分低體重、尤其是女性患者,在足夠的壓力貼靠下,往往較短的放電時間、較低的AI 值就能實現肺靜脈前庭的隔離,而體重較重的患者如果按照一般AI 值進行消融,很難實現單圈隔離。因此,在臨床應用中如何更好地結合性別、年齡、體重、甚至局部阻抗變化等因素,進行個體化的AI 值設定,也是值得探索的內容。
若按照預設AI 值不能實現局部阻滯,在第二次接受手術或補點消融時,可根據術者經驗逐漸增加AI 值,直至達到滿意的消融結果。但是,在應用AI 進行房顫導管消融的過程中,尚無有效的手段判斷對于不同部位是否存在過度消融的情況。因此,AI 并不一定能減少房顫導管消融中消融相關并發癥。
本研究中,盡管兩組手術時間、放射劑量比較差異無統計學意義(P>0.05);但研究組消融時間(52.8±12.6)min 短于對照組的(58.9±16.4)min,差異具有統計學意義(P<0.05)。回顧分析發現AI 指導下的消融點在導管壓力貼靠偏小的情況下往往放電時間會延長,這樣導致該點的消融損傷更深,更有助于實現永久性透壁損傷。若沒有實現單圈隔離的肺靜脈,在進行補點消融時,也可以優先到AI 值偏低的區域尋找漏點,一定程度上也能為術者提供方便。
在AI 指導下進行陣發性房顫的導管消融,不一定能提高房顫導管消融術后竇性心律維持率。但是,通過術者根據個人應用體會逐漸調整AI 預設值,進行自我反饋,能夠逐步提高肺靜脈單圈隔離的成功率。AI作為一種對消融損傷進行量化的工具,在臨床實踐不斷的自我反饋、經驗總結中,有可能提高肺靜脈永久阻滯的機會,從而實現術后更高的竇性心律維持率。應用AI 是否能降低消融相關并發癥,則需要更多研究來進一步探索。

