Cx32、Src/FAK 信號通路在肝癌組織中的表達及其與肝癌術后患者預后的關系
余美玲 馬翔 董淑英 童旭輝
肝細胞癌(肝癌)是我國第四高發的惡性腫 瘤,其致死率在所有惡性腫瘤中排名第二[1]。細胞縫隙連接(GJ)是細胞之間的一種蛋白質連接通道,由特殊的通道蛋白[連接蛋白(Cx)]組成[2]。研究顯示,腫瘤的發生、發展過程往往伴隨著Cx表達的降低或者缺失,而上調或恢復腫瘤細胞中的Cx 表達水平,可抑制腫瘤細胞的生長、分化,降低細胞的侵襲、轉移能力,逆轉耐藥[3-6]。Cx32在正常肝細胞表達的主要連接蛋白中占90%,是肝細胞縫隙連接最主要的結構基礎[7]。在肝癌的發生、發展過程中,Cx32 表達水平會明顯下降[7]。Src/局部黏著斑激素(FAK)信號通路在多種腫瘤細胞中持續性激活,Src 是一種相對分子量為60 kDa 的非受體酪氨酸激酶。對于人源的Src 而言,主要的磷酸化位點包括激酶區負責活化的pTyr416位點和C 端尾鏈抑制性的pTyr530 位點。當激活時,Src 在酪氨酸殘基 416 位點自磷酸化,因此在本研究中主要分析了p-Src Y416 的表達水平。Src可以激活Src 蛋白的細胞質復合物蛋白,如FAK。人FAK 含有6 個可以被磷酸化的酪氨酸,Tyr397、Tyr407、Tyr576、Tyr577、Tyr861、Tyr925。 筆 者在前期研究證實,肝癌細胞中Cx32 是Src/FAK 信號通路的上游調控因子[4]。為進一步探討Cx32、Src/FAK 信號通路在預測肝癌患者預后中的作用,本研究在前期研究的基礎上對97 例接受肝癌根治性手術的患者進行隨訪,分析肝癌組織中Cx32、Src/FAK 的表達水平與患者預后之間的關系。
對象與方法
一、研究對象
收集2014 年1 至12 月在蚌埠醫學院第一附屬醫院肝膽外科接受根治性手術的97 例患者的肝癌組織標本和相應的癌旁組織標本(距離肝癌病灶2 cm 的肝組織)。所有標本均經中性甲醛固定,常規石蠟包埋, 5 μm 厚連續切片。所有患者術前都未接受放射治療、化學治療和免疫治療等相關治療。對患者進行隨訪,隨訪時間至2019 年12月,最終入組97 例。本研究方案經蚌埠醫學院倫理委員會批準(批件號:[2020]第120 號),患者均已簽署知情同意書。
二、方 法
1. 臨床資料收集
收集97 例患者的臨床資料,包括年齡、性別、是否肝硬化、是否乙型肝炎、腫瘤最長直徑、有無包膜、甲胎蛋白水平、腫瘤分化程度、生存與否或死亡時間。分層分析時將肝癌分化程度依據《肝臟活檢病理解讀(第2 版)》分為高分化(肝癌組織接近正常組織,惡性程度低)、中分化(肝癌組織與正常組織差別不大,中度成熟,中度惡性程度)、低分化(肝癌組織與正常組織相差大,成熟度差,惡性度高)3 種情況;根據甲胎蛋白水平分為 ≤400 μg/L 和> 400 μg/L 2 種情況。
2. 免疫組織化學(免疫組化)染色法檢測
使用免疫組化染色法檢測Cx32、磷酸化-Src(p-Src)Y416、 總Src(total Src)、 磷 酸 化FAK(p-FAK)Y925、總FAK(total FAK)在肝癌組織以及相應癌旁組織中的蛋白表達:取病理組織切片脫蠟,梯度乙醇水化,枸櫞酸鹽緩沖液(pH =6.0)高溫修復,3% 過氧化氫阻斷內源性過氧化物酶后滴加血清封閉;然后將切片與一抗在4 ℃孵育過夜,復溫后滴加二抗室溫下孵育 15 min,二氨基聯苯胺顯色5 min;蘇木精復染,脫水透明后中性樹膠封片。以細胞內出現黃色或棕黃色顆粒為陽性表達,按陽性細胞所占百分比評分:<5%為(-),5%~10% 為(+),11%~50% 為(++),51%~75%為(+++),>75%為(++++)[8]。分層分析時將不表達和表達(+)歸為低表達,表達(++ ~++++)歸為高表達。
三、統計學處理
使用SPSS 20.0 對數據進行統計分析,計數資料采用配對χ2檢驗。采用單因素Cox 回歸分析收集到的肝癌手術患者的各項指標與肝癌術后患者的生存預后是否有關。將單因素Cox 回歸分析結果中有統計學意義的指標納入多因素Cox 回歸模型(納入法),分析肝癌術后患者生存的影響因素。通過繪制生存曲線(Kaplan-Meier 法)以及對數秩檢驗(Log-rank test)探討Cx32、p-Src Y416、p-FAK Y925 蛋白表達與患者生存時間的關系。P <0.05 為差異有統計學意義。
結 果
一、研究對象的基本信息
97 例肝癌患者中,男72 例、女25 例,年齡25~78 歲、中位年齡55 歲;肝硬化77 例(79%),乙型肝炎66 例(68%);甲胎蛋白> 400 μg/L 28例(29%);低分化17 例(18%),中分化70 例(72%),高分化10 例(10%);肝癌標本無包膜82 例(85%);腫瘤最大直徑> 5 cm 54 例(56%);隨 訪5 年 最 終 生 存55 例(57%), 死 亡42 例(43%)。
二、Cx32、Src/FAK 蛋白在肝癌組織以及相應的癌旁組織中的表達情況
免疫組化染色結果顯示,肝癌組織的Cx32蛋白表達陽性率低于相應的癌旁組織,其p-Src Y416、 total Src、 p-FAK Y925、total FAK 的蛋白表達陽性率均高于相應的癌旁組織(P 均< 0.05),見表1 及圖1。97 例肝癌組織以及相應癌旁組織中各蛋白的具體表達情況見表2。
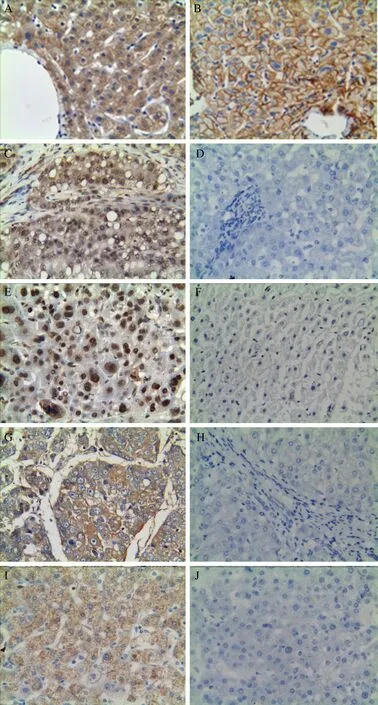
圖1 肝癌組織與癌旁組織的Cx32、p-Src Y416、p-FAK Y925、total Src、total FAK 蛋白表達比較(免疫組化染色,×200)
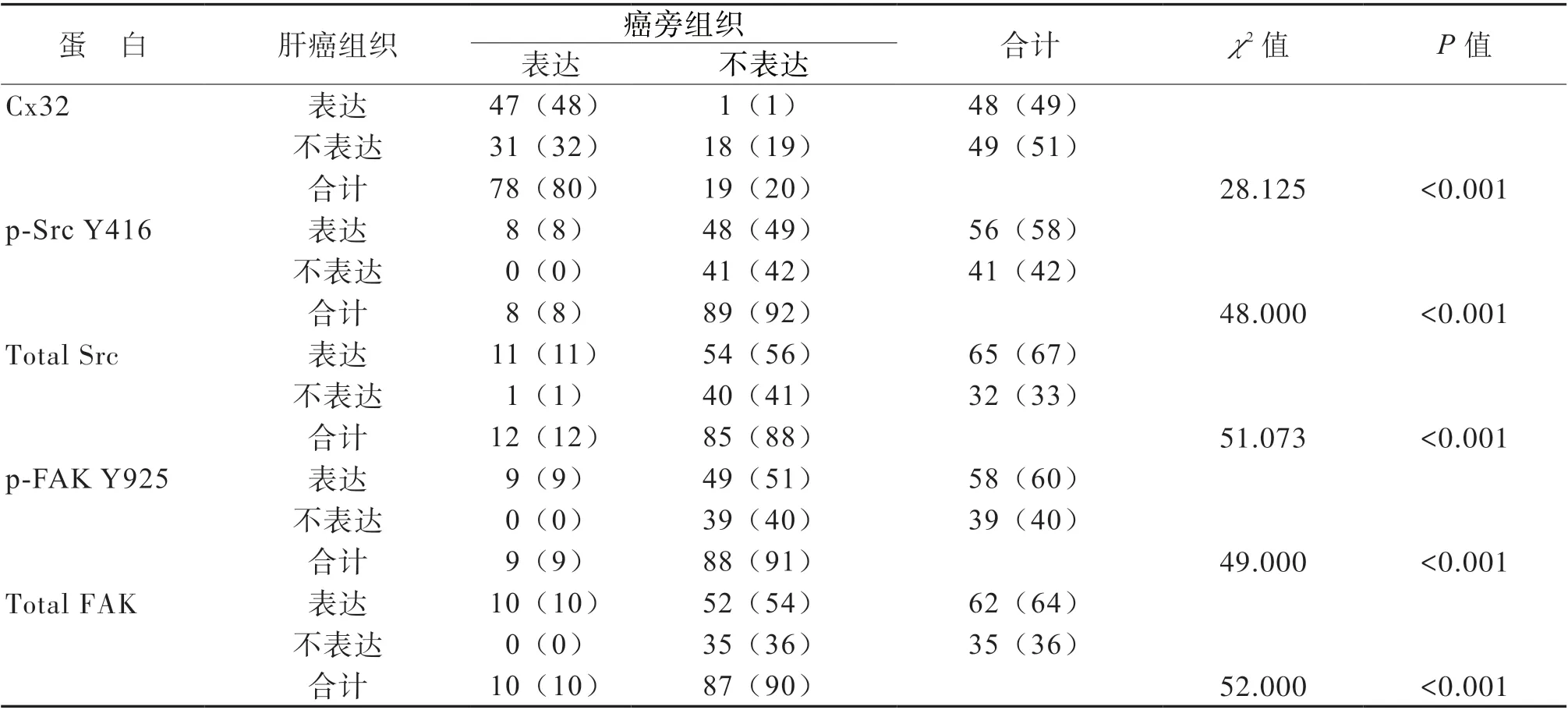
表1 97 例肝癌組織以及相應的癌旁組織中Cx32、Src/FAK 蛋白的表達情況[例(%)]

表2 97 例肝癌組織以及相應的癌旁組織中Cx32、Src/FAK 蛋白的具體表達情況[例(%)]
三、97 例肝癌根治性術后患者死亡的單因素和多因素Cox 回歸分析結果
單因素回歸分析顯示,肝癌患者死亡有8 項可疑影響因素,分別為年齡、腫瘤分化程度、腫瘤直 徑、Cx32、p-Src Y416、total Src、p-FAK Y925、total FAK 蛋白的表達(P 均< 0.05)。多因素回歸分析顯示,性別、甲胎蛋白> 400 μg/L、乙型肝炎、包膜、腫瘤長徑和total FAK 的蛋白表達均非肝癌患者死亡的影響因素(P 均> 0.05)。高表達Cx32 的肝癌患者死亡的風險可能為低表達Cx32 患者的12%(P < 0.05);高表達p-Src 的肝癌患者死亡的風險是低表達p-Src 肝癌患者的14.306 倍(P< 0.05);高表達p-FAK 的肝癌患者死亡的風險是低表達p-Src 肝癌患者的12.152 倍(P < 0.05)。另外,年齡和高表達Total Src 為獨立危險因素,中分化(與低分化對照)為獨立保護因素(P 均<0.05),見表3。
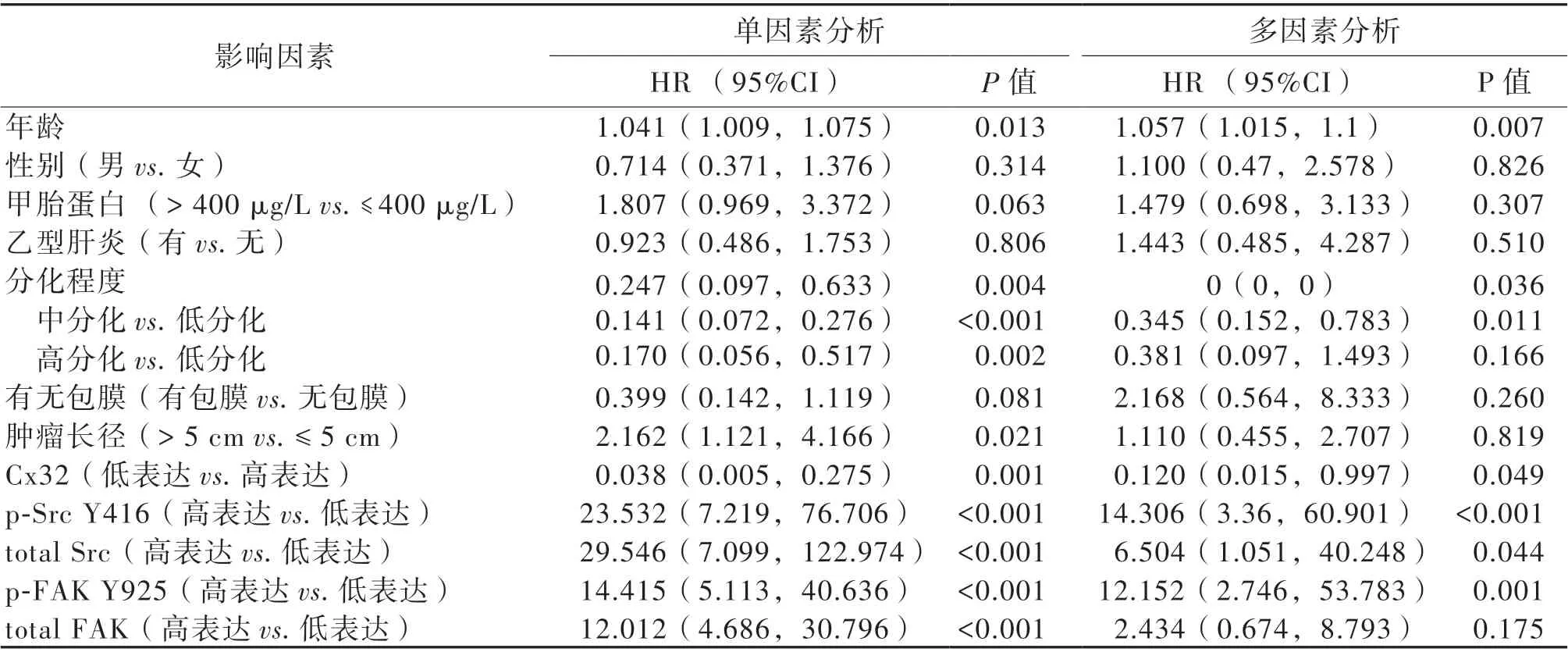
表3 97 例肝癌患者單因素和多因素分析結果
四、Cx32、p-Src Y416、p-FAK Y925 與97例肝癌術后患者總體生存時間的關系
生存分析顯示,肝癌患者中Cx32 高表達者與Cx32 低表達者的生存率分別為46.39%、10.31%(log-rankχ2= 23.856,P < 0.001);p-Src Y416 低表達者與p-Src 高表達者的生存率分別為45.36%、11.34%(log-rankχ2= 56.637,P < 0.001);p-FAK Y925 低表達者與p-FAK Y925 高表達者的生存率分別為42.27%、14.43%(log-rankχ2= 43.599,P <0.001),見圖2。
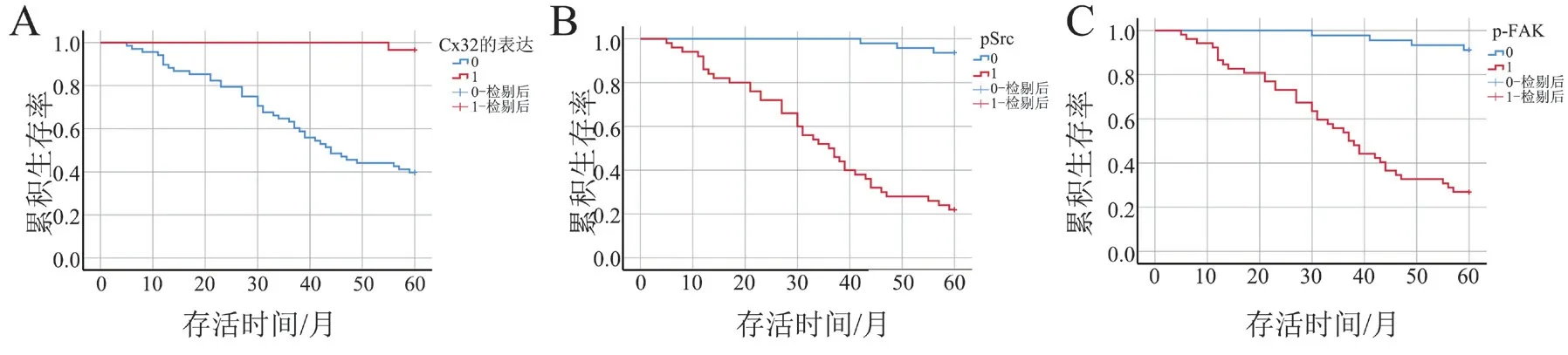
圖2 Cx32、p-Src Y416、p-FAK Y925 的生存曲線(Kaplan-Meier 法)
討 論
Cx32 是肝癌細胞最主要的連接蛋白。研究證實,Cx32 表達下降會促進肝癌的進展、化學治療耐藥,提高腫瘤的侵襲、轉移能力[3-4,7]。但Cx32能否作為肝癌的預后預測因子還有待于進一步驗證。Sheen 等(2004 年)的研究顯示,低表達Cx32 mRNA 的肝癌術后患者預后差,但該研究樣本量僅34 例。本研究共收集并成功隨訪97 例肝癌患者,驗證了與低表達Cx32 的患者相比,高表達Cx32 可能是肝癌患者術后死亡的獨立保護因素,Cx32 有望成為預測肝癌術后患者預后的標志蛋白。
Src/FAK 信號通路在多種腫瘤細胞中持續性激活[9-10]。Src 在細胞外可以激活Src 蛋白的細胞質復合物蛋白,如FAK 等,Src-FAK 復合物與許多底物的復合物相互作用,包括Crk 相關基質、樁蛋白和p190RhoGAP, 他們在細胞的生長、增殖過程中起重要作用。Src 也可以通過SH2 區域與FAK的C 末端酪氨酸殘基結合而磷酸化而使FAK 激活,激活的FAK 調節B1 整聯蛋白的活性,調節腫瘤細胞的生長、增殖。Src/FAK 信號通路的激活可促進腫瘤的侵襲、轉移、化學治療耐藥,筆者前期研究顯示,Src/FAK 信號通路的激活會促進肝癌細胞對多柔比星產生耐藥[4]。但Src/FAK 信號通路與肝癌患者生存預后的關系仍有待于進一步探討。Chen 等(2011 年)的研究顯示高表達的p-Src Y416 是肝癌患者死亡的獨立危險因素,低表達患者有更長的生存期。本研究顯示,高表達p-Src Y416、p-FAK Y925 是肝癌患者死亡的獨立危險因素,進一步明確了Src/FAK 信號通路與肝癌術后患者生存預后的關系。
結合筆者既往研究,本研究表明Src 是Cx32在腫瘤細胞中重要的下游調控因子。Sato 等(2007年)研究顯示,Cx32 可以通過抑制腎癌細胞Src的活性而抑制腫瘤的侵襲;Fujimoto 等(2005 年)通過Src-STAT3 信號通路抑制血管內皮生長因子介導的血管生成;Hada 等(2006 年)研究顯示,Cx32 通過抑制A549 肺腺癌細胞Src 的活性而抑制腫瘤細胞的增殖及遷移;Sato 等(2013 年)研究表明Cx32 還可以通過抑制Src 的活性來增加長春堿在人腎細胞癌中的毒性作用。上述研究均說明,Cx32 可通過影響Src 的活性而調控腫瘤細胞的生長、分化、侵襲、轉移以及化學治療的細胞毒性。但在肝癌細胞中Cx32 如何調控Src/FAK 信號通路尚未闡明。Finn 等(2008 年)報道,Src 能被胞質中的蛋白激活,因此推測隨著肝癌的發生、發展、耐藥的發生,Cx32 會從細胞膜上異位至胞質中,從而激活Src,下一步我們將進行研究驗證該推測。
由于本研究中Cox 多因素回歸分析中,高表達Cx32 對肝癌術后患者的影響P 值為0.049,故本研究進一步分析Cx32、Src/FAK 信號通路與接受肝癌根治性手術后患者生存預后的關系,結果顯示,低表達Cx32、高表達p-Src Y416、p-FAK Y925 患者生存預后差,患者中位生存期明顯縮短,Cx32、p-Src Y416、p-FAK Y925 可能為肝癌術后患者預后的標志。
本研究雖初步證實了肝癌組織中低表達Cx32、高表達p-Src Y416、p-FAK Y925 是肝癌患者預后的獨立危險因素,但樣本量仍偏小,后續研究中將繼續增加樣本量,收集多中心的臨床數據和標本,并設置更長的隨訪期,進一步探討Cx32、Src/FAK 信號通路與肝癌術后患者臨床預后的關系,明確Cx32、p-Src Y416、p-FAK Y925 是否能作為肝癌術后患者預后的標志蛋白。

