USP39通過HMGA2調控膠質瘤細胞增殖和遷移的作用機制
李軍 劉小江 管誠 管義祥 丁錦榮
(南通大學附屬海安醫(yī)院神經外科,江蘇 海安 226600)
惡性膠質瘤是成人最常見的侵襲性和致死性原發(fā)性腦腫瘤〔1,2〕。盡管治療取得了巨大進展,但惡性膠質瘤患者的中位生存期為14.5~16.6個月〔3〕。目前主要治療方法是手術切除腫瘤為主,結合放療和化療,由于特征復雜,包括侵襲性生長和彌漫性侵襲,其治療效果欠佳,易復發(fā),預后較差。近年來,許多研究工作集中在疾病的分子基礎上,目的是將這種更好的理解轉化為可行的治療方法〔4〕。
泛素特異性蛋白酶(USP)39是一個基于Dub結構域序列相似性分類的去蛋白家族成員。由于Dub結構域中沒有保守的活性位點殘基(半胱氨酸、組氨酸和天冬氨酸),USP39完全喪失了去氫脫氮活性〔5〕。USP39在酵母中也被稱為Sad1p,在人類中被稱為65 kD SR相關蛋白,這兩種蛋白都與成熟剪接體復合體的組裝有關,表明在mRNA剪接中起作用〔6〕。以前的研究已經證明USP39參與了極光激酶B轉錄的剪接〔5〕。斑馬魚USP39突變誘導視網膜母細胞瘤mRNA剪接缺陷基因rb1〔7〕。據報道,USP39也是EGFR前mRNA剪接的關鍵調節(jié)因子〔8〕。目前,有研究報道USP39在胃癌、卵巢癌、乳腺癌等癌癥中異常表達,其促進腫瘤發(fā)生和發(fā)展的生物學過程,包括增殖遷移、轉移和凋亡等〔9〕。USP39在膠質瘤中的表達和生物學作用尚未闡釋清楚。高遷移率族蛋白(HMG)A2和蛋白或DNA發(fā)揮作用,繼而參與轉錄調控發(fā)揮生物學功能〔10〕。在多種惡性腫瘤組織中表達失調,屬于原癌基因,與腫瘤的惡性程度和分期預后具有相關性〔11,12〕。然而,USP39-HMAGA2在膠質瘤中的作用尚未明確。本研究通過檢測膠質瘤組織中USP39的表達,分析其與臨床病理因素之間的相關性,進一步研究其對膠質瘤細胞增殖、遷移、侵襲能力的影響及其作用機制。
1 材料與方法
1.1材料 人膠質瘤細胞株LN18、U87MG、A172、U251、P3及神經膠質細胞系(HA)均購自中國科學院(上海)。USP39和HMGA2抗體購于美國cell signaling公司。Matrigel是美國BD公司。Tanswell小室購于美國康寧。Lipofectamine 2000是美國Invitrogen。
1.2患者臨床資料分析 收集2018~2020年海安市人民醫(yī)院膠質瘤組織及其癌旁正常組織各112例。統(tǒng)計分析所有患者的臨床病理資料,檢測USP39的表達水平,將112例患者分為USP39低表達組和USP39高表達組,分析兩組年齡、性別、腫瘤直徑、淋巴結轉移情況、病理分期。本研究通過醫(yī)院倫理委員會的同意。
1.3細胞培養(yǎng) 所有細胞在添加10%胎牛血清(FBS)的DMEM中培養(yǎng)。細胞保持在37℃,在含有5% CO2的細胞培養(yǎng)箱中。
1.4USP39干擾及細胞轉染 針對USP39基因設計特異性siRNA。當細胞A172和P3細胞貼壁密度達到70%左右時,接種于6孔板中,待細胞密度達到75%左右時,采用Lipofectamine 200轉染試劑盒進行轉染,分別將NC、敲降USP39轉染至細胞中。放入細胞培養(yǎng)箱繼續(xù)培養(yǎng),48 h后開始后續(xù)實驗。
1.5CCK-8檢測細胞增殖 細胞接種于96孔×5個培養(yǎng)皿中過夜。根據制造商說明,添加CCK-8溶液(Dojindo;日本熊本)以每24 h評估細胞活力。在微板閱讀器(PerkinElmer;加利福尼亞州圣何塞,美國)中,在450 nm處測量樣品。
1.6Transwell小室檢測細胞遷移和侵襲 將細胞(2×104/孔)接種到transwell小室(孔徑:8 μmol/L;康寧的上腔中Costar;Tewksbury,MA,USA)和含有30%FBS(600 μl)的培養(yǎng)基加入下室。培養(yǎng)箱在37℃下培養(yǎng)24~36 h,并固定細胞4%多聚甲醛,結晶紫染色(Solarbio;中國北京)。從每口井的5個隨機場(×100)獲得圖像。所有實驗一式3份。細胞侵襲實驗在Transwell小室內加入Matrigel基質膠,其余實驗方法與遷移實驗相同。
1.7RT-PCR檢測組織和細胞中mRNA表達水平 根據制造商的說明,使用TRIzol試劑(Takara;日本東京)進行細胞和組織RNA分離。分離的總RNA被量化,并使用逆轉錄試劑盒(Toyobo;大阪,日本)生成cDNA。mRNA水平用實時PCR定量。GAPDH作為內部控制。采用以下引物:GAPDH上游引物:5′-GCACGTCAAGCTGAAAC-3′;下游引物:5′-TGGTGAAGAGCCAGAGGA-3′;USP39上游引物:5′-TGACCTCATTCATGCCACATCGT-3′;下游引物:5′-TTGCCTGTCCCATGATGAAGC-3′;HMGA2上游引物:5′-ACCCAGGGGAAGACCCAAA-3′;下游引物:5′-CCTCTTGGCCGTTTTTCTCCA-3′。
1.8Western印跡檢測蛋白表達 細胞和組織在含有蛋白酶抑制劑的RIPA裂解中溶解。離心取上清,二喹啉甲酸(BCA)蛋白定量試劑盒進行蛋白定量。蛋白質裂解物(20 μg)行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE),并轉移到聚偏二氟乙烯膜上。在5%脫脂牛奶中封閉膜,并在4℃下用一級抗體孵育過夜,然后用二級抗體(ZSGB-BIO)孵育。使用化學發(fā)光試劑盒(Millipore;Billerica,MA,USA)觀察膜上的蛋白質。并使用Image J軟件(Bio-Rad)進行量化。所有實驗重復3次。
1.9統(tǒng)計學分析 采用SPSS13.0統(tǒng)計學軟件進行單因素方差分析。
2 結 果
2.1USP39在膠質瘤組織和細胞中表達升高 qRT-PCR 檢測結果表明,USP39在112例膠質瘤組織中mRNA表達水平高于癌旁正常組織 (3.73±0.89 vs 1.18±0.53,t=26.052,P<0.001)。在人腦膠質瘤細胞P3、U87MG、U251、A172和LN18中的mRNA表達水平顯著高于HA細胞(P<0.05)。USP39在人腦膠質瘤細胞P3、U87MG、U251、A172和LN18中的蛋白表達水平顯著高于HA細胞(P<0.05)。見表1、圖1。
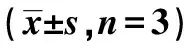
表1 USP39在HA、P3、U251、U87MG、LN18和A172中細胞中mRNA蛋白的表達水平

圖1 USP39蛋白在膠質瘤細胞中的表達
2.2USP39表達與膠質瘤患者臨床病理因素的相關性 USP39的表達與膠質瘤分級具有相關性(P<0.001)。見表2。

表2 USP39表達與膠質瘤患者的臨床病理特征的相關性(n)
2.3敲降USP39抑制膠質瘤細胞增殖 為了進一步研究USP39在膠質瘤發(fā)生發(fā)展中的生物學功能,我們在A172(NC組1.01±0.12,sh-USP39 0.34±0.16)和P3(NC組1.09±0.15,sh-USP39 0.37±0.16)細胞中通過慢病毒短發(fā)夾(shRNA)敲降USP39的表達。如圖2所示,轉染效率通過RT-PCR和Western印跡驗證轉染效果成功。采用CCK-8檢測分析細胞增殖曲線的變化,如表3所示,敲降USP39后顯著抑制了A172和P3細胞的增殖能力。因此,敲降USP39抑制膠質瘤細胞增殖。

圖2 敲降USP39后細胞中USP39蛋白的表達

表3 不同時間各組細胞活性分析(450 nm OD值)
2.4敲降USP39抑制膠質瘤細胞的遷移和侵襲 Transwell遷移實驗結果表明,敲降USP39可以顯著抑制A172和P3細胞的遷移、侵襲能力,與對照組相比,遷移、侵襲細胞數(shù)量顯著減少(P<0.05)。見圖3、表4。

表4 敲降USP39抑制膠質瘤細胞的遷移和侵襲變化個,n=3)
2.5USP39調控HMGA2的表達 敲降USP39可以顯著抑制A172和P3細胞中HMGA2蛋白表達(0.32±0.07、0.29±0.08),與對照組(0.97±0.09、1.03±0.07)相比差異顯著(P<0.05)。見圖4。

圖4 敲降USP39后細胞HMGA2蛋白表達
3 討 論
以往研究顯示,USP39有助于癌癥的進展,并預測各種腫瘤的不良預后〔13,14〕。同時有研究表明USP39在多種癌癥中異常表達〔15,16〕。本研究發(fā)現(xiàn)USP39蛋白水平的升高與膠質瘤分級有關。
有研究發(fā)現(xiàn)USP39促進卵巢癌細胞增殖和遷移等生物學功能〔17~20〕。本研究結果證明敲降USP39后顯著抑制了A172細胞的增殖和遷移能力;過表達USP39有效地促進了U251細胞的增殖和遷移能力。
HMGA2位于染色體12q13-15上,參與多種生物發(fā)育的生物學過程〔21〕。HMGA2在腫瘤的發(fā)生和發(fā)展中也起到重要作用〔22〕。USP39調控下游的HMGA2,通過3′剪接位點改變剪接。過表達USP39可以使HMGA2的截斷型轉錄升高。本研究發(fā)現(xiàn)過表達USP39可以顯著抑制HMGA2的蛋白表達。
綜上,在人腦膠質瘤組織和細胞中USP39高表達,且能促進膠質瘤的惡性腫瘤特性。因此,USP39在人類膠質瘤發(fā)育過程中似乎具有致癌特性。本研究進一步證明USP39的致癌活性是由于其能夠調控HMGA2。

