辛酸甲酯與正丁醇在低速柴油機中的氮氧化物排放特性仿真分析
田策,姚麗
(上海海事大學 商船學院,上海 201306)
辛酸甲酯與生物柴油的主要特性指標相似,有學者探究了辛酸甲酯(MO,CHO)的化學反應機理,通過射流攪拌器(JSR)裝置對辛酸甲酯與正丁醇混合燃料進行氧化動力學實驗研究,提出其動力學反應機理,確定可以選辛酸甲酯作為生物柴油替代燃料進行燃燒模擬。
因為生物柴油的含氧特性,在燃燒過程中會促進NO的生成,從而導致NO排放增加。均質充量壓燃(homogeneous charge compression ignition,HCCI)模型因NO排放低和燃燒效率高的特點備受關注。均勻的空氣和燃料混合氣引入氣缸,然后活塞壓縮混合氣使之升溫到一定程度自行燃燒,同時氣缸內沒有明顯的火焰傳播。這些特點導致較低的NO和顆粒物排放,同時保持高的熱效率。
考慮將生物柴油替代燃料辛酸甲酯與不同比例正丁醇混合形成的混合燃料和船用低速柴油機相結合,采用HCCI燃燒提升發動機燃燒效率,以達到降低船用低速柴油機NO排放的目的。計算辛酸甲酯與正丁醇不同混合比例的情況下NO體積分數隨曲柄轉角的變化關系,并詳細分析NO在反應器內的轉化情況。同時計算不同工況下,1∶1混合比例的混合燃料HCCI燃燒的氮氧化物排放特性。
1 分析的思路及方法
1.1 發動機參數與反應機理
選取MAN B&W 6S35ME-B9型船用低速柴油機作為分析對象,通過CHEMKIN軟件的HCCI反應器進行燃燒仿真。仿真計算的發動機參數均來源6S35ME-B9型發動機,其規格及主要參數見表1。
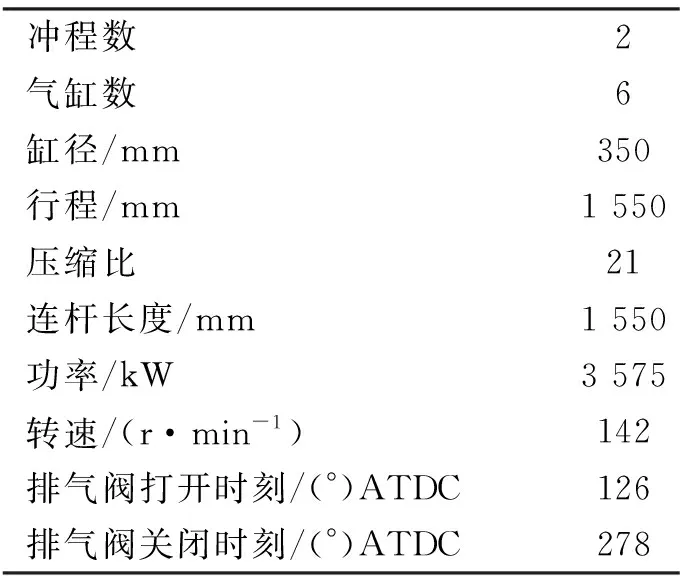
表1 6S35ME-B9型發動機規格及主要參數
仿真計算采用辛酸甲酯與正丁醇混合的反應機理來源于文獻[1],加入NO的反應機理,用于計算和分析NO的反應與生成。辛酸甲酯(MO, CAS 111-11-5)和正丁醇(NBA,CAS 71-36-3)的主要性質見表2。
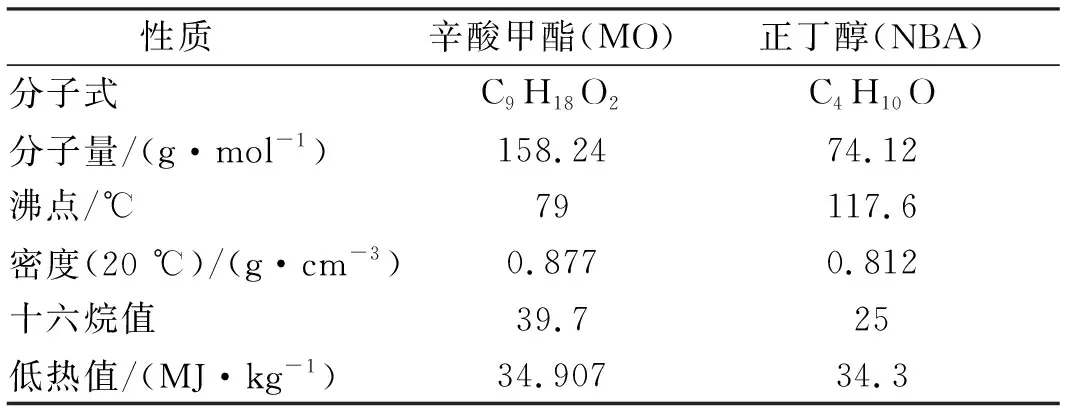
表2 辛酸甲酯和正丁醇的主要性質
1.2 模型計算參數
計算不同比例正丁醇混合條件下的氮氧化物排放特性時,考慮到船用低速柴油機實際航行時為了充分燃燒,通常空氣過量系數定在2.0,因此計算將過量空氣系數選為2.0。在CHEMKIN軟件的閉式HCCI反應模塊中進行辛酸甲酯和正丁醇的HCCI燃燒計算,設置初始溫度460 K,固定在100%負荷,轉速142 r/min,掃氣壓力為0.265 MPa,在混合物總摩爾分數不變的前提下,將辛酸甲酯和正丁醇按照0%、10%、20%和50%的比例混合。辛酸甲酯和正丁醇完全燃燒的化學反應方程式如下。
2CHO+25O→18CO+18HO
(1)
CHO+6O→4CO+5HO
(2)
計算過量空氣系數在2.0時不同混合比例下辛酸甲酯和正丁醇完全燃燒時消耗的空氣量,具體的混合成分見表3。
考慮到氬氣(AR)是惰性氣體,不參與反應,因此作為填充氣維持混合物的總摩爾分數不變。十六烷值是影響燃料性能的最重要的因素之一,是著火延遲的主要原因。大型低速船用柴油機所用的柴油十六烷值一般在30~35之間。從表3可見,當正丁醇摻混比例為50%時最接近船用低速柴油機燃油的十六烷值。
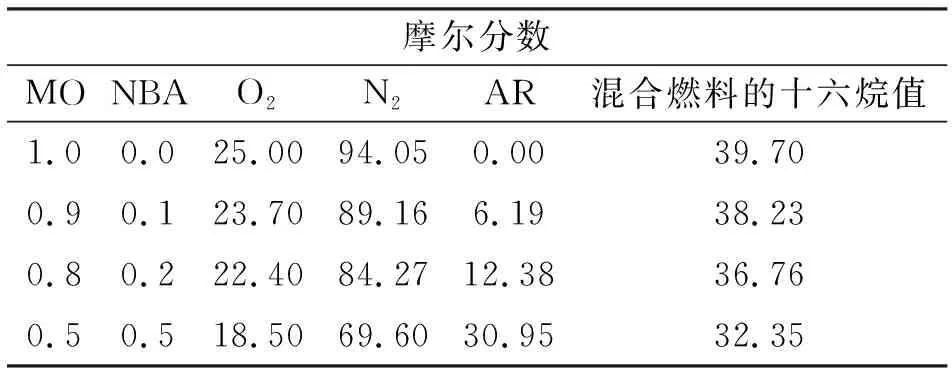
表3 混合燃料的摩爾分數和十六烷值
計算不同工況下混合燃料的氮氧化物排放特性時,選取辛酸甲酯與正丁醇混合比例1∶1,分析混合燃料在100%負荷,轉速142 r/min、75%負荷,129 r/min和50%負荷,112.8 r/min種不同工況下的氮氧化物排放特性。
2 結果討論
2.1 NOx排放特性以及NOx的生成與轉化
總摩爾分數不變,發動機固定在142 r/min,辛酸甲酯與不同比例正丁醇混合時NO體積分數隨曲柄轉角的變化見圖1。
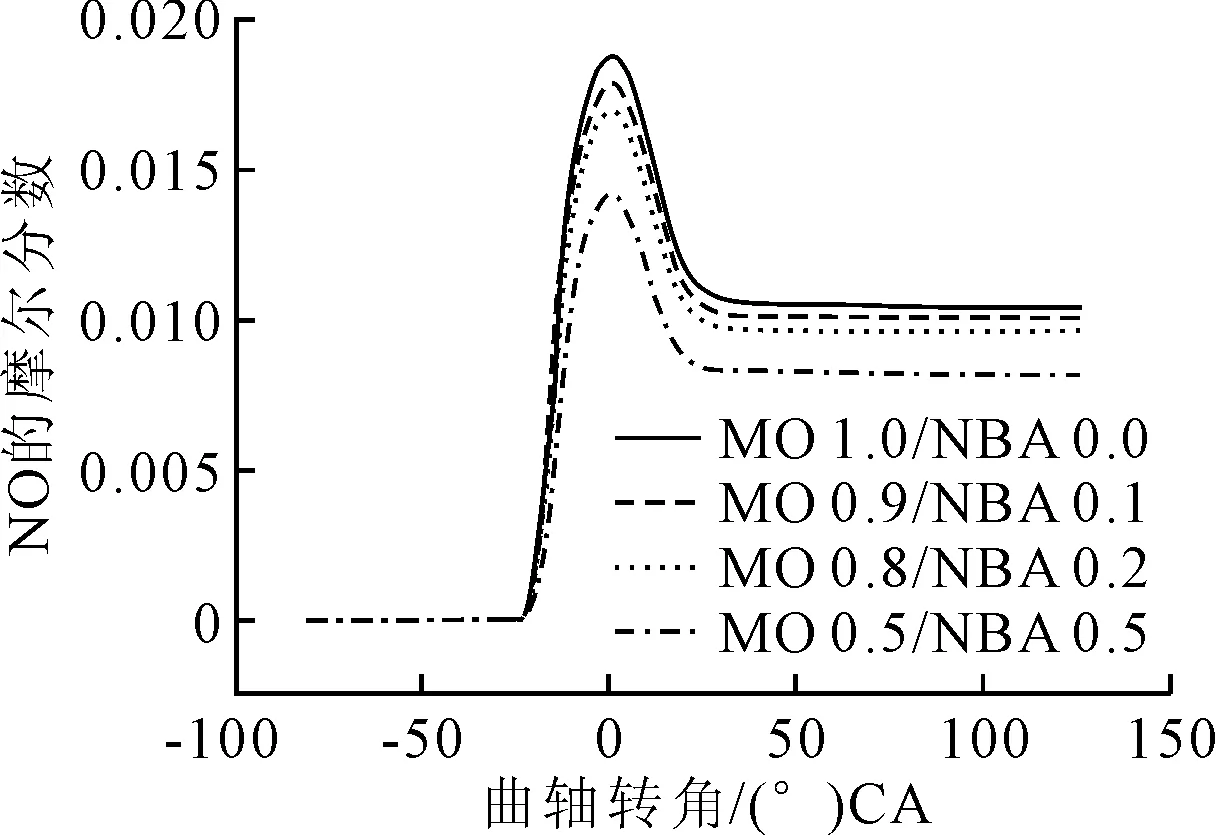
圖1 不同混合比例下的NO體積分數與曲軸轉角的變化
從圖1可見,起初體積分數隨曲柄轉角增加沒有明顯變化,當到-23.6 (°)CA時,NO體積分數驟增,然后在1.2~26.1 (°)CA區間下降之后基本保持不變,直至排氣口打開。同時,NO的體積分數隨正丁醇混合比例的增加而下降。
分析1.2~26.1 (°)CA區間內NO所參與的反應。11.6 (°)CA,正丁醇摻混比例為0%,142 r/min的情況下NO參與的主要反應方程式及產率見圖2。
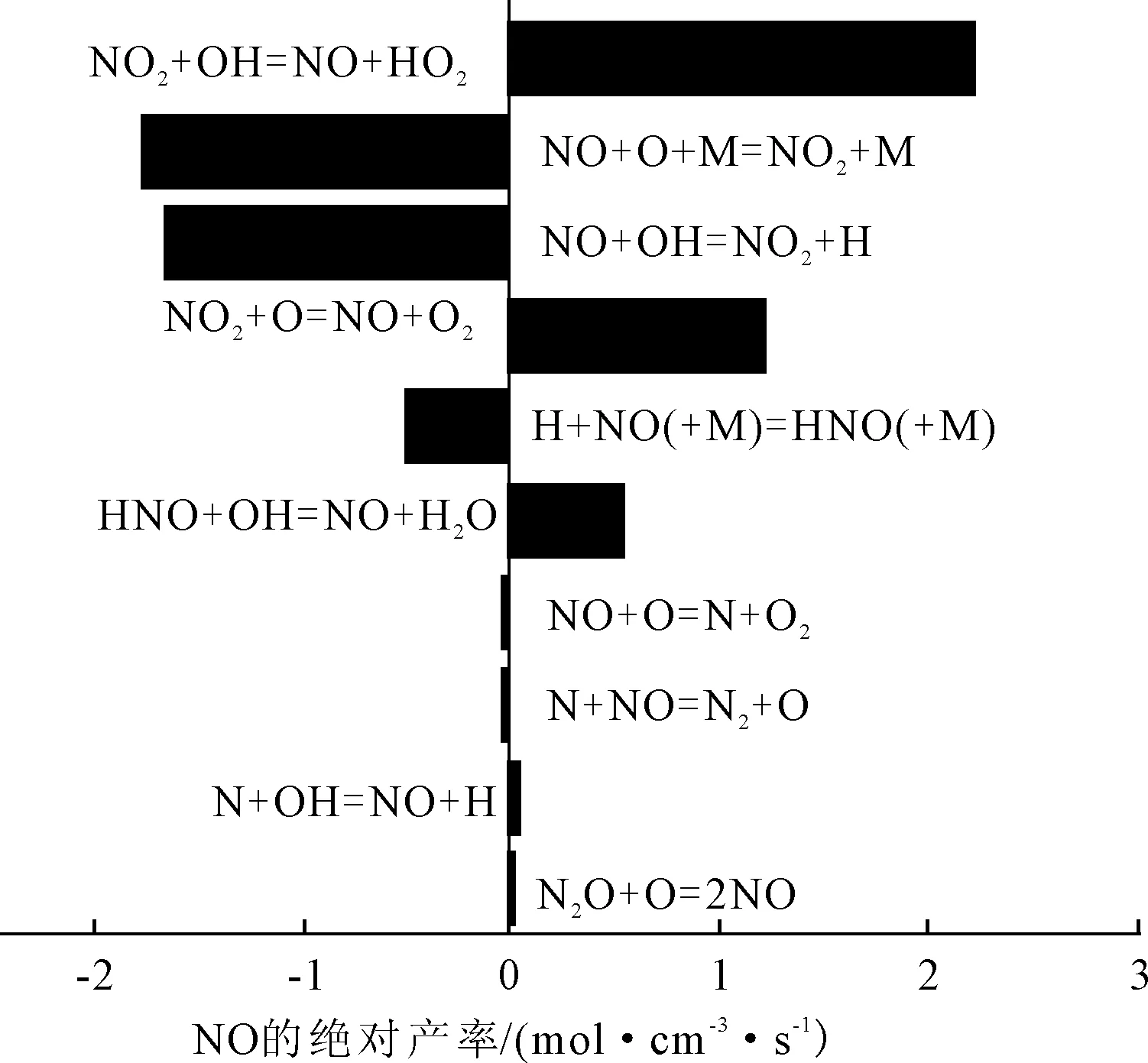
圖2 NO參與的主要反應方程式及產率
由圖2可見,NO在這些反應中既作反應物又作生成物,相互轉化發生反應,由于參與反應眾多,于是進一步分析同樣情況下NO的反應路徑,見圖3。
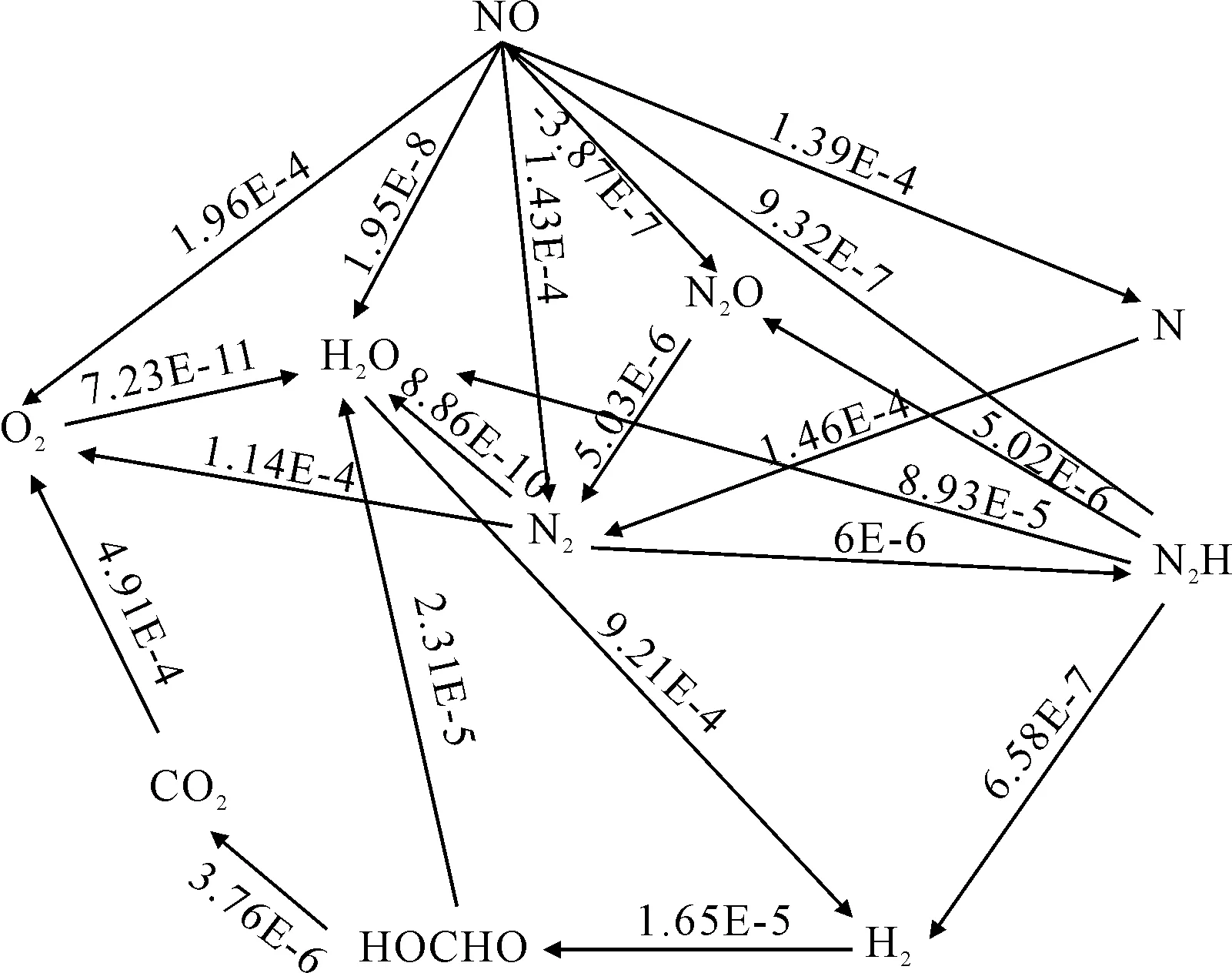
圖3 NO的反應路徑
由圖3可見, NO的一級產物有O、HO、N、NO和N。然后一級產物繼續發生反應生成其他物質,NO可以直接生成N,也可以通過生成NO和N再發生反應生成N。由此推論NO降低可能轉化成了N,為了驗證推論,計算N的體積分數變化情況。
轉速為142 r/min,不同比例正丁醇混合,N的體積分數隨曲柄轉角的變化見圖4。
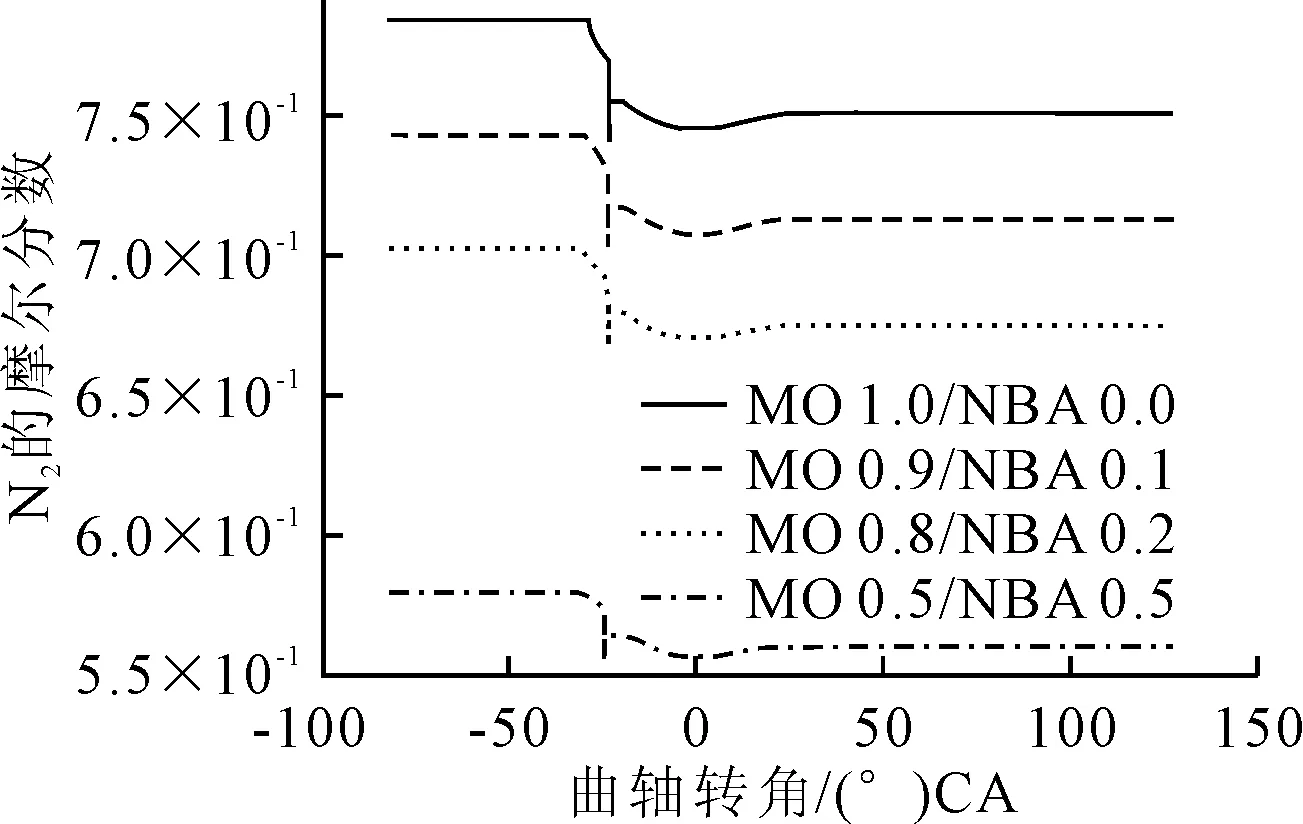
圖4 不同混合比例下的N2體積分數與曲軸轉角的變化
圖4中1.2~26.1 (°)CA區間,N呈緩慢上升趨勢,之后基本保持不變。N上升區間和NO的下降區間吻合。分析11.6 (°)CA,正丁醇混合比例為0%,142 r/min的情況下N參與的主要反應方程式及產率,見圖5。
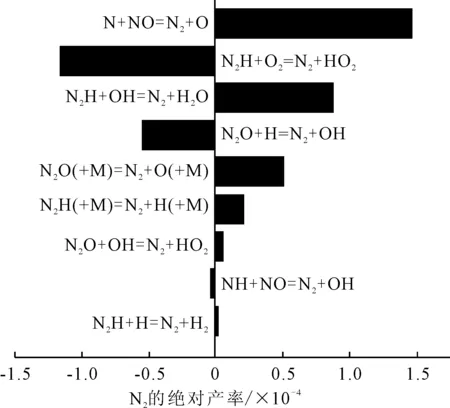
圖5 N2參與的主要反應方程式及產率
重點分析N作為生成物參與的主要反應N+NO=N+O,反應中N作為生成物,NO作為反應物,由此驗證了NO下降主要原因之一是轉化成了N。
分析NO反應過程,在142 r/min的情況下,辛酸甲酯與不同比例正丁醇混合時NO體積分數隨曲軸轉角的變化見圖6。
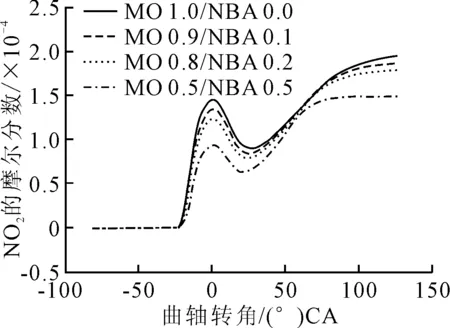
圖6 不同混合比例下的NO2體積分數與曲軸轉角的變化
NO體積分數在1.2~26.1 (°)CA區間下降,在26.1~126 (°)CA區間上升,還可以看出NO的體積分數隨著正丁醇混合比例的增加而下降。選取11.6 (°)CA和61.52 (°)CA兩處進行分析,見圖7、圖8。
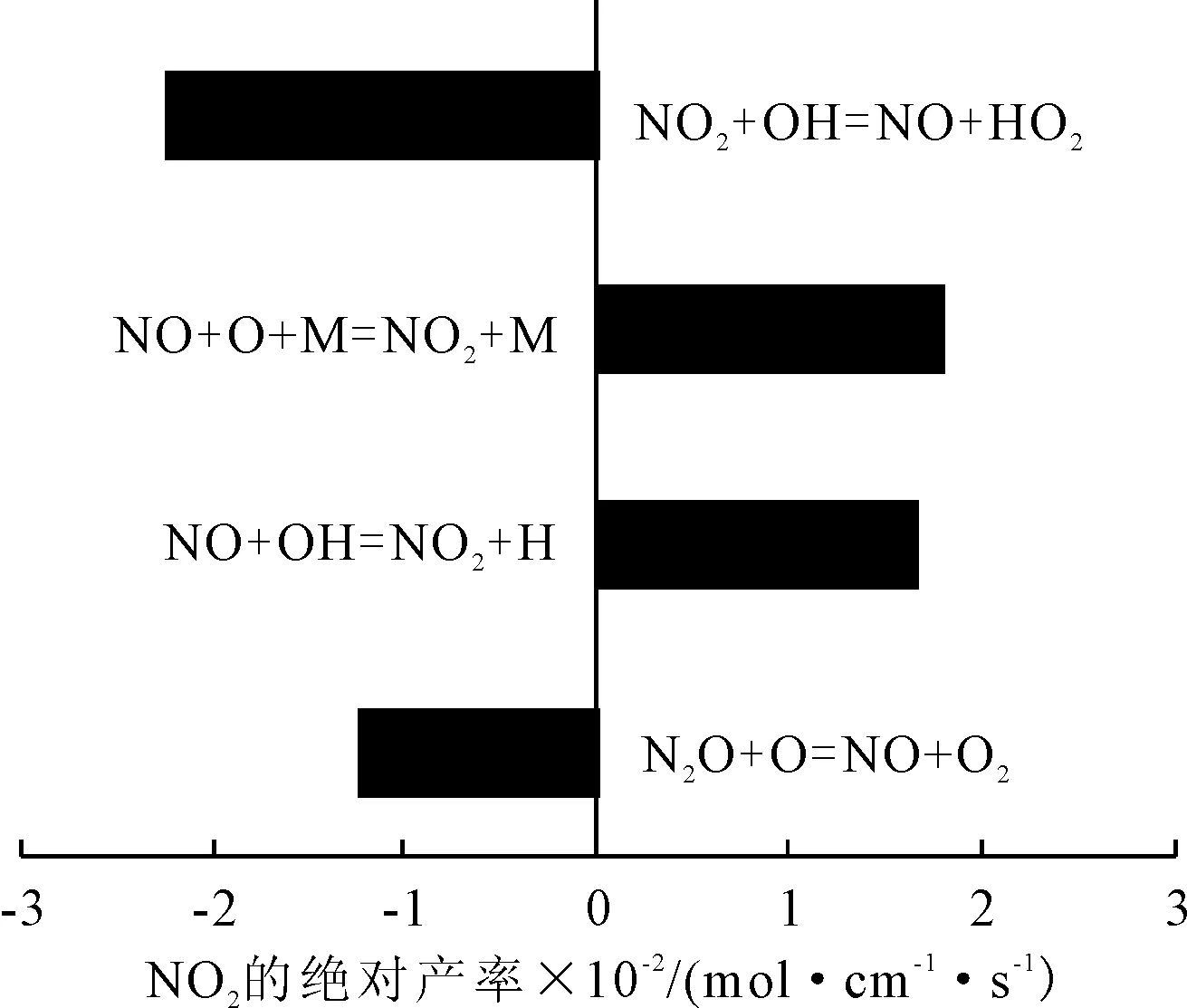
圖7 NO2參與的主要反應方程式及產率(11.6 (°)CA時)
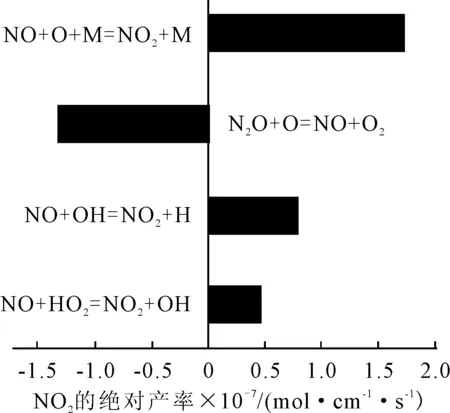
圖8 NO2參與的主要反應方程式及產率(61.52 (°)CA時)
由圖7可以看出,NO既作生成物又作反應物。經對比,NO作為生成物的產率低于其作為反應物的產率,所以在1.2~26.1 (°)CA區間內NO的體積分數呈下降趨勢的原因是NO反應生成NO。
由圖8可以看出,NO在NO+O+M=NO+M、NO+OH=NO+H和NO+HO=NO+OH這3個反應中作為生成物,在NO+O=NO+O中作為反應物。NO作為生成物的產率大于其作為反應物的產率。所以在26.1 (°)CA以后NO的體積分數呈上升趨勢的原因是NO反應生成NO。
142 r/min情況下,辛酸甲酯與不同比例正丁醇混合時NO體積分數隨曲柄轉角的變化見圖9。
由圖9可見,NO的體積分數隨著正丁醇混合比例的增加而下降,在1.2 (°)CA后呈下降趨勢,選取11.6 (°)CA處進行分析。
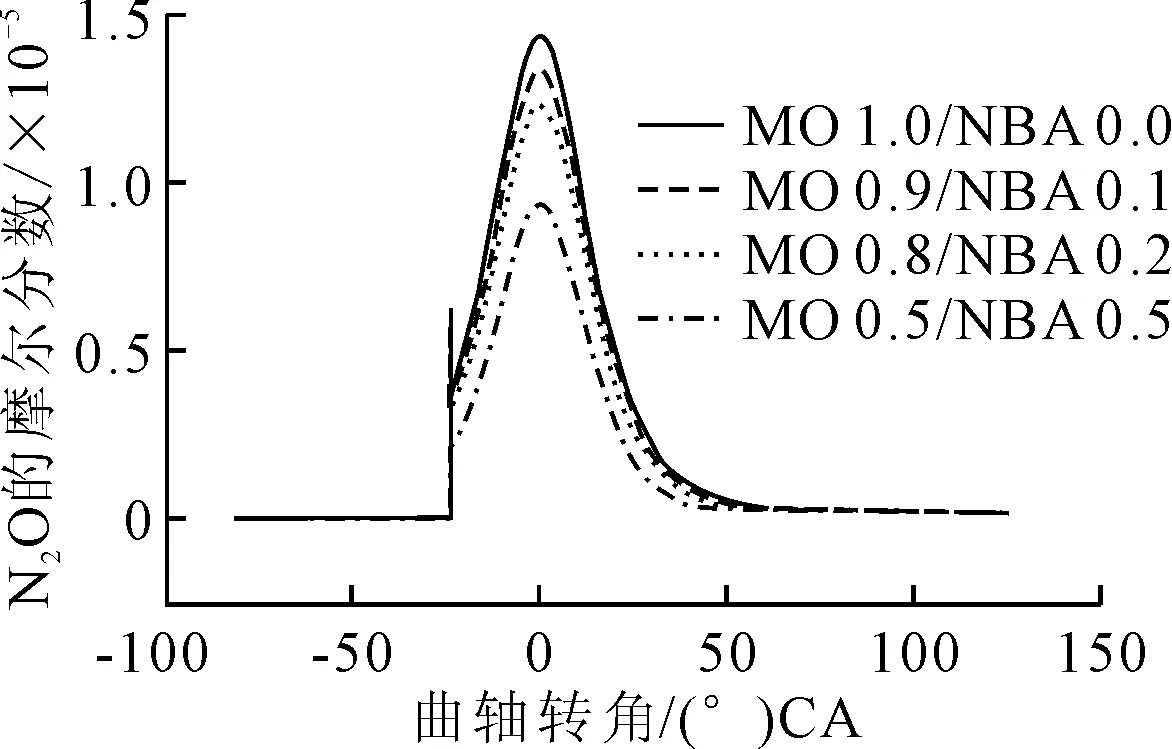
圖9 不同混合比例下N2O體積分數與曲軸轉角的變化
11.6 (°)CA,正丁醇摻混比例為0%,142 r/min情況下NO參與的主要反應方程式及產率見圖10。
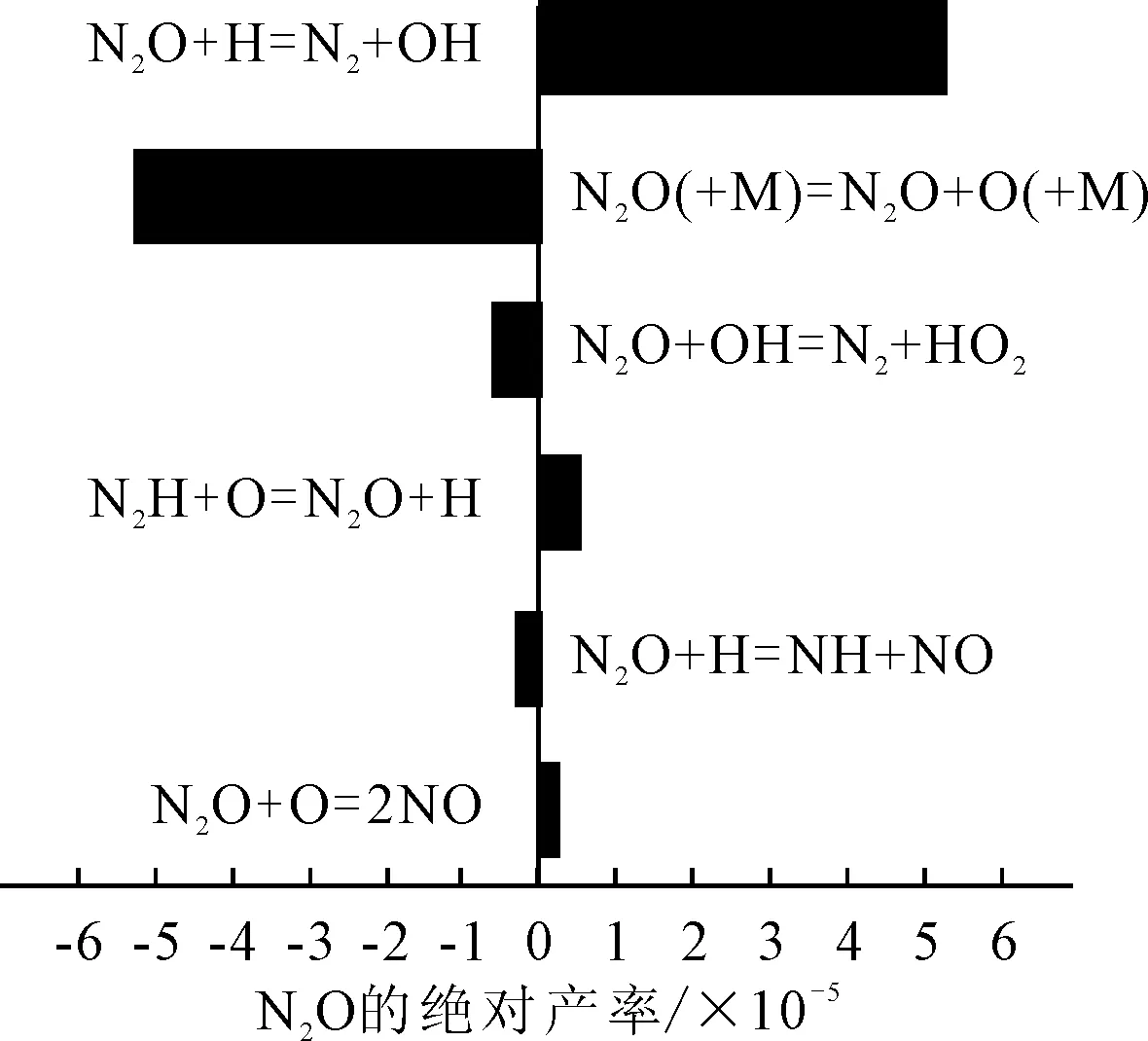
圖10 N2O參與的主要反應方程式及產率
從圖10可以看出,NO在NO+H=N+OH反應中作為生成物,在NO(+M)=N+O(+M)中作為反應物。數據對比表明,NO作為反應物的產率大于其作為生成物的產率,所以NO的體積分數在1.2 (°)CA后呈下降趨勢的原因之一是NO轉化成了N。
2.2 不同工況下NOx的排放特性
選擇辛酸甲酯與正丁醇1∶1摻混,分析不同轉速下混合燃料在HCCI燃燒中的NO排放特性,見圖11、12和13。
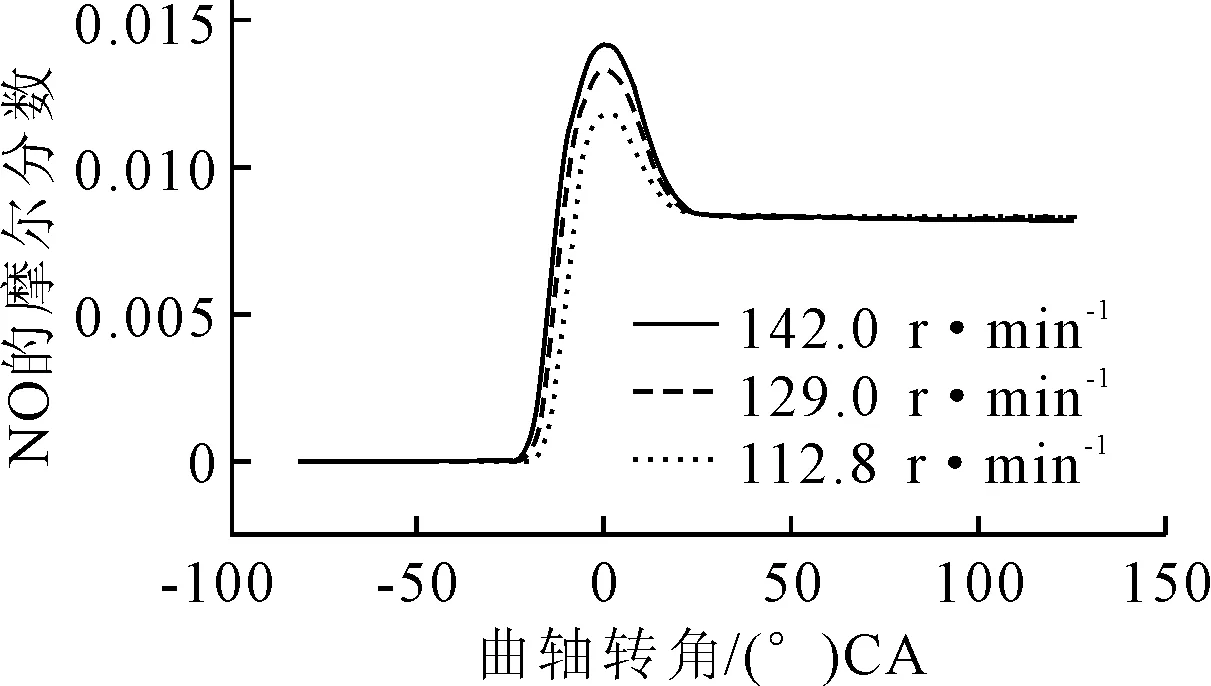
圖11 降低轉速對NO的排放影響
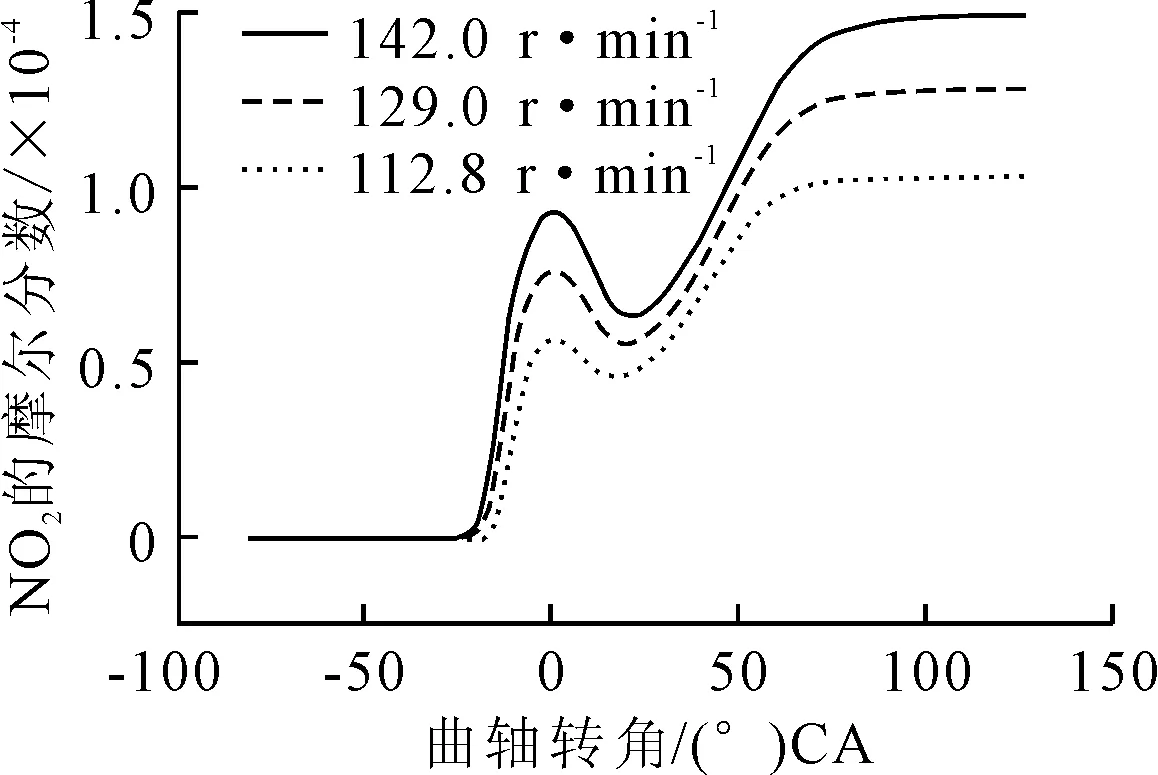
圖12 降低轉速對NO2排放的影響

圖13 降低轉速對N2O排放的影響
從圖11~13可見,NO的體積分數隨著轉速的降低而減少。由于過量空氣系數設定為2.0,熱力型NO成了NO排放的主要類型。熱力型NO主要受溫度、氧含量和反應時間等因素的影響。降低轉速對缸內溫度的影響見圖14。
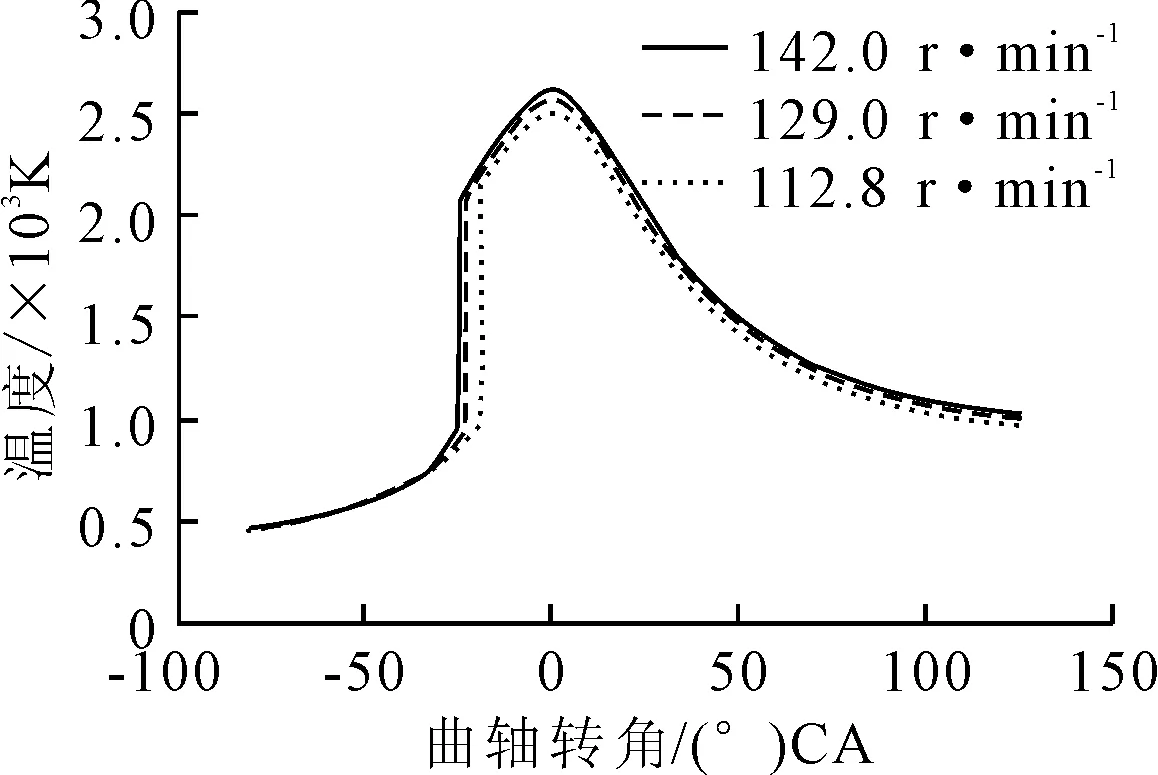
圖14 降低轉速對缸內溫度的影響
由圖14可見,氣缸內峰值溫度隨轉速降低而降低,因此NO的反應生成速率降低進而導致排放量降低;其次分析氧含量,由于過量空氣恒定,燃料總量不變,所以氧含量不變;最后分析反應時間,發動機轉速從142 r/min降到112.8 r/min,NO的反應分解時間變長,反應分解充分,因此NO的體積分數降低。綜上,適當降低轉速也可以降低NO排放。
3 結論
1)模擬生物柴油替代燃料辛酸甲酯與正丁醇混合燃料在船用柴油機中的燃燒情況,根據反應機理對NO的反應過程進行分析,可以準確地觀察到NO、NO和NO的主要化學反應路徑和化學反應速率。
2)辛酸甲酯與正丁醇的混合燃料在均質壓燃反應器內,設定過量空氣系數為2.0,轉速為142 r/min時,燃料總摩爾分數不變,隨著正丁醇混合比例的增加,NO的體積分數隨之下降。因此在應用生物柴油時可以通過混合一定比例的正丁醇來減少NO的排放。
3)在辛酸甲酯與正丁醇1∶1混合比例的前提下,降低發動機轉速,反應器內NO的體積分數也隨之降低。因此,在燃用生物柴油和正丁醇混合燃料時,可以在適當范圍內降低柴油機轉速來減少NO的排放。

