Cu含量對磁控濺射Ti-Cu納米復合涂層抗菌性能的影響*
程培雪,馬 迅,李 偉,劉劍楠,劉 平,王靜靜,陳田田,楊 旭,滕海森
(1. 上海理工大學 材料與化學學院,上海 200093;2. 上海交通大學 醫學院附屬第九人民醫院,上海200011)
0 引 言
隨著種植技術的日趨成熟,種植修復已成為牙周疾病或外傷導致失牙的重要治療手段。因此,對口腔種植材料的需求也在增加。而鈦金屬作為種植體的首選材料,具有良好的生物相容性和機械性能,但由于鈦本身不具有抗菌性能,所以存在細菌感染發生率高等問題[1]。因此,通過對鈦種植體表面改性處理,使其獲得良好的抗菌性能具有十分重要的意義。
為了使鈦植入體表面獲得良好的抗菌性能,表面改性技術特別是涂層技術成為一種有效的策略。多種多樣的涂層例如負載抗生素涂層[2]、抗粘附的涂層[3]、負載納米抗菌涂層[4]等迅速發展。然而,負載抗生素具有療效不穩定、釋放速率難以控制、細菌產生耐藥性等問題,而抗粘附涂層很難準確地評估其在體內臨床條件下的有效性,因此在很大程度上限制了其應用[5]。相比之下,負載納米抗菌涂層如金屬系涂層的抗菌效果則更加穩定[6]。
銅作為金屬系抗菌劑是人體所需的微量元素之一,而且價格低廉,適量的銅無細胞毒性,并且有一定的抗菌性能[7-9],在醫學領域作為抗菌劑引起越來越多的關注。制備納米銅涂層的方法有很多,例如物理氣相沉積法(PVD)、化學氣相沉積法(CVD)、金屬有機化合物熱分解法、液相化學還原法、水熱法等。其中磁控濺射作為物理氣相沉積法具有所需設備少、成膜速率高且均勻性好,涂層與基體之間具有較強的結合力等優點[10],在實際生產中應用較為廣泛。
近年來銅抗菌材料的研究也受到了越來越多的關注。Liu等[11]針對純Ti與Ti-Cu合金種植體做了對比,結果表明Ti-Cu合金對變形鏈球菌和牙齦卟啉單胞菌的抗菌效果更佳,并做了細胞的增殖和粘附實驗,發現Ti-Cu合金的生物相容性與純Ti類似。李慕勤等[12]在環境溫度為50 ℃的情況下,在試樣表面鍍銅3 min,通過實驗測試發現銅涂層的抗菌率達到98.3%,抗菌效果非常明顯。Heidenau等[13]基于凝膠-溶膠法在Ti合金表面制備了Cu-TiO2涂層,抑制了表皮葡萄球菌在鈦合金表面的增殖,且對大鼠結締組織成纖維細胞的生長沒有明顯的影響。韋春貝等[14]利用雙靶磁控濺射在不銹鋼表面制備了TiN/Cu-Zn涂層,并研究了多層結構對膜層耐腐蝕性能和抗菌性能的影響。結果表明,Cu-Zn層比較薄時,膜層的耐腐蝕性能比較好,抗菌性能對TiN層厚度較為敏感;隨著Cu-Zn層厚度的增加耐腐蝕性能顯著下降,而當Cu-Zn層較厚時,抗菌性能對TiN層厚度不敏感,均具有良好的抗菌性能
Cu是動物和高等植物中必不可少的微量元素且具有良好的抗菌活性,然而,銅過量時又具有較高的毒性,影響正常細胞生長。因此,本文采用磁控濺射法在純Ti表面制備不同納米Cu含量的Ti-Cu復合涂層,研究納米Cu含量對Ti-Cu復合涂層表面形貌、粗糙度、疏水性、細胞毒性和抗菌性能的影響,在符合生物安全材料標準的情況下提高鈦種植體的抗菌性能。
1 實驗材料和方法
1.1 樣品制備與分組
本文利用磁控濺射儀(JGP-450,沈陽科學儀器有限公司)在純Ti基體上制備Ti-Ag納米復合涂層。選用直徑50 mm,厚度3 mm,純度99.99%的Ti靶和Cu靶,并切成6塊,然后將不同塊的Ti靶和Cu靶拼接成一個整體,使用該方法拼接成具有不同面積比的Ti-Cu復合靶,Cu∶Ti的比例分別為1∶99、2∶98、3∶97、4∶96和5∶95,如圖1以5∶95為例。基體為純Ti片,直徑10 mm,厚度1 mm,用800#、1000#、1200#、1500#、2000#的耐水砂紙對Ti片進行拋光打磨至鏡面,在超聲震蕩機內利用丙酮、無水乙醇以及去離子水進行超聲清洗各20 min,然后自然晾干。
利用磁控濺射儀濺射之前,需對磁控濺射儀抽真空,直至真空度低于5×10-4Pa,通入Ar,設置壓強,啟輝,預濺射15 min左右,除去靶材表面殘留的雜質。在濺射功率為40 W,濺射氣壓為0.8 Pa,氬氣流量為30 mL/min下濺射1.5 min,制備不同Cu含量的Ti-Cu納米復合涂層,實驗流程圖如圖2。根據復合靶中Ti和Cu面積比的不同將涂層組分為Cu-1組、Cu-2組、Cu-3組、Cu-4組、Cu-5組。
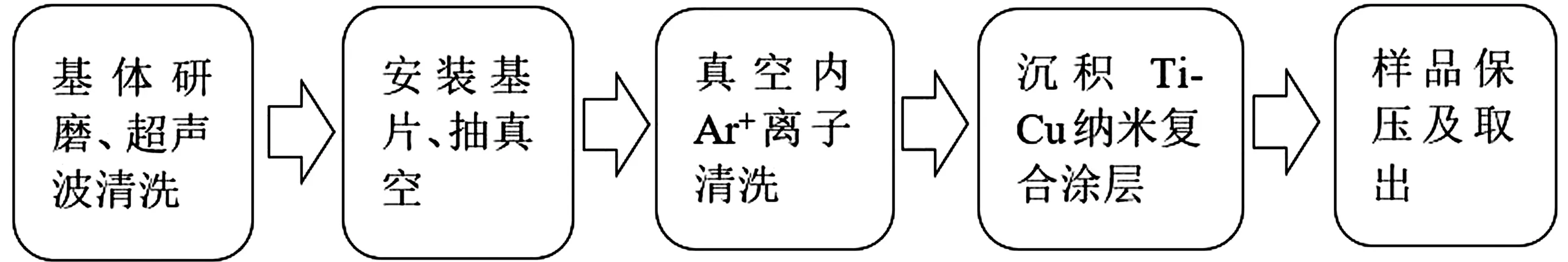
圖2 實驗流程圖Fig.2 Experimental flow chart
1.2 樣品表征
使用場發射掃描電子顯微鏡(SEM,Quanta FEG450,FEI公司)觀察樣品的表面形貌;X射線衍射儀(XRD,D8 Advance,Bruker公司)分析樣品物相,測量范圍30~80°;采用原子力顯微鏡(AFM,Dimension Icon,Bruker公司)觀察各組樣品的三維形貌同時進行粗糙度的測量;使用界面張力測量儀(JC2000C1,上海中晨數字技術設備有限公司)進行水接觸角的測量,用量角法測量樣品不同位置的水接觸角,每組分別測量5組平行數據,最后計算出每組數據的平均值,所有測試均在室溫下進行。
1.3 體外細胞毒性試驗
按照MEM培養基:馬血清為9∶1的比例配制細胞完全培養基,所有樣品均為固體,每組樣品均用含量為75%的酒精棉球進行擦拭,然后用無菌去離子水對樣品進行3次沖洗,最后將樣品放置于37 ℃保溫箱內進行烘干。將各組樣品放入無菌平皿內并做好標記,轉移至超凈臺(SW-CJ-2FD,上海篤特科學儀器有限公司)內,通過紫外線照射對樣品進行2 h的殺菌,然后把樣品放到新的無菌離心管內,同時做好標記。按照10 mL∶1 cm2的比例加入完全培養基,放入37 ℃ CO2恒溫細胞培養箱(WIGGENSWCI-180,北京桑翌實驗儀器研究所)72 h,制備成浸提液。此為母液,4 ℃保存備用。
選取對數生長期的小鼠成纖維細胞(L929,上海賽百慷生物),進行細胞計數,調整細胞濃度,按照6×103/孔的比例在96孔板中進行接種。總共分為9個組別,依次為:空白對照組(純高糖培養基)、陽性對照組(苯酚)、陰性對照組(聚乙烯)、Ti組、Cu-1組、Cu-2組、Cu-3組、Cu-4組、Cu-5組。在5%CO2,37 ℃恒溫培養箱中培養過夜,培養24 h后丟棄上清液,按照100 mL/孔加入浸提液,在24 h、48 h、72 h后停止細胞的培養,避光條件下,每孔各加入10 mL CCK-8試劑(Invigentech,貨號:IV08-100),并于5%CO2,37 ℃恒溫培養箱中培養2 h。通過酶標儀(TECAN,型號:SPARK 10M)檢測細胞在450 nm處的吸光度值OD。根據式(1)計算細胞相對活力(relative growth rate,RGR),根據表1判斷樣品的毒性等級和安全標準。
(1)
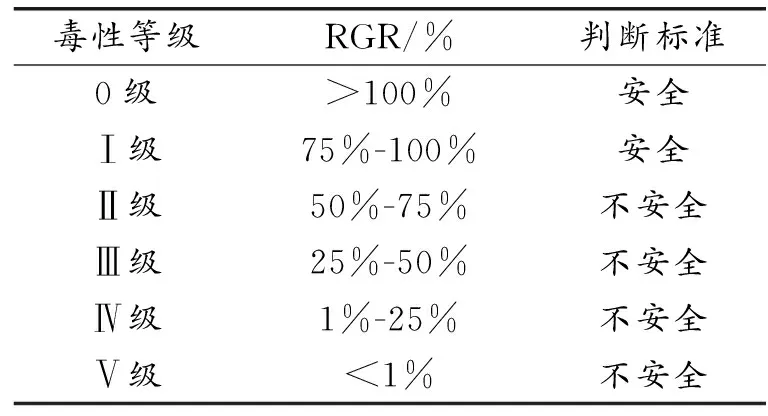
表1 細胞RGR判斷其毒性等級與安全標準
1.4 外抗菌實驗
該實驗采用的細菌為具核梭桿菌,采用腦心浸液肉湯(BHI)瓊脂平板培養,然后在標準厭氧條件下(80%N2、10%H2、10%CO2,37 ℃)培養24 h,傳代、稀釋培育后,選取濃度值為106CFU/ml菌液,備用。將前述制備的樣品用75%的酒精棉球擦拭,然后用去離子水沖洗試件3遍,37 ℃保溫箱內烘干。將各組樣品經紫外線照射殺菌2 h后,轉移到新的無菌平皿內并標記。將滅菌后的樣品與具核梭桿菌共培養24 h后,置于1 mLPBS中,輕振使樣品上粘附的細菌脫落,然后將菌液稀釋105倍,接種于新的BHI瓊脂培養基中并做好標記,將標記好的培養基放置于厭氧箱中,然后抽真空,充入CO2混合氣,37 ℃恒溫孵箱內厭氧培養48 h后,對具核梭桿菌進行拍照計數,通過計數結果計算各樣品抗菌率。
(2)
式中:R為抗菌率,%;A為實驗組樣品平均回收菌落數,cfu/片;B為純Ti對照組樣品平均回收菌落數,cfu/片。
2 結果與討論
2.1 不同Cu含量對Ti-Cu納米復合涂層微觀形貌的影響
不同Cu含量的Ti-Cu納米復合涂層的SEM圖如圖3,由圖3可見,Ti片表面比較光滑,而涂層組樣品表面分布有納米級顆粒。隨著Cu含量的增加,Ti片表面顆粒也越來越多。圖4為各涂層組樣品的XRD圖,從圖中可知沒有Cu相產生,說明Ti-Cu納米復合涂層中Cu含量過少,且Cu的尺寸為納米級別的,顯示不出來。在衍射角2θ為76.1°附近出現了Ti的衍射峰。根據圖4與標準圖譜對照結果,可以得知為Ti(112)晶面。

圖3 不同納米Cu含量涂層的SEM圖(a)Ti、(b)Cu-1、(c)Cu-2、(d)Cu-3、(e)Cu-4、(f)Cu-5Fig.3 SEM images of coatings with different nano Cu content: (a)Ti, (b)Cu-1, (c)Cu-2, (d)Cu-3, (e)Cu-4, (f)Cu-5
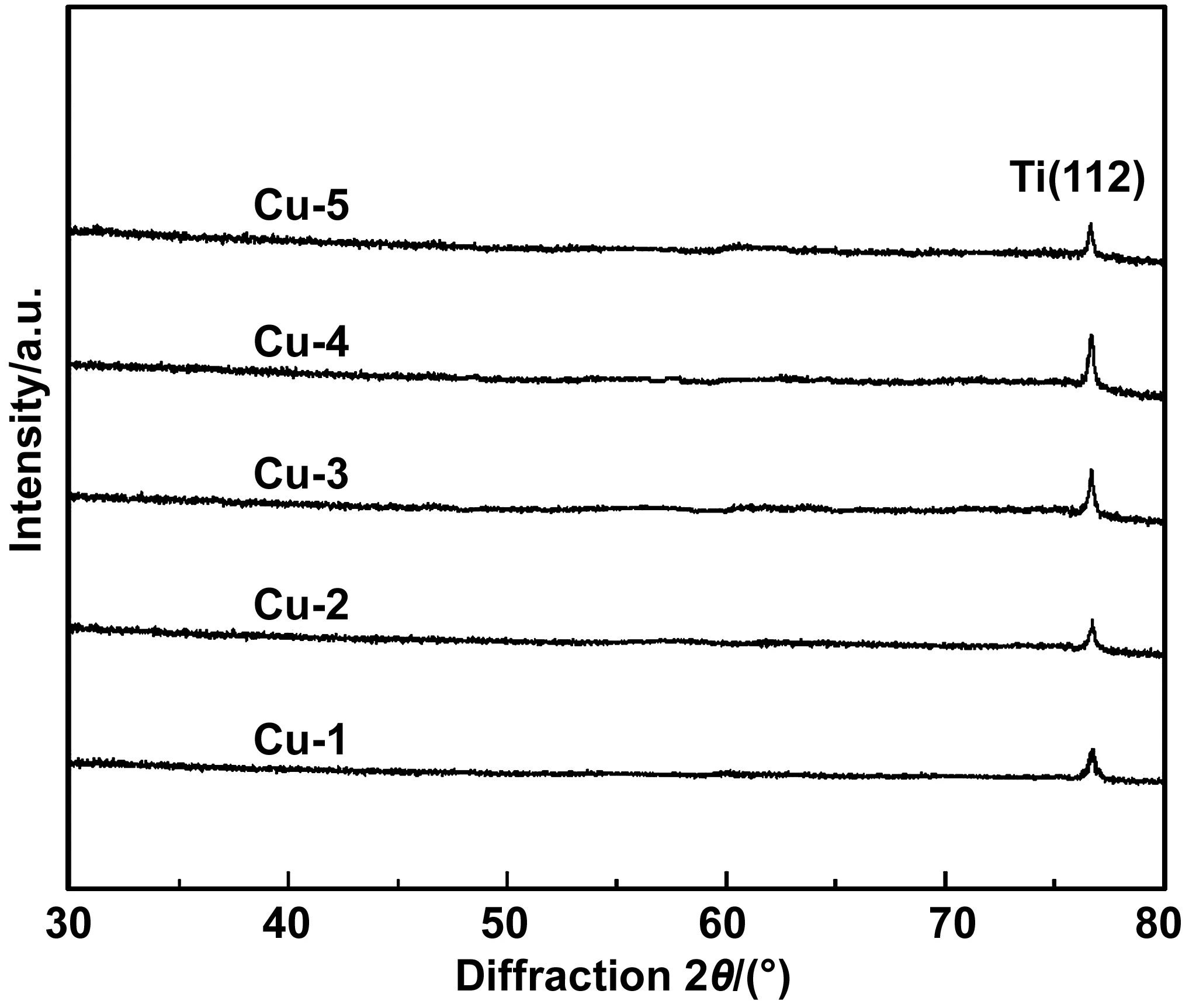
圖4 不同納米Cu含量涂層的XRD圖譜Fig.4 XRD patterns of coatings with different nano Cu content
2.2 不同Cu含量對Ti-Cu納米復合涂層粗糙度的影響
圖5和圖6分別為AFM分析的三維形貌和表面粗糙度。如圖5所示,Ti組和涂層組的三維形貌有很大差別。Ti對照組表面如圖5(a)比較光滑,無顆粒狀結構。而涂層組表面被均勻分布的Ti/Cu顆粒所覆蓋。由圖6可知,純Ti表面粗糙度Ra為1.12±0.18 nm,涂層組表面粗糙度Ra相對于純Ti對照組有明顯地增加,差異具有顯著的統計學意義(P<0.01)。并且隨著Ti-Cu涂層中納米Cu含量的增加,涂層組的粗糙度也按照Cu-1、Cu-2、Cu-3、Cu-4、Cu-5的順序依次在增加,粗糙度值分別為5.16±0.40 nm、8.45±0.90 nm、10.45±0.70 nm、13.70±0.80 nm、16.1±s0.75 nm,其中Cu-5組粗糙度最大。

圖5 樣品表面AFM形貌:(a)Ti, (b)Cu-1, (c)Cu-2, (d)Cu-3, (e)Cu-4, (f)Cu-5Fig.5 AFM morphology of sample surface: (a)Ti, (b)Cu-1, (c)Cu-2, (d)Cu-3, (e)Cu-4, (f)Cu-5
材料表面粗糙度是影響微生物粘附的一個主要因素[15]。粗糙的種植體表面有利于細菌粘附,而光滑的表面可以減少細菌粘附[16-18]。然而,近年來研究發現,表面粗糙度與細菌粘附[19]的數量并不是正相關的。Bollen等[20]研究了粗糙度與細菌粘附的關系,結果表明,Ra>0.2 μm時,表面粗糙度的增加可以促進細菌粘附,而Ra<0.2 μm時,細菌的粘附不隨粗糙度的變化而變化。本實驗中原子力顯微鏡(AFM)分析結果表明,涂層組表面的粗糙度雖然都有所提高,但所有樣品的表面粗糙度均保持在0.2 μm以下,所以,本實驗中各組樣品的表面粗糙度對細菌粘附的影響不大。

圖6 不同納米Cu含量涂層的粗糙度Fig.6 Roughness of coatings with different Cu content
2.3 不同Cu含量對Ti-Cu納米復合涂層疏水性的影響
圖7為各樣品的水接觸角。一般認為,水接觸角小于90°時該表面具有親水性,表面自由能高;水接觸角大于90°時該表面具有疏水性,表面自由能低[21-22],植入材料的疏水性對細菌的粘附以及生物膜的形成都有一定的影響,尤其影響細菌在其表面的初始粘附。通常親水性的表面比疏水性表面更有利于細菌粘附和增殖[23]。本實驗中,由圖7可知,對照組純Ti的水接觸角為80.67°±0.82°,與對照組相比,各鍍Ti-Cu納米復合涂層組樣品表面的水接觸角均增大,且差異具有顯著的統計學意義(P<0.01)。隨著納米Cu含量的增加,水接觸角增加,Cu-1、Cu-2、Cu-3、Cu-4、Cu-5組涂層的水接觸角分別為95.58±0.92°、98.17±0.62°、100.33±0.51°、103.17±0.85°、107.42±1.23°。
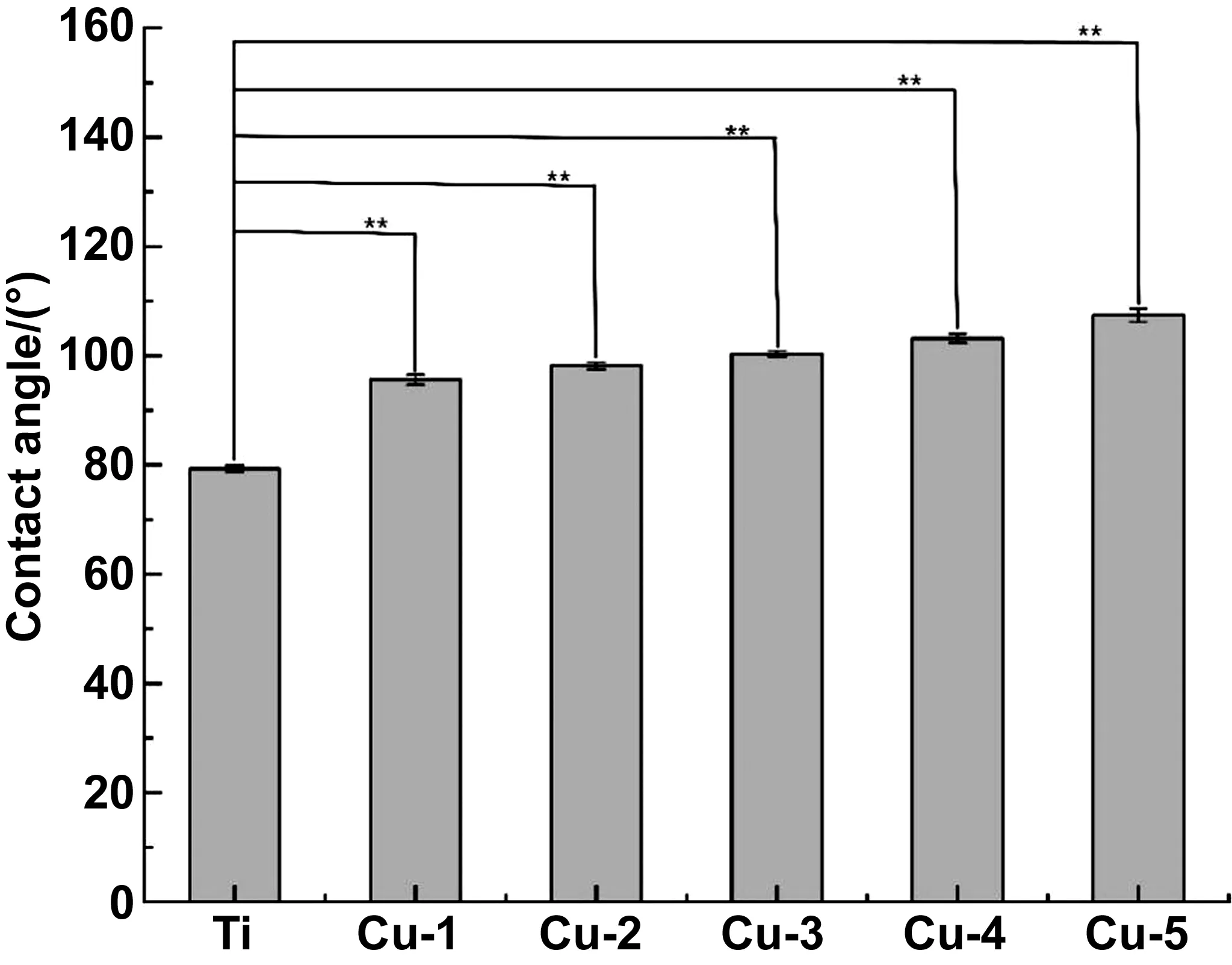
圖7 不同納米Cu含量涂層的水接觸角Fig.7 Water contact angle of coating with different Cu content
2.4 不同Cu含量對Ti-Cu納米復合涂層細胞毒性的影響
圖8和表2分別是細胞吸光度值OD、RGR及細胞毒性等級結果。由圖8可知,在24,48,72 h 3個時間點,納米Cu涂層組、Ti組、陰性對照組的OD值與空白對照組相比差異均無統計學意義(P>0.05),對比陽性對照組在所有時間點與其他實驗組的OD值,差異具有顯著的統計學意義(P<0.01)。
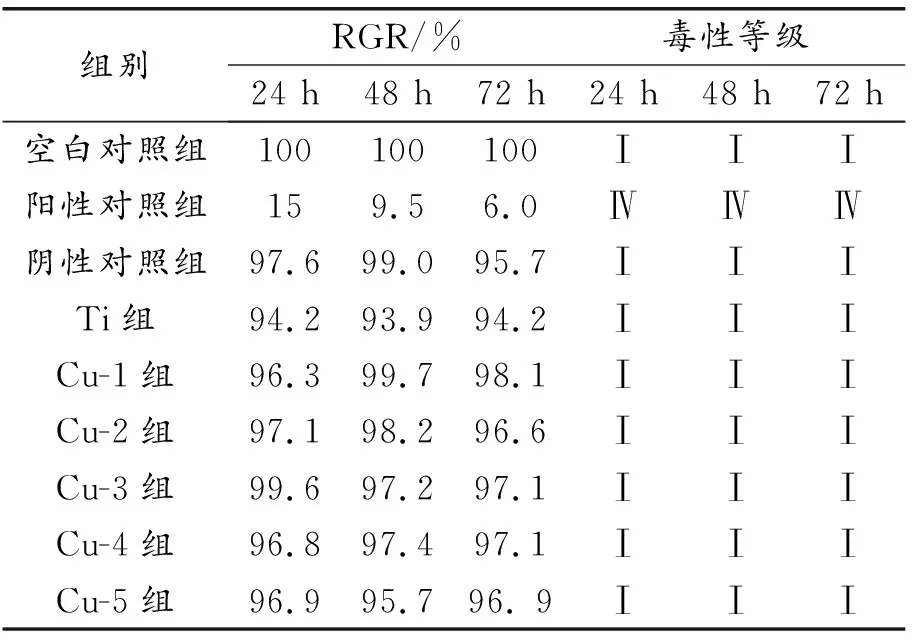
表2 各組L929細胞培養不同時間的RGR與細胞毒性等級
大量的研究表明,納米Cu具有細胞毒性和遺傳毒性。納米Cu的細胞毒性受到多種因素的影響,例如納米Cu的大小,形狀,濃度等。通常納米Cu的濃度越高,其細胞毒性越大,甚至可以導致細胞死亡。本實驗通過CCK-8法檢測各組樣品的細胞毒性,結果表明,陰性對照組、Ti組和各納米Cu涂層組細胞相對活力均大于90%,毒性等級為Ⅰ級,未表現出明顯的細胞毒性,符合生物安全材料的標準。這是由于涂層組樣品有較少的Cu,從而未表現出細胞毒性。
本實驗結果表明抗菌結果表明,通過磁控濺射技術在純鈦表面沉積的Ti-Cu納米復合涂層具有明顯的抗菌作用,并且Cu含量越高,涂層的抗菌效果也越好。雖然人們對Cu的抗菌機制已經有長期的研究,但是關于其抗菌機制也沒有統一定論,目前大家公認的主要有以下兩種理論:
2.5 不同Cu含量對Ti-Cu納米復合涂層抗菌性能的影響
圖9為個樣品表面細菌培養計數結果,如圖9所示,經過一定時間的培養,樣品表面的菌落在瓊脂平板上生長。結果表明,細菌在Ti組樣品表面存活良好,稀釋后涂覆到平板中在培養基表面大量繁殖,培養基的表面出現大量菌落,表明Ti組表面沒有殺菌作用。對應載Cu涂層組的培養基中菌落明顯減少。樣品的抗菌率見表3,以對照組Ti組的細菌存活率100%為標準,Cu-1、Cu-2、Cu-3、Cu-4、Cu-5組樣品表面的抗菌率分別為83%、85%、 89%、93%和95%,表明Cu元素的加入使材料獲得抗菌性能,且對具核梭桿菌具有較強的抗菌作用,隨著納米Cu含量的增高,抗菌效果也越好,Cu-5組抗菌率最高,達到95%。
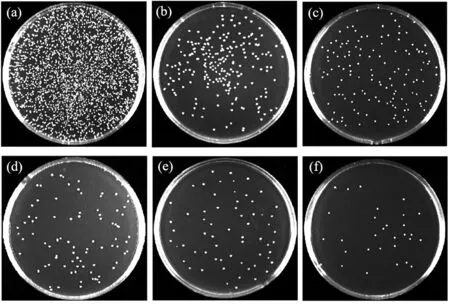
圖9 各樣品表面細菌培養計數結果 (a)Ti、(b)Cu-1、(c)Cu-2、(d)Cu-3、(e)Cu-4、(f)Cu-5Fig.9 Counting results of bacterial culture on the surface of each sample: (a)Ti, (b)Cu-1, (c)Cu-2, (d)Cu-3, (e)Cu-4, (f)Cu-5

表3 具核梭桿菌菌落計數(±s,n=3)及抗菌率(%)Table 3 Colony count and antibacterial rate of Fusobacterium nucleate
(1)銅離子釋放殺菌
銅離子表面帶正電荷,對于細菌而言,細胞膜表面帶負電荷。當受到靜電引力作用時,銅離子很容易吸附在細菌細胞膜上,且一步步透過細胞壁穿入細菌內部,和相關的酶、蛋白質等產生一定的化學反應,進而達到破壞核酸和DNA合成的目的。通過以上過程銅離子可以干擾細菌的正常功能,影響其內部pH值,使其無法正常分裂繁殖,也即達到了消滅細菌或抑制細菌增殖的目的[24-25]。
(2)接觸殺菌
有研究發現,含銅涂層中未析出的銅離子也會有一定的抑菌效果[26]。當細菌與材料表面的銅涂層接觸時,涂層中含的銅離子和細菌表面發生反應,導致細菌的細胞膜破損,進而造成細菌停止呼吸,細菌活性喪失,進而完成殺菌或抑菌[27-28]。也有研究表明,接觸式的殺菌與細菌細胞膜內部的不飽和脂肪酸的ROS催化反應有關,ROS可以干擾細菌生存所必需的一些基本成分活性,導致細菌死亡[29]。
3 結 論
基于磁控濺射技術,在純Ti表面鍍Ti-Cu納米復合涂層,對其微觀結構和理化性質進行了表征,并通過細胞毒性實驗和抗菌實驗對樣品的生物相容性和抗菌性能進行評價。研究得出以下結論:
(1)利用磁控濺射技術,在純Ti表面成功沉積Ti-Cu納米復合涂層,并且隨著涂層中納米Cu含量的增加,涂層表面粗糙度和水接觸角均依次增大,Cu-5組的粗糙度和水接觸角均最大,分別為(16.10±0.75)nm和107.41°±1.23°。
(2) CCK-8法檢測細胞毒性結果表明,Ti-Cu納米復合涂層改性的純Ti未表現出明顯的細胞毒性,各組材料的毒性等級均為I級,符合物安全性材料的標準。
(3) 體外抗菌實驗結果表明Ti-Cu納米復合涂層改性的Ti植入材料對具核梭桿菌抗菌率均達到80%以上,有較強的抗菌作用,并且隨著納米Cu含量的增加,涂層的抗菌性也越好,Cu-5組抗菌性最好,抗菌率高達95%。

