兩種蛋清蛋白-殼聚糖乳液負載β-胡蘿卜素的性能對比研究
高博,潘晴楣,張志鵬,胥偉*
1(沈陽中街冰點城食品有限公司,遼寧 沈陽,110164)2(武漢輕工大學 食品科學與工程學院,湖北 武漢,430023)
單層乳液的油滴僅被單獨一層乳化劑覆蓋,蛋清蛋白-殼聚糖混合乳液是以蛋清蛋白-殼聚糖復合粒子作為乳化劑制備而成的單層乳液。單層乳液的固體顆粒真實吸附后將在界面上穩定存在,并且可以增加連續相黏度,從而減緩乳液的分層速率,降低乳析指數[1]。由于單層乳液在某些條件下穩定性較差,為了提升乳液的穩定性,可以采用化學改性、低能乳化、微乳液聚合、逐層靜電沉積技術等方法制備多層乳液[2]。雙層乳液是一種具有2層界面的乳液,一般通過層-層靜電自組裝技術形成,其2個界面層可由蛋白質、多糖等生物聚合物或磷脂等小分子表面活性劑以靜電吸附或共價結合的方式形成于乳液液滴的表面。作為一種傳遞體系,與傳統的單層乳液相比,雙層乳液在結構穩定性和抵抗環境壓力(如酸堿度、溫度和離子強度等)方面更具優勢,能對所包裹的生物活性物質提供更好的保護,且具有一定的控釋能力[3]。
蛋清蛋白中包含了大量的疏水氨基酸,使得蛋清蛋白具有良好的兩親性質,是制備Pickering顆粒的理想原料[4]。研究表明,超聲處理的蛋清蛋白凝膠顆粒是制備Pickering乳液的理想材料[5]。殼聚糖來自于幾丁質的堿性脫乙酰化,是一種潛在的pH響應性聚合物。pH小于6.5時,氨基的質子化使其溶解,反之則不溶解[6]。殼聚糖的不溶性有利于形成不溶性殼聚糖顆粒,從而有利于Pickering的乳化性能。殼聚糖顆粒可以吸附在油水界面,即使在低濃度下也可以穩定Pickering油/水乳液。蛋白質和多糖已被證實可以用來穩定Pickering乳劑,它們的復合粒子如蛋白質-蛋白復合粒子、多糖-多糖復合粒子和多糖蛋白復合粒子理論上都可以作為Pickering乳劑的穩定劑。WANG等[7]通過殼聚糖和明膠之間的靜電相互作用制備了蛋白質-多糖復合物顆粒。此外,不同顆粒的結合可以相互補充,提高在Pickering乳液中的性能。蛋白質-多糖復合物顆粒兼具2種生物聚合物的良好特性及其協同效應[8],蛋白質和多糖具有不同的固有特性,它們的組合可以改善其特性,并賦予水包油Pickering乳液更好的動力學穩定性[9]。與純蛋白質或多糖顆粒相比,蛋白質多糖復合物顆粒具有更強的乳化性能,可作為Pickering穩定劑,這歸因于復合顆粒穩定的Pickering乳液具有較厚的界面層[10]。
β-胡蘿卜素是一種抗氧化劑,具有解毒作用,是維護人體健康不可缺少的營養素,在抗癌、預防心血管疾病、白內障及抗氧化上有顯著的作用,并進而防止老化和衰老引起的多種退化性疾病[11]。但是,由于其極低的水溶性,化學和代謝不穩定性以及體內生物活性差,β-胡蘿卜素在食品中的應用,尤其是營養保健品強化食品的應用受到阻礙[12]。針對β-胡蘿卜素穩定性差、易降解及水不溶性的問題,乳液致密的界面層可以防止不穩定的生物活性物質降解,乳液遞送系統是提高β-胡蘿卜素穩定性以及拓寬其應用的有效途徑。由于蛋白質-多糖復合粒子穩定的混合乳液與雙層乳液均具有較好的乳液性能,因此本文制備了以蛋清蛋白-殼聚糖復合粒子為穩定劑的混合乳液和蛋清蛋白-殼聚糖雙層乳液,對比了這2種乳液在負載β-胡蘿卜素后熱穩定性、抗消化穩定性及貯藏穩定性的變化,以期為構建一種功能活性物質遞送載體提供參考。
1 材料與方法
1.1 材料與試劑
雞蛋,神丹蛋品有限公司;大豆油,益海嘉里食品營銷有限公司;鹽酸、磷酸氫二鈉、磷酸二氫鈉、考馬斯亮藍試劑盒、殼聚糖、β-胡蘿卜素、黏蛋白、胃蛋白酶、胰酶、脂肪酶,上海葉源生物有限公司;谷氨酰胺轉胺酶(100 U/g),江蘇一鳴生物股份有限公司。
1.2 儀器與設備
YB-1000A 型納米粒度、Zeta電位和分子質量分析儀,英國MALVERN公司;超聲細胞粉碎機、冷凍干燥機、XHF-DY型高速分散器,寧波新芝生物科技股份有限公司;UV2000紫外可見分光光度計,尤尼柯(上海)儀器有限公司。
1.3 實驗方法
1.3.1 負載β-胡蘿卜素的蛋清蛋白-殼聚糖乳液的制備
參考GUO等[13]的方法并稍作改動,分離出新鮮雞蛋的蛋清,在室溫下中速攪拌1 h后,過濾除去不溶性物質,測得蛋清蛋白的含量為10%(質量分數)。取30 mL的蛋清蛋白溶液在一定功率下超聲10 min,用1 mol/L HCl溶液調整蛋清的pH至7.0,利用磁力攪拌器在室溫下攪拌2 h后加入1%(質量分數)的TG酶水浴反應2 h,將蛋清蛋白溶液置于90 ℃水浴加熱40 min,然后立即冰浴冷卻。在4 ℃條件下靜置24 h后形成凝膠,將凝膠搗碎,并用去離子水稀釋樣品。預均質2 min,轉速為10 000 r/min。再利用高壓微射流均質機在20 000 psi下均質3次,得到蛋清蛋白凝膠顆粒。
混合乳液的制備:將質量分數為4%的蛋清蛋白凝膠顆粒分散液與質量分數0.6%的殼聚糖溶液在pH為6的條件下以2∶1的質量比混合形成液滴,再加入體積分數為40%的負載β-胡蘿卜素的大豆油。為了使油滴均勻分散于界面,將混合液體置于高速均質機下以15 000 r/min的轉速分散2 min,即制得混合乳液。
雙層乳液的制備:采用層層組裝靜電沉積技術,在蛋清蛋白Pickering乳液上吸附連續沉積多層聚電解質,即可形成多層乳液。本研究采用飽和法,即在沒有中間漂洗步驟的情況下,通過從溶液中吸附聚電解質來構建層。參考SILVA等[14]的方法并稍作修改,取質量分數為4%蛋清蛋白凝膠顆粒分散液,體積分數為40%的大豆油,調整體系的pH值為6,再加入體積分數為40%的負載β-胡蘿卜素的大豆油,將混合液體置于高速均質機下以15 000 r/min的轉速分散2 min,制得蛋清蛋白Pickering乳液。然后向體系中加入體積分數為0.6%的殼聚糖溶液,通過從溶液中吸附聚電解質構建層,以15 000 r/min的轉速分散2 min,即制得雙層乳液。
1.3.2 粒徑的測定
取新鮮制備的乳液,將其稀釋100倍后使用Mastersizer 3000粒度分布儀對其進行粒徑分布分析。其參數為:顆粒吸收率為0.001,顆粒折射率為1.450,分散劑折射率為1.330,密度為0.945,球形液滴。
1.3.3 乳相體積分數測定
觀察、記錄不同乳液液面高度并拍照。乳析指數(creaming index,CI)的計算方法如公式(1)所示:
(1)
式中:Hc,乳相層的高度,mm;Ht,樣品總高度,mm。
1.3.4 乳液流變特性的測定
利用Discovery DHR-2型流變儀測定乳液的流變性能,剪切轉子選用40 mm平板,測量溫度為25 ℃,選擇0.1~1 000 s-1的剪切速率測定乳液的靜態剪切流變特性,在1~1 000 rad/s頻率內測定彈性模量(G′)和黏性模量(G″)。
1.3.5 β-胡蘿卜素含量的測定
準確稱取1 g乳液,正己烷+乙醇(3∶2,體積比)混合溶劑連續提取3次,合并上相,定容至10 mL,以正己烷為參比,測定450 nm處吸光度,結果通過標準曲線算出。
1.3.6 乳液氧化穩定性的測定
將制備的乳液分裝于樣品瓶中,將樣品瓶放置于45 ℃下貯存,定期取樣測定乳液的氧化程度:過氧化值(peroxide value,POV)。
根據KIOKIAS等[15]的方法,吸取0.5 mL樣品乳液,加入5 mLV(異辛烷)∶V(異丙醇)=2∶1的混合溶劑,混合均勻后,在8 000 r/min的轉速下離心2 min。吸取2 mL上清液,分別加入20 μL的硫氰酸鉀和FeCl2溶液,再用V(甲醇)∶V(正丁醇)=2∶1的混合溶劑定容至5 mL,混合均勻后在室溫下避光靜置20 min,以V(甲醇)∶V(正丁醇)=2∶1的混合溶劑作空白對照,于510 nm下測定其吸光度。POV計算如公式(2)所示:
(2)
式中:POV,樣品的過氧化值,meq/kg;A,樣品的吸光度;K,Fe3+標準曲線的斜率(實驗計算得到斜率為1.82);55.86,Fe的原子量;m,稱取的樣品中油脂的質量,g;0.5,O/Fe的摩爾比;n,吸取上清液的體積分數;2,氧換算為POV值的系數。
1.3.7 體外消化模型的構建
參考YUAN等[16]的方法并稍作修改構建體外消化模型。
模擬口腔消化液:將0.03 g/mL黏蛋白的溶解在pH 7.0的磷酸緩沖鹽溶液(phosphate buffered saline,PBS)中來制備模擬唾液(simulatated saliva fluid,SSF)。將SSF在37 ℃下預熱2 min,然后將7.5 mL初始乳液與7.5 mL SSF混合。將樣品的pH值調節為6.8,并在37 ℃和100 r/min下孵育10 min。
模擬胃消化液:通過添加2 g NaCl和3.2 g胃蛋白酶制備1 L模擬胃液(simlated gastric fluid,SGF),然后使用1.0 mol/L HCl將溶液的pH值調節為1.2。將來自口相的樣品與SGF以1∶1的體積比混合,然后通過添加1.0 mol/L HCl調節pH值為2。將所得混合物在37 ℃下振蕩孵育2 h以模擬胃消化過程。
模擬小腸消化液:將來自胃相的30 mL樣品的pH值調節為7.0。然后,將模擬的腸液[2.5 mL酶懸浮液(60 mg胰酶和60 mg PBS中的脂肪酶,pH 7.0),1.5 mL 鹽溶液(36.7 mg/mL CaCl2和218.7 mg/mL NaCl)和3.5 mL的膽鹽溶液(PBS含有187.5 mg,pH 7.0)]加入樣品中。并將混合體系的pH值調節為7.0,采用光學顯微鏡放大40倍觀察消化過程中乳液形態結構的變化。
1.3.8 β-胡蘿卜素的生物可給性測定
以β-胡蘿卜素的質量濃度(X)為橫坐標,吸光度(Y)為縱坐標繪制β-胡蘿卜素標準曲線,得到線性回歸方程Y=0.213 3X+0.028 9,R2=0.999 2。通過測定450 nm處樣品吸光度,計算樣品中β-胡蘿卜素的質量濃度。β-胡蘿卜素的生物可給性被認為是來自食品基質或補充劑被摻入混合膠束中并能被腸道吸收的部分[17]。簡而言之,將收集的小腸消化液在8 000×g離心30 min。收集透明的膠束相,并根據繪制的標準曲線分析β-胡蘿卜素的含量。并根據公式(3)計算β-胡蘿卜素的生物可給性:
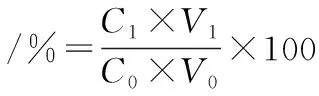
(3)
式中:C1為樣品經過體外消化后β-胡蘿卜素的質量濃度(μg/mL);V1為收集的小腸消化液體積(mL);C0為樣品未經體外消化β-胡蘿卜素的質量濃度(μg/mL);V0為樣品未經消化的體積(mL)。
1.4 數據統計分析
所有實驗至少重復3次,數據以x±s表示(x為平均值,s為標準偏差,n=3),并采用 GraphPad Prism 8進行繪圖,SPSS 22 軟件(IBM,美國)進行方差分析,實驗數值間以Duncan法進行顯著性差異分析(P<0.05)。
2 結果與分析
2.1 熱穩定性分析
2.1.1 乳析指數分析
乳液的乳析指數是關于乳液中油相和連續相之間平衡穩定狀態的指標,是評價乳液物理穩定性的一個非常重要的參數[18]。由圖1可知,隨著溫度升高乳液的乳析指數呈現上升的趨勢,在20 ℃時,混合乳液、雙層乳液的乳析指數分別為20%、23.3%;而當溫度升高的80 ℃時,混合乳液、雙層乳液的乳析指數分別為30.8%、26.7%,分別較20 ℃時增大了54%、14.6%,結果表明雙層乳液具有較強的熱穩定性。隨著溫度的升高,乳析指數增加可能是受布朗運動和重力等因素的影響,使乳液中的液滴處于連續運動狀態而發生相互碰撞導致的[19]。

混-混合乳液;雙-雙層乳液圖1 不同溫度處理下乳液的宏觀圖Fig.1 Macro view of emulsion under different temperature treatments注:乳析指數已在圖中標示
2.1.2 β-胡蘿卜素保留率分析
由圖2可知,2種乳液中β-胡蘿卜素的保留率均隨著溫度的升高而下降。混合乳液在40~80 ℃條件下的保留率分別為76.4%、55.8%、53%,雙層乳液在此條件下β-胡蘿卜素的保留率分別為91.8%、84.8%、74%。雙層乳液對于β-胡蘿卜素的保護作用強于混合乳液,其原因為雙層乳液表面具有較厚的乳化劑層,可以有效提高雙層乳液的穩定性,有效阻隔可以誘導β-胡蘿卜素分解的外界因素[17]。而混合乳液對于β-胡蘿卜素的保護作用最差,是因為混合乳液形成前,蛋清蛋白Pickering顆粒與殼聚糖發生聚合,具有較大的粒徑,無法在乳液表面吸附形成致密的乳化劑層,所以在經過熱處理的時候,乳滴熱運動加劇,使得乳液容易發生碰撞而破壞乳液表面的結構,從而導致β-胡蘿卜素容易接觸外界環境而分解。由圖1可以看到,隨著溫度的升高,乳液的顏色隨之變淺,說明乳液的中的β-胡蘿卜素含量越來越低,即圖1的結果與圖2中乳液中的β-胡蘿卜素的保留率變化相一致。
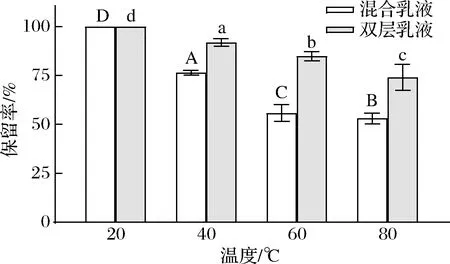
圖2 溫度對β-胡蘿卜素保留率的影響Fig.2 The effect of temperature on β-carotene retention注:圖中不同大/小英文字母表示差異顯著(P<0.05)(下同)
2.2 抗消化穩定性分析
2.2.1 抗消化穩定性分析
使用光學顯微鏡對β-胡蘿卜素乳液在模擬體外消化過程中的微觀結構進行觀察。由圖3可知,與經過口腔消化的乳液相比,2種乳液經過胃消化后仍能保持完整的乳滴結構。但是經過胃消化120 min后,混合乳液中液滴的密度明顯下降,還出現了大量較大粒徑的乳滴。其原因為混合乳液表面的蛋清蛋白凝膠顆粒與殼聚糖分子無序吸附在乳滴表面,液滴表面的乳化劑在極酸性環境下與胃蛋白酶、電解質(Na+、K+、Cl-等)混合,造成界面層被破壞[20]。而雙層乳液經過胃消化過程后乳滴密度也稍有減小,乳液粒徑略微增大,說明雙層乳液在強酸環境中具有較好的穩定性。混合乳液則在小腸消化90 min后出現破乳現象;而雙層乳液在整個小腸消化過程中保持完整的乳液結構,但是乳液的粒徑明顯增大,其原因為雙層乳液具有較厚的界面層,可以有效減乳液結構被破壞[21]。
2.2.2 生物可給率分析
在小腸消化階段,由于載體油的水解,包埋在乳液中的營養物質會被釋放,并溶解在膽汁鹽膠束中,進而被小腸吸收[22]。混合乳液、雙層乳液中β-胡蘿卜素的生物可給率分別為25.5%、40.2%。結果表明,通過構建蛋清蛋白-殼聚糖雙層乳液遞送載體可以有效提高β-胡蘿卜素的生物可給率。其原因為經過體外消化后,消化液中的脂肪酶、膽鹽等可與乳液體系中的乳化劑發生競爭性取代,吸附于乳滴表面,分解油脂,釋放β-胡蘿卜素,被小腸細胞吸收利用[17]。而雙層乳液仍能保持完整的乳液結構,具有較大的比表面積,有利于脂肪酶、膽鹽等吸附,促進脂溶性膠束的形成,從而提高β-胡蘿卜素的生物可給率;而混合乳液經過小腸消化后,乳液結構被破壞,具有較小的比表面積,油脂的分解速度較慢,進而抑制脂溶性膠束的形成。雙層乳液具有較高的生物可給率的原因還可能為雙層乳液具有較強的穩定性,經過腸胃消化仍能保持完整的乳液結構,隔絕外界環境,防止乳液中β-胡蘿卜素的降解,而混合乳液在消化過程中出現破乳現象,油脂發生聚集而與外界環境直接接觸,導致β-胡蘿卜素發生降解。
2.3 貯藏穩定性分析
2.3.1 乳液粒徑分析
由圖4可知,乳液的粒徑均隨著貯藏時間的延長,乳液的粒徑顯著增大(P<0.05)。新鮮制備的混合乳液、雙層乳液的粒徑分別為99.5、77.4 μm,在貯藏15 d后,乳液的粒徑分別為129.5、89.8 μm,分別較新鮮乳液增大了30.2%、16.1%。其中,雙層乳液的穩定性最好,而混合乳液的穩定性最差;其原因為混合乳液表面的乳化劑為蛋清蛋白Pickering顆粒與殼聚糖分子通過靜電作用形成的復合物,粒徑較大,無法再油滴表面形成致密的保護膜,且乳液表面的電勢很小,乳滴之間的靜電斥力較小,所以在貯藏期間乳液在發生運動時容易發生碰撞,然后聚合形成粒徑較大的乳液;而雙層乳液則是油滴表面具有2層乳化劑薄膜,可以有效減小乳滴在碰撞過程中的聚合機率,減緩乳滴粒徑增大的速度[3]。
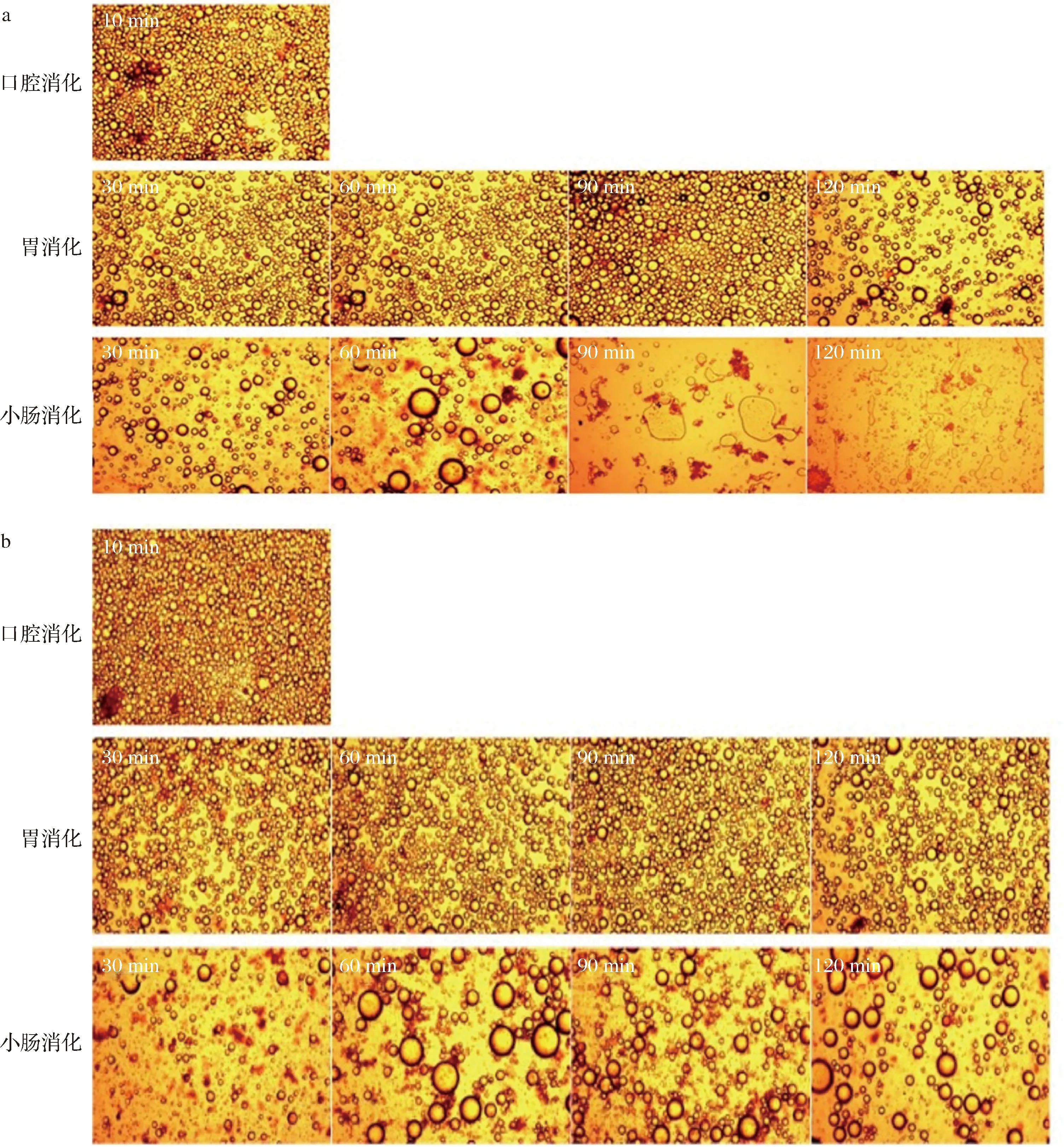
a-混合乳液;b-雙層乳液圖3 乳液體外消化過程中的微觀結構Fig.3 Microstructure of emulsion in vitro digestion注:圖中放大倍數為40倍
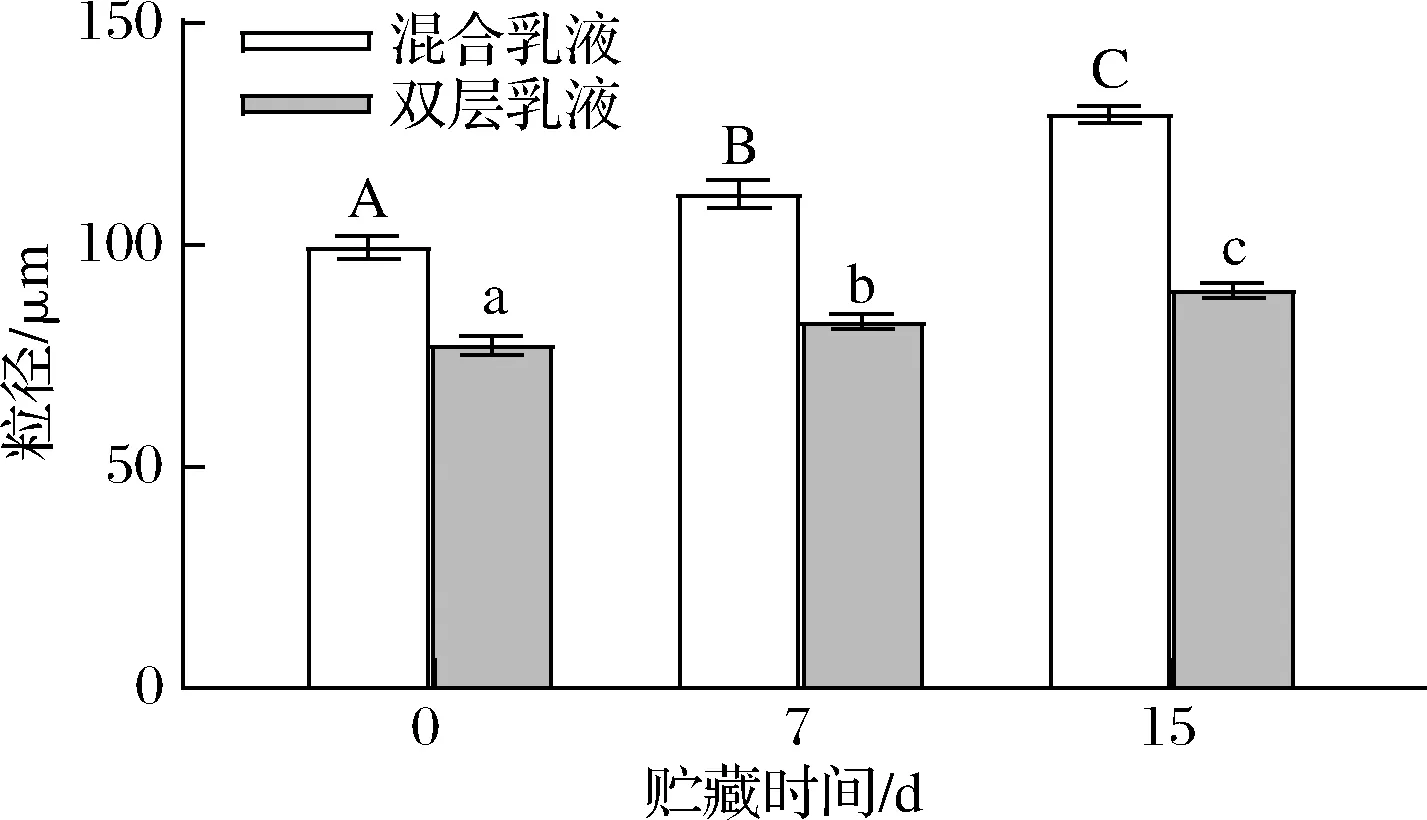
圖4 不同種類乳液貯藏期間粒徑變化Fig.4 Changes in particle size of different types of emulsions during storage
2.3.2 β-胡蘿卜素保留率分析
由圖5可知,負載β-胡蘿卜素的2種不同乳液中β-胡蘿卜素的的保留率隨著時間的延長均顯著下降(P<0.05)。在第3天時,2種不同種類乳液中β-胡蘿卜素的保留率分別為78.3%、85.1%。在貯藏15 d后,2種乳液中β-胡蘿卜素的保留率分別為32%、50.3%。其中,混合乳液中β-胡蘿卜素的保留率低于雙層乳液,這種現象主要歸因于混合乳液的不穩定性,表面的穩定劑層容易被破壞,雙層乳液的乳滴表面具有致密的雙層乳化劑膜,可以有效阻隔可以誘導β-胡蘿卜素分解的外界因素。此外,有研究表明β-胡蘿卜素的保留率隨著乳液粒徑的減小而增加[23]。由此可見,雙層乳液對于β-胡蘿卜素的保存效果最好。
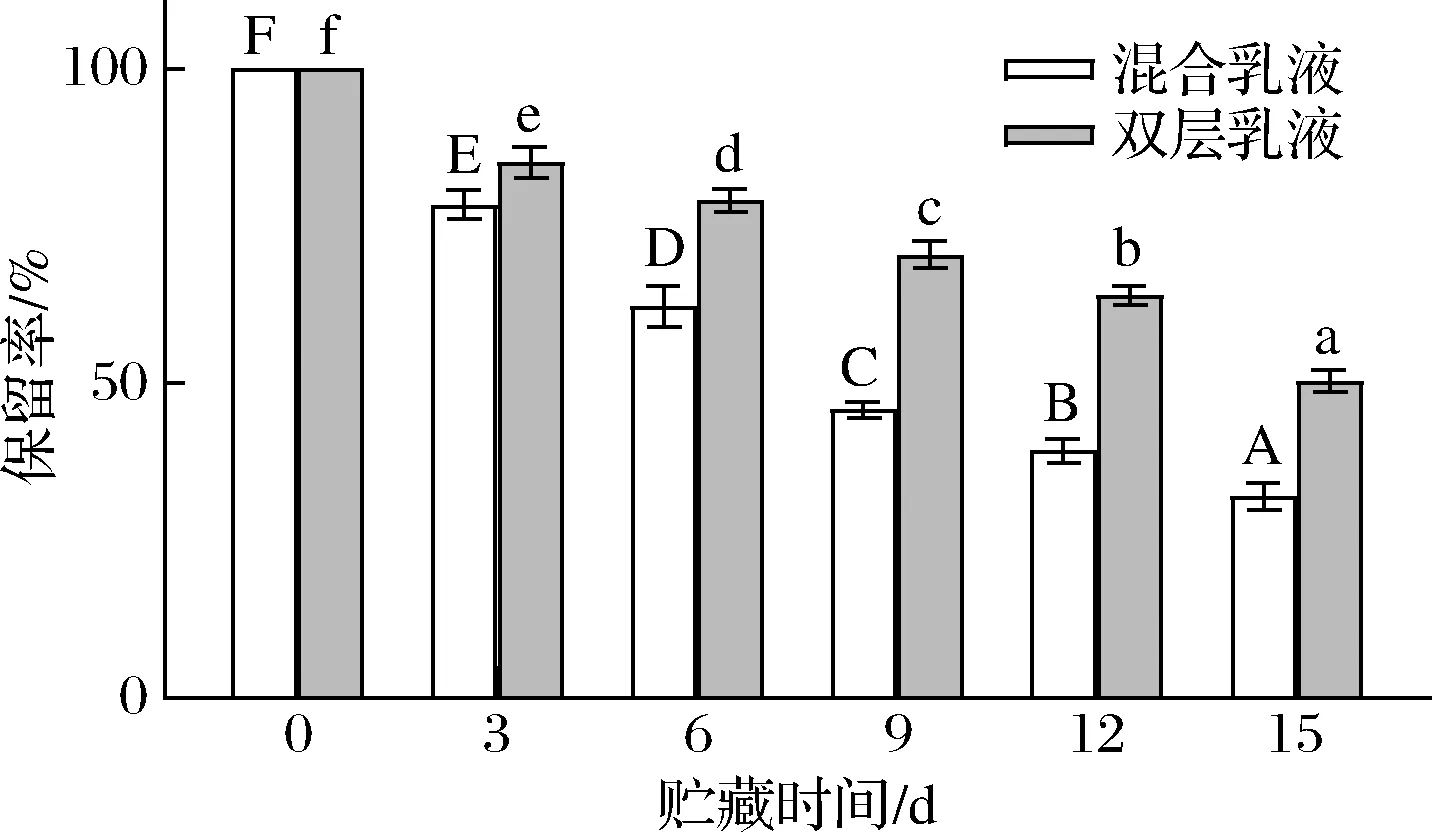
圖5 貯藏期間乳液中β-胡蘿卜素保留率的變化Fig.5 Changes in β-carotene retention rate in emulsion during storage
2.3.3 氧化穩定性分析
2種乳液中POV的含量隨著貯藏時間的變化如圖6所示。乳液中油脂的POV值均隨著氧化時間的延長而顯著增加(P<0.05),說明乳液的氧化穩定性降低。在第15天時,負載β-胡蘿卜素的混合乳液和雙層乳液中油脂的POV值分別為62.7、39.3 meq/kg。由此可見,雙層乳液中油脂氧化穩定性優于混合乳液。其原因為雙層乳液表面電勢接近于0或者帶正電,與連續相中同樣帶正電的促氧化劑發生排斥反應,減緩乳液中的油脂與促氧化劑接觸而發生氧化[24]。同時,雙層乳液表面的界面膜層數以及厚度的增加可以為油-水界面提供極強的界面屏障,進一步抑制了油脂與促氧化劑發生氧化反應。而混合乳液表面的蛋清蛋白顆粒與殼聚糖形成的聚合物粒徑較大,乳滴表面無法形成致密的保護膜,乳液中的油脂容易接觸連續相中的促氧化劑,導致混合乳液的氧化穩定性最差。
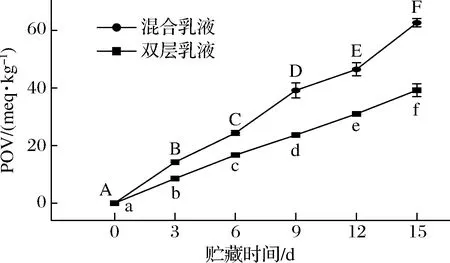
圖6 不同種類乳液貯藏期間氧化穩定性變化Fig.6 Changes in oxidation stability of different types of emulsions during storage
3 結論
本研究對比了蛋清蛋白-殼聚糖混合乳液與蛋清蛋白-殼聚糖雙層乳液負載β-胡蘿卜素后,其熱穩定性、抗消化穩定性和貯藏穩定性的變化。結果表明,熱處理后雙層乳液的粒徑變化更穩定,且80 ℃處理后雙層乳液的β-胡蘿卜素的保留率更高,表現出較強的熱穩定性。在體外消化過程中,雙層乳液的抗消化穩定性更好。在貯藏期間,雙層乳液能夠較好地保留β-胡蘿卜素,且在貯藏15 d時,負載β-胡蘿卜素的雙層乳液中油脂的POV值較混合乳液低23.4 meq/kg。因此,雙層乳液有利于抵抗環境因素如溫度、光照等的影響,可以在一定程度上延緩生物活性物質的降解,雙層乳液的制備為生物活性物質的遞送提供了一種新的思路。

