基于網絡藥理學探討小柴胡湯增強鼻咽癌放療敏感性的分子機制
裴路,仇雯麗,王佳佳,李紅閣,楊鳳蓮,王俊利
(1.右江民族醫學院附屬醫院生殖中心,廣西百色 533000;2.右江民族醫學院a.研究生學院,b.藥學院,c.檢驗學院,廣西百色 533000)
鼻咽癌(nasopharynx cancer,NPC)是一種起源于鼻咽黏膜內層的上皮癌[1],在兩廣地區高發。鼻咽癌惡性程度高,75%~90% 的新發病例已為局部晚期,常伴有頸部淋巴結轉移,鼻咽癌的一線治療是放射治療。雖然放療可以提高局部控制率,延長患者5年生存率至82.1%~83.3%,但放療后的復發與遠處轉移是臨床治療中面臨的兩大難題[2]。小柴胡湯(XCHD)出自《傷寒論》,是傳統的和解少陽之方劑,由柴胡、黃芩、半夏、甘草、大棗、人參、生姜組成,其中柴胡為君,用量最大[3]。本研究借助網絡藥理學,深入挖掘小柴胡湯增強鼻咽癌放療敏感性的潛在靶點和作用機制,為小柴胡湯的進一步研究提供方向,為臨床用藥提供理論依據。
1 材料與方法
1.1 尋找NPC放療抵抗差異性表達基因通過GEO數據庫,搜索關鍵詞“nasopharynx cancer radiotherapy”得到GSE48501數據集,該數據集通過鼻咽癌抗輻射亞克隆CNE2-IR細胞系按照實驗方案進行5輪亞致死劑量照射(11 Gy)培養生產,以放療敏感的親代細胞系CNE2細胞系為對照并進行測序,下載該數據集通過R4.0.5對這些數據整理和注釋并通過edgeR包用于標準化基因表達,篩選條件為:(| log2FC| >1 和調整后的P<0.05),得到2731個差異表達基因,1551個上調表達基因,1180個下調表達基因,并通過“clusterProfiler”“org.Hs.eg.db”和“enrichplot”等R包進行基因本體論(GO)和京都基因與基因組百科全書(KEGG)通路分析進行功能注釋。
1.2 XCHD有效成分及靶標的尋找XCHD的有效成分從中藥系統藥理學(TCMSP)數據庫下載(http://lsp.nwu.edu.cn/tcmsp.php),其中包含很多中藥條目,藥物疾病網絡和藥物靶點網絡。可從TCMSP數據庫中獲得大量草藥信息,包括成分、分子名稱、分子量(MW)、藥物相似性(DL)、人類口服生物利用度(OB)、半衰期(HL)、水分配系數(AlogP)、氫鍵供體和受體的數目(Hdon/Hacc)、Caco-2滲透性(Caco-2)。OB是口服藥物最重要的藥代動力學特性之一,評價藥物向全身循環的傳遞效率。其值由課題組前期研發的OBioavail 1.1 模型計算得出[4]。OB表示一個單位口服用藥劑量能夠產生藥效的百分數,是決定活性分子類藥性的關鍵指標。DL用于評估化合物成為藥的可能性,只有具有較高OB和DL的分子才可能具有良好的藥理學活性。參考Drug Bank數據庫中藥物的DL均值為0.18,所以將口服生物利用度標準采用≥30%、DL≥0.18的成分視為有效成分。得到246個有效活性成分。
1.3 將藥物有效基因與NPC差異表達基因交集得到交集基因通過TCMSP數據庫篩選XCHD的有效成分后,將有效成分上傳到PubChem(https://www.ncbi.nlm.nih.gov/)多功能Web服務器,用于基于分子3D相似性方法探索藥理學和化學結構的關聯。我們從ChemMapper數據庫中搜索了XCHD中每種活性成分的預測目標,并根據3D結構相似性高于1.0和預測得分高于0的標準進行了篩選,找到了有效成分的二維結構。此外,Uniprot(https://www.uniprot.org/uploadlists/)用于標準化預測的靶標,并以基因ID的形式表達它們。為了提高目標的可信度,使用STITCH數據庫(http://stitch.embl.de/,這是用于檢索預測化合物與目標蛋白之間相互作用的常用數據庫)預測目標。最后,制作了維恩圖,并將兩個數據庫的交集視為XCHD的最終基因靶標。其中XCHD包括7種中藥成分,一共得到246種有效活性成分,其與NPC差異性表達基因進行交集得到38個交集基因。
1.4 化合物-靶標-疾病(CTD)網絡構建使用Cytoscape(v.3.8.0)分別構建中藥中具有活性成分的246個靶基因和藥物-疾病相同的38個基因的靶標網絡及化合物-靶標-疾病(CTD)網絡,可以看到XCHD活性成分網絡與分子靶向預測的靶標以及化合物-靶標-疾病(CTD)網絡核心關系。網絡分析器插件用于根據以下標準識別關鍵有效成分和關鍵候選目標:程度值超過網絡中所有節點平均值的節點。程度值是節點在網絡中具有的邊數,它指示一個節點與多少個草藥/成分/目標相關。如果節點的度數值較大,則認為該節點在網絡中起著更重要的作用。
1.5 交集基因蛋白互作網絡(PPI)的構建從STRING數據庫獲得疾病和目標PPI數據,對得分≥0.04的PPI數據進行了篩選,將結果導入Cytoscape 3.7.1構建小柴胡湯-target-鼻咽癌PPI網絡。
1.6 將交集基因進行GO、KEGG富集分析使用R軟件處理上述38個交集基因,分別利用clusterProfiler、org.Hs.eg.db、enrichplot、ggplot2,pathview插件包(vision 3.6.2)進行GO與KEGG的可視化,P值過濾條件為:PvalueFilter<0.05,矯正后的P值過濾條件qvalueFilter<0.05。為了進一步闡明XCHD有效成分治療NPC的作用機制,對選定的靶標注明了化學癌變-受體的激活、p53、凋亡等信號通路。
2 結 果
2.1 尋找NPC放療抵抗差異性表達基因通過GEO數據庫,搜索關鍵詞“nasopharynx cancer radiotherapy”得到2731個差異表達基因,1551個上調表達基因,1180個下調表達基因。見圖1。
2.2 XCHD有效成分及靶標的尋找XCHD的有效成分從TCMSP數據庫下載(http://lsp.nwu.edu.cn/tcmsp.php),根據OB和DL對小柴胡湯中的活性成分進行篩選,分別得到柴胡活性成分17個、黃芩活性成分36個、半夏活性成分13個、甘草活性成分92個、人參活性成分22個、生姜活性成分5個、大棗活性成分29個。見表1。
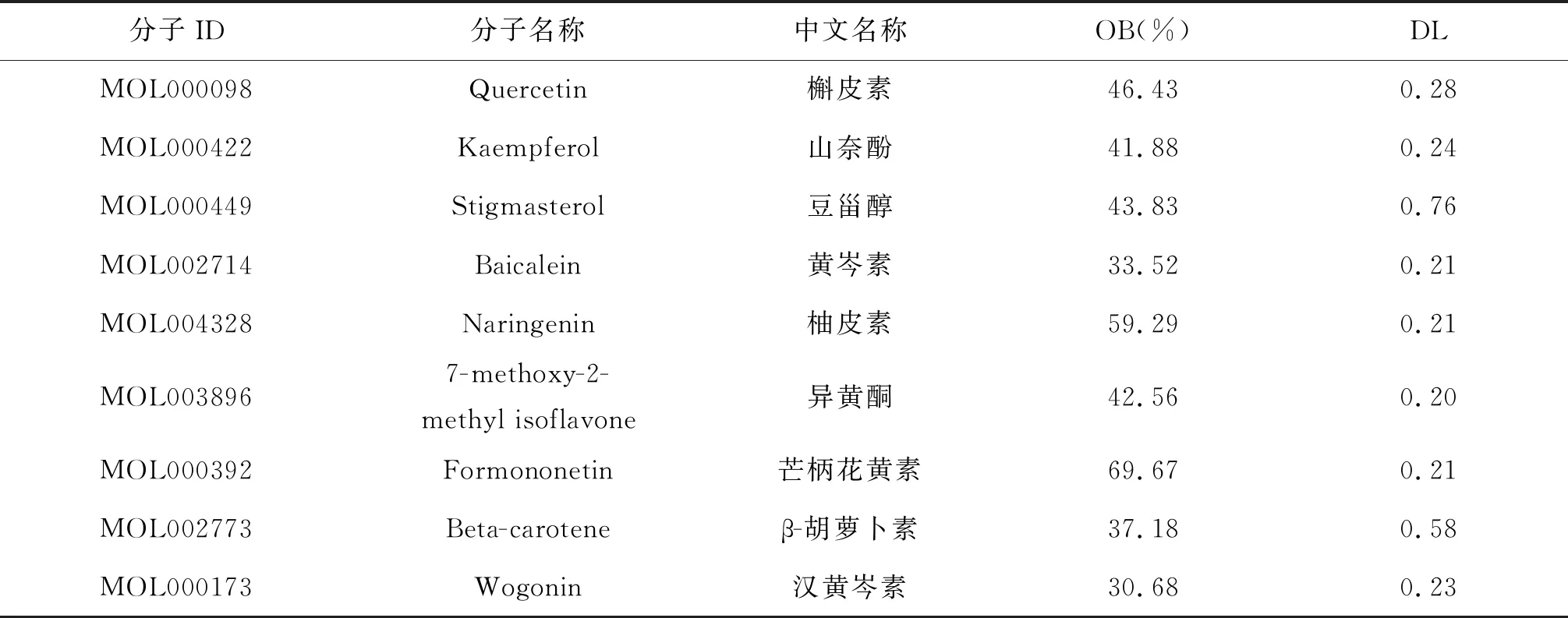
表1 小柴胡湯中靶點數目排名前9位的潛在有效活性成分
2.3 將藥物有效基因與NPC差異表達基因交集得到交集基因將藥物有效基因與NPC差異表達基因交集得到38個交集基因。見圖2。
2.4 化合物活性成分靶點網絡的構建活性成分靶點網絡包括138個節點,215條線。拓撲結果顯示,“degree”值較高的成分是槲皮素(quercetin,MOLD00098)、山奈酚(kaempferol,MOL000422)、漢黃芩素(wogonin,MOL000173)、芒柄花黃素(formononetin,MOL000392)、異黃酮(7-Methoxy-2-methyl isoflavone,MOL003896)、豆甾醇(stigmasterol,MOL000449)、柚皮素(naringenin,MOL004328)、β-胡蘿卜素(beta- carotene,MOL002773)、黃芩素(ba-icalein,MOL002714)等,小柴胡湯主要通過9個活性成分作用于PPARG、RXRA、ACHE、MAOB、CASP3、CYP3A4、BAX 7個靶標基因,這7個靶標基因可能影響增強鼻咽癌放療敏感性。見圖3。
2.5 靶點PPI的構建從STRING數據庫獲得疾病和目標PPI數據,對得分≥0.04的PPI數據進行了篩選,將結果導入Cytoscape 3.7.1構建小柴胡湯-target-鼻咽癌PPI網絡。蛋白互作網絡中“degree”值較高的靶點是PPARG、RXRA、ACHE、MAOB、CASP3、CYP3A4、BAX等,提示這些靶點可能是小柴胡湯增強放療敏感性的關鍵作用靶點。見圖4。
2.6 GO功能富集分析將上述得到的38個交集靶點通過R語言的Bioconductor生物信息軟件包進行GO功能富集分析。GO功能富集分析主要包括生物過程(biological process,BP)、細胞組分(cellular component,CC)和分子功能(mo-peculiar function,MF)三部分。根據P值升序排列結果前10條顯著富集的條目,生物過程BP主要涉及對藥物反應、氧化應激、對有毒物質反應、RNA聚合酶調控、細胞黏附;細胞組分涉及細胞膜、膜筏、膜微域等方面;分子功能涉及藥物結合、蛋白質結合、酶結合和酶活性等方面。見圖5。
2.7 KEGG通路富集分析通過R語言軟件的Bioconductor生物信息軟件包進行KEGG通路富集分析后,富集比較明顯的前20個通路,包括: 化學致癌作用中-受體的激活、丙型肝炎信號通路、P53信號、凋亡等信號通路。見圖6。
3 討 論
小柴胡湯具有免疫調節和抗腫瘤作用。本研究結合GEO數據挖掘和網絡藥理學,分析預測小柴胡湯增強鼻咽癌放療敏感性的潛在藥理機制。小柴胡湯含有多種活性成分,可影響多個靶點和作用途徑。使用TCMSP數據庫篩選出OB≥30%、DL≥0.18的小柴胡湯相關活性化合物,構建了活性化合物-靶基因網絡。結果表明,靶點富集較多的前3位化合物是槲皮素、山奈酚、芒柄花黃素(FN)。
槲皮素是廣泛存在于水果、蔬菜及中草藥中的天然黃酮醇類化合物,可調節細胞內外AMPK途徑、PI3K-AKT途徑和mTOR等多個信號通路[5-6],進而影響腫瘤細胞的生長。SU等研究表明,槲皮素可通過AMPK信號通路激活誘導膀胱癌細胞凋亡[7],其誘導細胞凋亡的作用機制可能是通過下調Bcl-2蛋白的表達而實現。槲皮素可通過調節miR-16-5p和WEE1的表達增強NSCLC細胞的放射敏感性[8];也可通過靶向Notch-1通路增強結腸癌細胞的放射敏感性[9]。山奈酚是一種安全且潛在的放射增敏劑,可通過抑制AKT/PI3K和ERK通路以及激活線粒體凋亡通路,在體外和體內增加了輻射對腫瘤細胞的殺傷作用[10]。FN是一種從紅三葉草中提取的功能性植物雌激素[11],越來越多的證據表明FN對某些惡性腫瘤具有有效的藥理活性,包括乳腺癌、卵巢腫瘤和肝癌[12],此外,另一項研究表明,FN抗NPC是通過直接參與抑制鼻咽癌細胞的增殖過程,其藥理機制與誘導線粒體依賴性細胞凋亡有關,FN的抗增殖和侵襲性益處是通過抑制細胞ERK1/2通路和滅活NPC細胞中的細胞內Lamin A/C信號來實現的[13]。本研究中靶點富集較多的槲皮素、山奈酚、芒柄花黃素在抗腫瘤方面的作用研究較少,可能是有價值的研究方向。
PPI網絡分析結果表明,NPC中有5個樞紐基因MAPK3、CAT、CASP3、PPARG和CCND1受小柴胡湯調節。MicroRNA-143靶向MAPK3調節人乳腺癌細胞的增殖和骨轉移。CASP3的遺傳變異可能會增加頭頸部鱗狀細胞癌的風險;CASP3是一種重要的凋亡成分,是細胞凋亡的關鍵分子,細胞凋亡的形態變化是一系列胱天蛋白酶活化并水解底物的結果,其異常功能或許在癌癥發病機制中起關鍵作用[14]。在人類非小細胞肺癌細胞中,PPARγ的激活能夠克服 NRF2 依賴性化學抗性,在基底樣乳腺癌中,PPARG激活顯著降低了MnSoD的表達并增加了化學敏感性[15]。到目前為止,PPARG的參與已在一些其他位于頭部或頸部的鱗狀細胞癌中進行了探索,lncRNA HCG18在NPC中高度表達,并與NPC患者的不良預后相關。HCG18通過調節miR-140/CCND1軸和Wnt/β-catenin與Hedgehog途徑充當腫瘤啟動子[16]。CCND1的過度表達是人類癌癥的公認標志,通過催化SAGA亞基 USP22控制CCND1泛素化對于癌細胞通過G1的細胞周期進程十分重要。
在GO富集方面,我們推斷小柴胡湯可能通過干擾對藥物的反應、轉錄RNA聚合酶Ⅱ啟動子的轉錄、氧化應激、對有毒物質反應、細胞黏附。RNA聚合酶Ⅱ是一種RNAP酶,存在于真核細胞的細胞核中,與NPC細胞的生長有關。KEGG通路富集分析結果顯示化學癌變-受體的激活、p53、凋亡和癌癥中的通路相關。有相關文獻報道,在神經母細胞瘤小鼠模型中,p53的缺失誘導體內放射抗性[17],在黑色素瘤中,p53的恢復有利于體內放射敏感性[18]。 在NPC細胞和小鼠中,發現MDM2抑制劑可抑制MDM2并增強TP53的mRNA和蛋白質水平,并促進細胞凋亡和腫瘤生長[19]。鼻咽癌組織內存在TP53基因突變,其可通過調控Bcl-2和Bax的表達,阻滯細胞周期,誘導細胞衰老或凋亡[20]。因此,我們提出小柴胡湯對NPC的藥理作用可能通過這些途徑發生。本研究也存在不足,中藥單體是多靶點、多通路綜合作用的結果,由于數據庫不完善以及計算機無法真實模擬體內環境,因此本研究著重于理論分析,后期仍需要更多體內和體外實驗進行驗證,但這為后續機制實驗及臨床用藥提供理論依據。

