注射液中不溶性微粒的統計學分析
*魏靜 秦天琦 吳愫青
(珠海市食品藥品檢驗所 廣東 519090)
注射劑不溶性微粒是指除氣泡外,隨機存在于液體制劑包括滅菌粉針劑所制成的液體中的可流動的不溶性外來物質,其粒徑在50μm以下,肉眼看不見,具流動不溶性,在肌體內不能代謝[1]。不溶性微粒的種類主要包括無機微粒:如金屬顆粒、玻璃碎屑、礦物塵粒等;有機微粒:如植物纖維、人的皮屑、塑料等;生物微粒:如細菌、霉菌、芽孢等。產生它的途徑,一是來源于外源污染如金屬屑、橡膠屑、纖維、粉塵、晶體、碳化物等;二是來源于內源因素,如注射劑生產、儲存、運輸過程及臨床配藥操作污染等途徑引入的污染[2],以及藥物配伍時理化性質的變化而產生的[3]。其粒徑超過一定大小,或數量超過一定限度,就會在人體內蓄積,會對人體產生一些危害,可引起肺水腫、靜脈炎、熱原樣反應、血栓、組織壞死等,嚴重時甚至還可引起過敏反應危及生命,因此有必要對注射劑的不溶性微粒進行檢查并嚴格控制其數量[4]。
很多國家藥典中均制定了不溶性微粒檢查的限度,《中國藥典》2020年版四部通則0903不溶性微粒檢查法光阻法[5]的限度規定為:(1)每1ml中含10μm及10μm以上的微粒數不得過25粒,含25μm及25μm以上的微粒數不得過3粒(標示裝量為100ml或100ml以上的靜脈用注射液);(2)每個供試品容器中含10μm及10μm以上的微粒數不得過6000粒,含25μm及25μm以上的微粒數不得過600粒(標示裝量為100ml以下的靜脈用注射液、靜脈注射用無菌粉末、注射用濃溶液)。控制微粒數量不超過規定范圍是注射劑質量的重要指標之一,這對于增強其臨床使用的安全性起到了積極作用。本實驗中我們對總計172個批次的注射劑進行了不溶性微粒的測定,這些注射劑為近兩年我所的抽檢樣品,樣品來源基本涵蓋國內目前注射劑的生產廠家,選取的類型也包括了小容量注射劑、大容量注射劑和粉針劑,實驗結果基本能反映出目前國內注射劑不溶性微粒數量的情況,也從一個側面反映出目前國內注射劑生產的質量控制情況,我們對實驗結果進行統計學分析,希望在此基礎上能夠發現不同容量和劑型注射劑不溶性微粒的統計學意義,為注射劑制備過程中可能引入的微粒污染、臨床使用中最大限度減少微粒污染提供理論參考。
1.儀器與試藥
APSS 2000不溶性微粒檢測儀(美國PMS公司),儀器試驗操作環境應不得引入外來微粒,測定前的操作應在潔凈工作臺進行。
不溶性微粒檢查用水:將蒸餾水用孔徑為0.45μm的微孔濾膜過濾即得。經檢測符合《中國藥典》不溶性微粒檢查用水的要求:每10ml含10μm及10μm以上的不溶性微粒數應在10粒以下,含25μm及25μm以上的不溶性微粒數應在2粒以下。
注射劑:總計172個批次。其中靜脈用注射液101批次(小容量注射液76批次,總計23個品種,標示裝量從1ml至20ml;大容量注射液25批次,總計5個品種,標示裝量從100ml至500ml);靜脈注射用無菌粉末71批次,規格10mg至2.5g,總計26個品種。
2.實驗方法
靜脈用注射液:根據注射液的標示裝量不同,取每個批次的供試品不少于4支,小心翻轉20次,充分混勻待測溶液,小心開啟容器,合并至少4個供試品的內容物(使總體積不小于25ml),置于燒杯中,靜置10min使其脫氣泡,置于取樣器上進行測定。依法測定4次,舍棄第1個數據,測定結果以后3次測定數據的平均值為準。根據每個供試品的總體積和每個容器的標示裝量,計算每個容器所含微粒數。
靜脈注射用無菌粉末:取每個批次的供試品至少4支,根據不同品種要求的濃度,每瓶分別精密加入適量微粒檢查用水,緩緩振搖使內容物溶解,合并容器中的溶液(使總體積不小于25ml),置于燒杯中,靜置10min使其脫氣泡,置于取樣器上進行測定。依法測定4次,第1個數據不計,取后3次測定數據的平均值作為測定結果。根據每個供試品的總體積,計算每個容器所含微粒數。
APSS 2000型不溶性微粒檢測儀達到目前所有的USP、E、JP和CHP標準,儀器有多個檢測通道可供選擇,本文根據藥典規定選取≥2μm粒徑,≥10μm粒徑,≥25μm粒徑3個通道,同時采集這3個粒徑通道的數據,并對實驗結果進行匯總分析。
3.實驗結果
(1)不溶性微粒數據的統計學特征
通過分析靜脈用注射液,注射用無菌粉末的不溶性微粒數據,結果發現:≥2μm,≥10μm,≥25μm三種粒徑的微粒數據按每瓶的微粒總數計,均符合指數分布,通過考察樣本數量和樣本中不溶性微粒數量的統計學關系,發現兩者呈負指數相關,即樣本數量越大,不溶性微粒的數量越少。以≥10μm粒徑的微粒數據為例,統計微粒數量與樣本數量的關系,結果如下圖所示。

表1 ≥10μm微粒數與樣本數數據匯總
從圖1可以看出,雖然不同劑型的注射劑≥10μm不溶性微粒的數量分布跨度較大,但大多數樣本均分布在較低微粒數量范圍內,且遠低于藥典規定的限度。說明在不超出藥典規定的限度基礎上,各廠家均能將不同注射劑不同粒徑的微粒數量進行合理控制,盡可能降低不溶性微粒對使用者的影響。
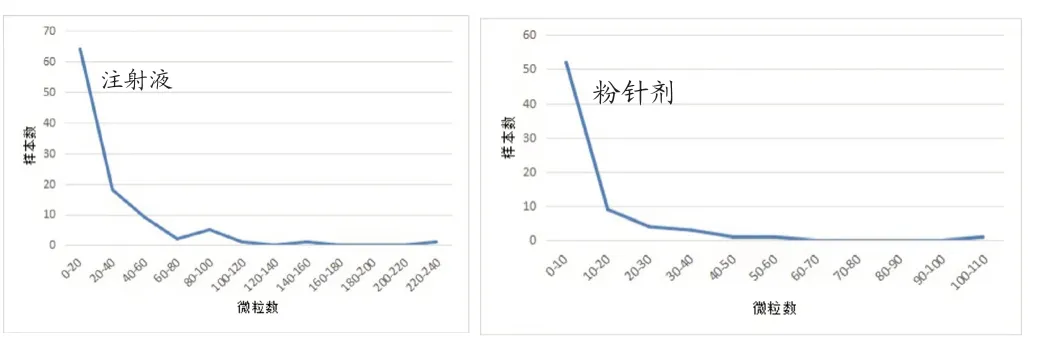
圖1 注射劑≥10μm微粒數與樣本數關系圖
(2)不同類型注射劑的微粒分布的差異
考察小容量注射液(<100ml),大容量注射液(≥100ml),注射用粉針劑,不同粒徑的微粒數量分布,結果如表2所示。

表2 不同劑型注射劑微粒數量分布
從表2可知,考察藥典規定的≥10μm粒徑、≥25μm粒徑兩種微粒,以每瓶中微粒總數作為檢查結果,小容量注射液、大容量注射液和粉針劑的結果均符合藥典規定的限度要求,但廠家和批次之間的結果有一定的差別。例如對于≥10μm的微粒來說,含量最少的樣品每瓶微粒數為0粒,含量最多的樣品每瓶微粒數為234粒,而對于不計入藥典規定限度范圍內的≥2μm的微粒數,這一跨度更為夸張,每瓶微粒數從1粒到10000粒不等,雖然存在偶然誤差的影響,但仍說明不同批次樣品的微粒含量有著巨大差別。這也提示藥廠應以最高的標準要求自己,進一步優化生產工藝,從源頭上降低不溶性微粒的潛在隱患,提高制劑質量。
從表中我們可以看出,在每瓶微粒數量上,小容量注射液>注射用粉針劑>大容量注射液,為了進一步驗證這一結論,我們對不同容量的注射劑微粒數量進行細化分析。
(3)不同容量注射劑微粒數均值的差異
觀察不同劑型注射劑微粒數量分布數據,每瓶微粒數量對比,小容量注射液>注射用粉針劑>大容量注射液。為了進一步驗證這一結論,我們對不同容量的注射劑微粒數量進行細化分析,結果如表3。
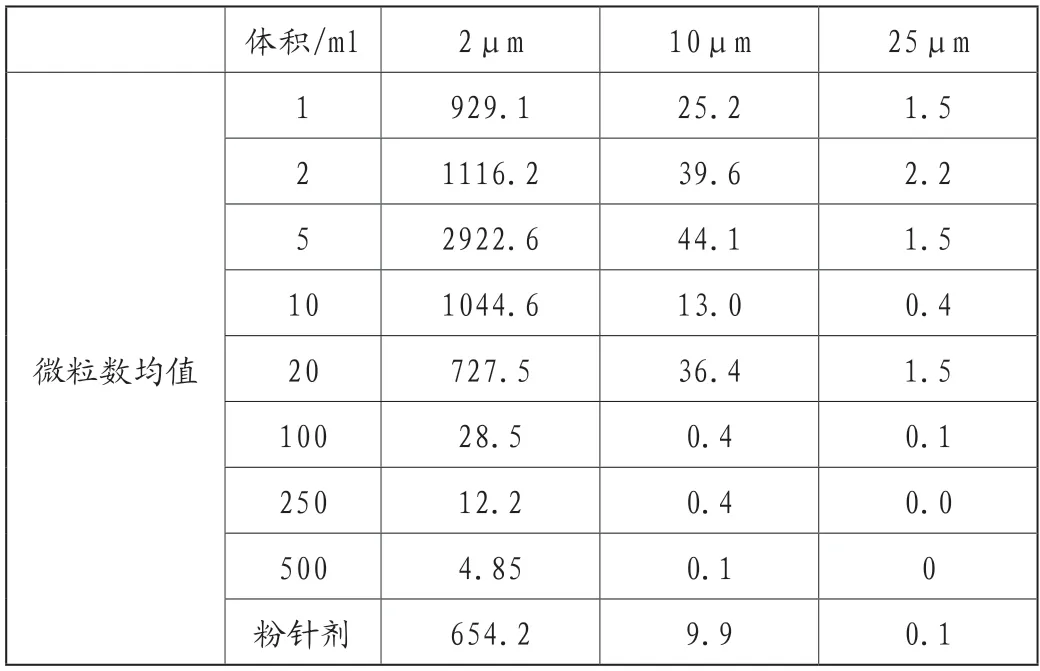
表3 不同容量注射劑微粒數均值
從微粒數均值的數據可以看出,對于藥典規定的≥10μm、≥25μm兩種粒徑的微粒,用于分析的172批次注射劑每瓶中的微粒總數均符合《中國藥典》規定的限度要求,相對于小容量注射液,大容量注射液對人體健康影響更大,標準更嚴格,微粒數更少,制劑安全性更高。注射用無菌粉末的微粒數介于大容量與小容量注射液之間。
我們再以2μm的數據為例,對小容量注射液的不溶性微粒數的數據進行統計學分析,得出以下結果如表4。
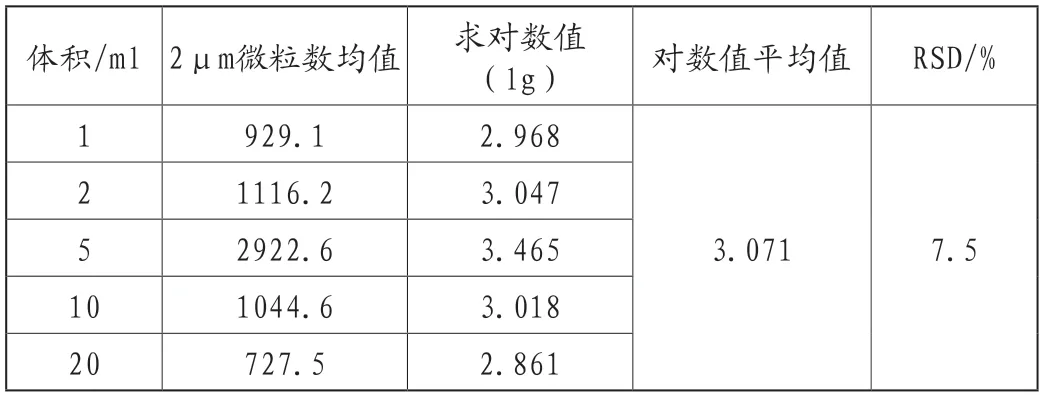
表4 小容量注射液微粒數分析
從數據可以看出,小容量注射液的微粒數的對數值和注射劑自身的體積之間不存在顯著性差異,這和小容量注射液的生產工藝多數是配料、配液、安瓿清洗、安瓿灌封、滅菌等一系列相似的工藝流程有一定的關系。
我們再對以上大容量注射液和粉針劑的2μm數據繼續分析,得到表5的結果。

表5 大容量注射液和粉針劑微粒數分析
數據表明,大容量注射液的體積和不溶性微粒的對數值呈負相關。我們將表5粉針劑的不溶性微粒的對數值和表4小容量注射液微粒數的對數值進行統計學分析,兩者的相對平均偏差為4.3%,不存在顯著性差異,這和注射用無菌粉末在測定前需要用微粒檢查用水進行復溶再測定有一定的關系,其測定結果除了與制劑本身的質量有關以外,還和檢驗者的操作手法、制劑本身的溶解性有一定的關系,如水溶性較差的粉針劑用不溶性微粒檢查用水溶解后檢查時,因為溶解不完全的原因,微粒檢查結果都存在比其他粉針劑結果偏高的現象,這就提示我們,從不溶性微粒的角度來看,對于相同同成分的產品,臨床使用時,注射液與粉針劑應優選注射液,這樣既可以減少不溶性微粒產生的風險,提高患者用藥的安全性,也減少了護士的配液工作量。另外,溶解時的振搖過程,也會將膠塞和瓶壁上的微粒更多的引入溶液中,在一定程度上也會造成結果偏大。
4.討論
通過對172批次注射劑不溶性微粒測定結果的統計學分析,我們發現了不同粒徑微粒的統計學分布特征,以及不同類型和不同容量的注射劑微粒數量分布的差異,并對影響注射劑不溶性微粒數量的因素進行了簡要的分析,不溶性微粒可能來源于產品本身,如高微粒負載的原材料、包裝材料等,也可能來源于一些易產生微粒的生產工藝,如注射用水、噴涂、切割等,還有可能來源于環境,如空氣中的懸浮粒子、手套的粉塵、員工的皮屑、衣物纖維等。通過數據分析,我們對國內注射劑不溶性微粒污染情況有了一個整體了解。
靜脈輸液和靜脈注射療法是現代臨床治療中的重要手段和方法,通過這種治療方法,注射劑中的不溶性微粒一旦進入人體,可終身存在體內,對人體造成危害,如異物微粒可侵入組織形成肉芽腫、可引起局部組織血栓或壞死等,這就直接關系到患者的用藥安全。同時,不溶性微粒的檢查結果也間接地反映出不同企業按照GMP要求生產的差距,對于藥品監管部門的監管和企業落實質量管理主體責任有著一定的參考依據。藥品生產質量管理規范(藥品GMP)自誕生以來在保證藥品質量方面發揮了巨大的作用,1999年8月1日起實施的《藥品生產質量管理規范》(1998年修訂)是其一個里程碑,我國所有藥物制劑和原料藥在2004年7月1日實現按照藥品GMP生產,并且藥品GMP(2010年修訂)中包括了無菌藥品的附錄,這個附錄對注射劑的質量管理也提出了具體要求,藥品GMP的發展歷程對藥品企業做好藥品全生命周期的監管提出了新的挑戰,我們的研究就是建立在此基礎上。希望我們的研究對于藥廠優化生產處方和生產工藝,合理選擇藥包材,提高制劑質量及臨床應用的安全性具有一定的借鑒作用。

