氮氧化富氮骨架的含能材料合成研究進展
郭元盛,呂 璽,李 洋,薛 祺,彌陽麗,崔 偉,南少聰,劉 鵬,張 萌
(1.西安近代化學研究所,陜西 西安 710065;2.中國人民解放軍駐845廠軍代室,陜西 西安 710302;3.陸裝駐西安地區航空軍事代表室,陜西 西安 710065)
引 言
含能化合物是混合炸藥、推進劑和發射藥的能量來源[1],是航空航天、兵器裝備、民用爆破等領域的基礎性材料,而研發高性能骨架結構則是提升化合物能量密度水平最高效的途徑之一[2-5]。研究表明[6-9],N-氧化物鍵的兩性離子性質產生了較大的偶極矩,通常會導致晶體密度增加;同時,N-氧化物提升了整體的氧平衡水平,可以提供更多的氧化性元素來改善分子中燃料的整體燃燒。此外,N-氧化物往往能夠產生額外的穩定作用,N-氧化物的官能團引入常常導致含能材料對外界刺激的敏感度(如沖擊感度、摩擦感度、經典感度等)降低[10-11]。而從成鍵方式角度,根據N—O鍵的不同可以分為兩類結構:一類為中性的芳香性N-氧化物(N-oxides);另一類則為羥胺失去質子后形成的N-氧陰離子(N-oxide anion),屬于離子型化合物。前者氮原子中心為sp2雜化,N—O片段為氮原子提供孤對電子所形成的偶極鍵;后者氮原子中心為sp3雜化,N—O片段為氮氧原子分別貢獻一個電子所形成的單鍵。基于氮氧化富氮骨架的含能材料由于其高生成焓水平以及突出的能量密度水平引起了含能材料研究工作者的重視,成為高性能含能材料結構設計與合成的重點研究方向[12-15]。
基于氮氧化富氮骨架的含能化合物設計與合成根據N—O鍵種類的不同分為富氮芳環N-氧化物及富氮N-氧化陰離子結構。而根據環系排列的不同則進一步可分為3類結構[16]:(1)單環型氮氧化富氮骨架含能材料;(2)串聯型氮氧化富氮骨架含能材料(即以化學鍵將環系進行串聯獲得鏈式結構);(3)并聯型氮氧化富氮骨架含能材料(即以氮氧化富氮骨架并聯所形成的并環結構)。不同的結構類型帶來迥異的性能特征,基于此,本文圍繞氮氧化富氮骨架的含能化合物研究,按照其組成結構方式的不同進行了綜述,并對代表性化合物的性能進行了分析,為含能N-氧化物的研發提供參考,同時也為新型含能化合物研究提供依據。
1 單環型氮氧化富氮骨架的含能材料
對比三類富氮芳環N-氧化物及富氮N-氧化陰離子結構(見圖1),單環型氮氧化富氮骨架的含能材料的骨架結構最為簡單。從合成角度,單環型芳環N-氧化物研究絕大多數是以雜環氮原子的直接氧化為關鍵反應步驟,形成N-氧化物片段,此類轉化需要以氮氧化反應方法學研究為基礎。氮氧化反應實現依賴于氧化劑的篩選,目前可用于氮氧化反應的氧化劑種類豐富,包括雙氧水、間氯過氧苯甲酸(mCPBA)、次氟酸乙腈溶液(HOF/MeCN)、過氧化尿素(UHP)、過硫酸氫鉀復合鹽(Oxone)等[17-23]。如利用mCPBA可將1,2,3-三唑和1,2,4-三唑氧化為相應N-氧化物,其中1,2,3-三唑的N1、N3位易被氧化,1,2,4-三唑的N1、N4位易被氧化[8-10];利用次氟酸的乙腈溶液(HOF/MeCN)可將四唑氧化為四唑-2-氧化物[11-12];利用H2O2-TFAA可將氨基取代的1,2,4,5-四嗪氧化為1,2,4,5-四嗪-1,4-二氧化物等[13],見圖2。

圖1 三分子骨架體系中的富氮芳香族N-氧化物Fig.1 Nitrogen-rich aromatic N-oxides in three molecular skeleton systems


圖2 氮氧化反應的方法學研究Fig.2 Methodological study of nitrogen oxidation reaction
1.1 吡唑N-氧化物結構
對于五元多氮雜環體系,依據氮含量的升高,二氮唑、三氮唑、四氮唑的芳環缺電子效應愈發明顯,導致相關N-氧化轉化反應的難度也逐步加大,同時此類結構中N-氧化物片段主要以N-氧陰離子形式存在。對于二氮唑結構,Shevelev[29]早在1996年即報道了N-羥基二硝基吡唑的合成,以KHSO5作為緩沖溶液可以以20%~48%的中等收率獲得3,4-和3,5-二硝基吡唑的氧化產物,即1-羥基化合物,成為此類研究的起始性工作。在此基礎上,2012年Shreeve[30]以Oxone作為氧化劑,對更加缺電子的3,4,5-三硝基吡唑體系進行了氧化,順利引入了相應的N-羥基的氮氧化物結構。N-羥基結構進一步通過成鹽反應可以獲得各種高氮含量的鹽類含能化合物,見圖3,其中以銨鹽結構的性能最為突出,理論爆速與爆壓分別為8676m/s與35GPa,密度達到1.82g/cm3,生成焓達到118kJ/mol,熱穩定性為176℃,撞擊感度則與RDX相近。

圖3 3,4,5-三硝基吡唑1-氧化物和相應鹽的制備Fig.3 Preparation of 3,4,5-trinitropyrazole 1-oxides and corresponding salts
1.2 三氮唑N-氧化物結構
2012年,Petrie等[31]指出利用Oxone與K2HPO4形成的氧化劑體系具有較強的反應性,可以將4,5-二硝基-1,2,3-三唑以96%產率氧化為相應的N-氧陰離子結構,即4,5-二硝基-1,2,3-三唑-1-氧化物,進一步形成的銨鹽的晶體密度為1.789g/cm3,熱分解溫度為195℃。類似的,當以次氟酸作為氧化劑氧化3,5-二硝基-1,2,4-三唑的鉀鹽時,可以65%的產率獲得相應的N-氧化物鉀鹽,進一步可轉化為銨鹽結構,密度為1.784g/cm3,與其1,2,3-三唑類物密度相近,而分解溫度則降為145℃,見圖4。


圖4 3,5-二硝基-1,2,4-三唑1-氧化物和4,5-二硝基-1,2,3-三唑1-氧化物的制備Fig.4 Preparation of 3,5-dinitro-1,2,4-triazole 1-oxide and 4,5-dinitro-1,2,3-triazole 1-oxide
1.3 四氮唑N-氧化物結構
與三唑體系類似,氮原子排布對四氮唑N-氧化物的熱穩定性影響也非常顯著。四氮唑是氮含量極高的骨架,Klap?tke等[32]利用硝基四唑結構進行了Oxone氧化,實現了高氮氧含量的含能結構的制備(見圖5),并以此為基礎獲得了大量的含能離子鹽。但該類結構中中性羥基中性結構f的計算爆轟性能更加突出,密度1.94g/cm3,爆速9447m/s,爆壓40.4GPa。

圖5 硝基四唑N-氧化物的制備Fig.5 Preparation of nitrotetrazole N-oxide
1.4 噠嗪N-氧化物結構
雖然六元雜環體系的N-氧化物合成研究報道較五元環體系偏少,但化合物1-氧-2,6-二氨基-3,5-二硝基吡嗪(LLM-105)[33]一度被認為有望取代現役鈍感炸藥配方,因而引起各國的普遍關注,并被視為現役單環型富氮芳環N-氧化物最為重要的代表性化合物之一,其制備以2,6-二氨基-3,5-二硝基吡嗪(ANPz)與過氧三氟乙酸反應實現。2018年Klapo?tke等[34]利用二羥甲基取代的氧化噠嗪實現了獨特的3,5-二氨基-4,6-二硝基氧化噠嗪(DADNPO)結構的合成(見圖6),作為LLM-105的同分異構體,DADNPO的密度1.84g/cm3,爆速8486m/s,爆壓30.2GPa,與LLM-105相當。但其爆熱達到4913J/g,爆溫3470K,明顯優于LLM-105(4506J/g和3202K)。

圖6 3,5-二氨基-4,6-二硝基噠嗪-1-氧化物的合成Fig.6 Synthesis of 3,5-diamino-4,6-dinitropyridazine-1-oxide
1.5 嘧啶N-氧化物結構
2018年,張慶華等[35]以2,4,6-三胺-嘧啶通過硝化獲得2,4,6-三氨基-5-硝基嘧啶,在此基礎上利用氮氧化反應將硝基間位的氮原子轉化為N-氧化物結構ICM-102(見圖7)。ICM-102具有高實測密度(1.95g/cm3)、高熱分解溫度(284℃)、高爆速(9169m/s),機械感度較低,屬于鈍感炸藥的理想結構。

圖7 ICM-102的合成Fig.7 Synthesis of ICM-102
1.6 三嗪N-氧化物結構
2020年,王伯周等[36]以三聚氰胺為基礎,在強氧化條件下獲得了對應的雙氮氧化產物,并利用成鹽反應獲得了多種鹽類結構(MDOP、MDOMN、MDONA),其密度范圍在1.75~1.89g/cm3,爆速范圍8711~9085m/s,與RDX能量相當,但機械感度明顯低于RDX,見圖8。

圖8 1,3,5-三嗪體系的氧化研究Fig.8 Oxidation study of 1,3,5-triazine system
2015年,Shreeve等[37]發展的雙氧水-三氟乙酸酐體系的N-氧化方法學實現了對1,2,4,5-四嗪骨架的有效氧化,獲得了2,4-雙氮氧化1,2,4,5-四嗪的結構,形成了多種高密度、高性能含能材料,見圖9。所得的新型雙氧化四嗪化合物具有高密度、高熱穩定性、正生成焓和優異爆轟性能等特征,密度1.92g/cm3,爆速9316m/s,爆壓39.4GPa, 優于RDX,接近HMX水平。其中1,2,4,5-四嗪骨架兩端分別連接的特定推拉電子基團對氧化性及氧化程度均發揮了關鍵作用。
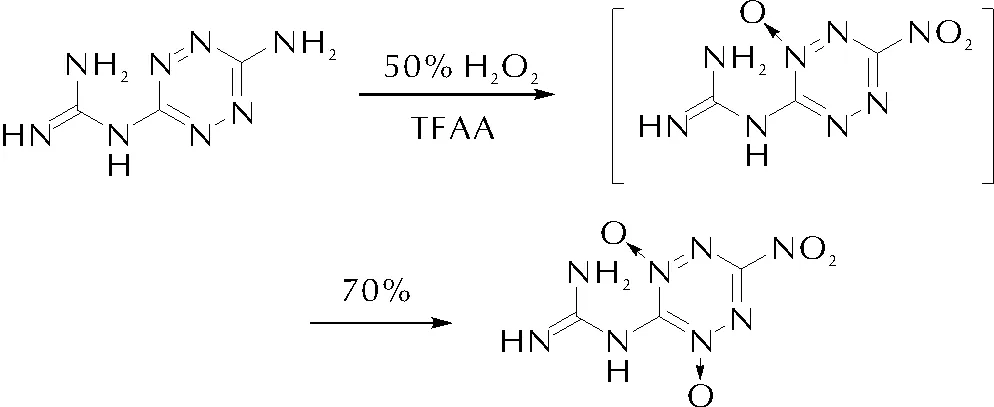
圖9 1,2,4,5-四嗪的硝化研究Fig.9 Study on nitroxidation of 1,2,4,5-tetrazine
此外,單環型芳環N-氧化物也可以直接以環化途徑進行構建,但通過這類方式所獲得的含能材料主要指氧化呋咱衍生化的結構,其主要原因在于氧化呋咱結構本身當前仍無法通過呋咱進行氧化獲取[38]。2016年,陳三平等[39]以氰基乙酸為原料,通過環化反應形成氧化呋咱骨架,將氰基結構通過含能衍生化轉化為偕二硝甲基結構,獲得了基于單環氧化呋咱的高能結構,見圖10。

圖10 4,5-雙(二硝基甲基)-呋喃酸酯結構的制備Fig.10 Preparation of 4,5-bis(dinitromethyl)-furoxanate structure
2 串聯型氮氧化富氮骨架的含能材料
串聯型氮氧化富氮骨架含能材料是指以碳碳單鍵或其他基團將兩片段的氮氧化富氮骨架結構進行鏈接。從制備方法角度,串聯型氮氧化富氮骨架的含能材料構建可以基于氮雜環結構的氧化,也可以是在環化過程中直接形成N-氧化物結構。
2012年,Klap?tke 等[40]合成了5,5′-雙四唑 N,N′-二氧化物及其二羥基銨鹽(TKX-50),成為串聯型氮氧化富氮骨架含能結構的代表性化合物, 見圖11。該化合物制備簡便,以二氯乙二肟進行疊氮化轉化并環化即可完成核心骨架的合成,其中N-氧化物片段在環化過程中直接形成。TKX-50具有優異的爆轟性能,密度為1.91g/cm3,爆速9698m/s,爆壓42.4GPa,應用前景廣闊。

圖11 TKX-50的制備Fig.11 Preparation of TKX-50
2014年,Klap?tke等[41]完成了雙硝基氧化呋咱結構的制備。該類化合物制備以連續的乙二肟結構進行環化獲得4,4′-二氨基-3,3′-二氧化呋咱的結構,見圖12。在此基礎上,進行氨基的氧化反應形成硝基結構,但最終硝基產物僅以痕量被檢測到,盡管如此,計算結果表明硝基體系的密度在100K高達2.007g/cm3,爆速為9525m/s。

圖12 二硝基雙氧化呋咱結構的制備Fig.12 Preparation of dinitro bis-furoxan Structure
2018~2021年,Shreeve及王伯周等[42-44]陸續發展了基于碳碳單鍵所串聯的三氧化呋咱骨架,分別與硝基及氟偕二硝基型致爆基團結合實現了串聯型的三氧化呋咱體系的合成,各化合物能量密度水平較之傳統含能化合物均有顯著優勢,見圖13。
2013年Klap?tke等[45]以縮合方式制備了聯1,2,4-三唑結構,并通過氧化反應分別制備獲得了氨基與雜環氮原子的氧化,最終將N-羥基片段轉化為N-氧陰離子含能鹽,獲得了MAD-X1,同時研究表明MAD-X1-CMDB推進劑的理論比沖和特征速度分別達到了2449.6N·s/kg和1540.7m/s,見圖 14。2014年,Shreeve等[46]對聯1,2,3-三唑結構進行了氧化,獲得了相似的串聯型氮氧化富氮骨架的含能結構,見圖15。

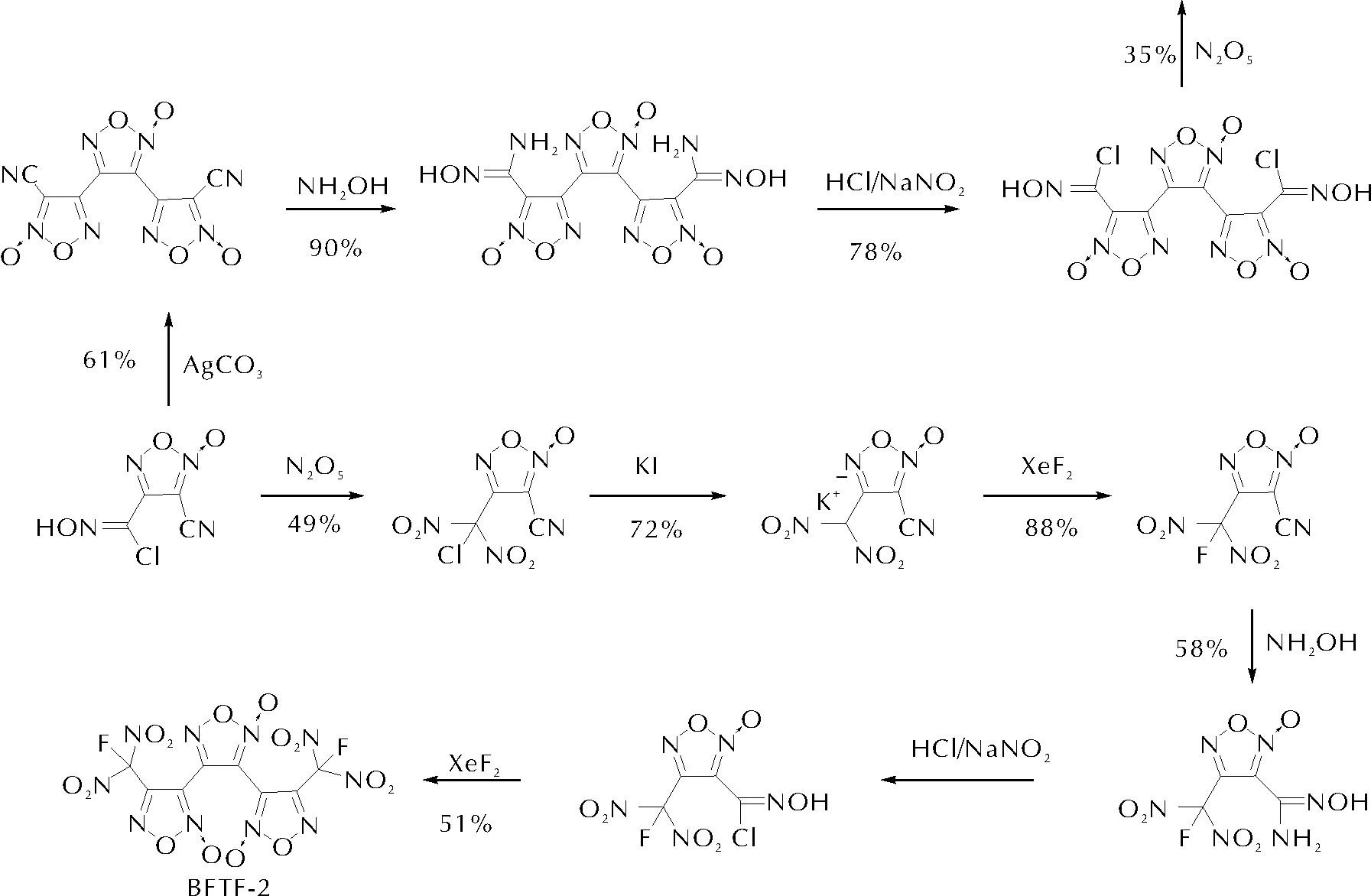
圖13 含能三氧化呋咱結構的制備Fig.13 Preparation of energetic tri-furoxan structure

圖14 MAD-X1制備Fig.14 Preparation of MAD-X1

圖15 雙1,2,3-三唑N-氧化物結構的制備Fig.15 Preparation of bi-1,2,3-triazole N-oxide structures
3 并聯型氮氧化富氮骨架的含能材料
較之鏈式結構,氮氧化富氮骨架并聯所形成的含能結構骨架更為致密,生成焓更高,且氧平衡更為理想,因而并聯型氮氧化富氮骨架的設計與合成研究對于推動新型高能量密度材料的研發意義重大,因而也成為氮氧化富氮骨架的含能材料研究的重點。但需要指出,由于骨架結構的特殊性,并聯型氮氧化富氮骨架合成難度通常顯著高于單環及串聯型氮氧化富氮骨架,此外,相比于串聯型結構,并聯型結構尤其是芳環結構骨架本身往往缺電子特點更加明顯,因此直接氧化難度較之串聯型結構難度也更大。2017年,Chavez等[47-48]利用氨基疊氮基四嗪環化所得的四唑并四嗪稠環進行氧化,成功實現了6-氨基-四唑并[1,5-b]-1,2,4,5-四嗪-3,7-二氧化物結構的構建,見圖16。但整體而言,并聯型富氮芳環N-氧化物更多傾向于采用直接環化的方法構建N-氧化物片段。

圖16 6-氨基-四唑并[1,5-b]-1,2,4,5-四嗪-3,7-二氧化物的制備Fig.16 Preparation of 6-amino-tetrazolo[1,5-b]-1,2,4,5-tetrazine-3,7-dioxide structure
事實上,并聯型富氮芳環N-氧化物往往存在高能量密度水平與低水解穩定性的矛盾。Rakitin等[49]將以并環策略將氧化呋咱環與噠嗪-1,2-二氧化物完成重組,成功實現了4,6-二硝基-呋咱[3,4-d]-1,5,6-三氧化物的合成,可能的轉化機制如圖17所示。該化合物晶體熔點在50~52℃,且無法在多種有機溶劑中穩定存在。該化合物密度達到了1.98g/cm3,理論爆速達到9.52km/s,與CL-20相當,但其較差的穩定性限制了其在配方研發中的應用。
通過直接環化合成的方式獲得高氮氧含量的并聯富氮稠環N-氧化物結構需要以富氮芳環N-氧化物的環合成方法學研究為基礎。直接環化合成方式獲得高氮氧含量富氮稠環N-氧化物的代表性工作是1,2,3,4-四嗪并[5,6-e]-1,2,3,4-四嗪-1,3,5,7-四氧化物(TTTO)的設計與合成研究。TTTO計算密度可達2.155g/cm3,生成焓836.8kJ/mol,爆速10.9km/s,爆壓60GPa,氧平衡為零,各項指標均高于現有含能化合物,被一度視為C-H-O-N類含能化合物的能量極限,凸顯了富氮稠環N-氧化物的研究價值。2016年,Anikin等[28, 50-52]首次通過獨特的H2SO4-HNO3-Ac2O“一鍋法”硝化環化方法突破了第二個高張力環境下的1,2,3,4-四嗪-1,3-二氧化物環系的構建,成功實現了TTTO合成。但新形成的雙1,2,3,4-四嗪-1,3-二氧化物稠環極易水解為更穩定的1,2,3,4-四嗪-1,3-二氧化物并三唑,表明雙1,2,3,4-四嗪-1,3-二氧化物稠環雖然能量密度水平優異,但近乎極限的高氮氧比例一定程度上影響了結構穩定性,見圖18。

圖17 4,6-二硝基-呋咱[3,4-d]-1,5,6-三氧化物的制備Fig.17 Preparation of 4,6-Dinitro-furazan[3,4-d]-1,5,6-trioxide

圖18 TTTO的制備Fig.18 Synthesis of TTTO
氧化呋咱并二氧化四嗪結構氧平衡為零,結構高度緊湊,是極其理想的含能結構。針對這一結構,多個團隊進行了長期的研究,但始終未能獲得合成突破。2021年,Khakimov等[54]發表了關于氧化呋咱并二氧化四嗪研究的原理性探索結果,指出由于氧化呋咱中N-氧化物片段對硝酰陽離子[55-57]以及其他陽離子的吸引作用,將使得環化過程被鎖死在中間體狀態無法繼續轉化(見圖19)。這一研究結果從理論角度揭示了N-氧化物體系硝化環化過程的深層次反應性問題,對基于二氧化四嗪體系并環類結構研究具有重要的指導意義。

圖19 氧化呋咱-1,2,3,4-四嗪1,3-二氧化物的可能轉化途徑Fig.19 Possible transformation pathways towards furoxano-1,2,3,4-tetrazine 1,3-dioxides
王伯周等[58-59]利用3-氨基-4-(叔丁基-NNO-氧化偶氮基)氧化呋咱結構,開展了氧化三唑并二氧化四嗪結構的合成(見圖20)。為實現合成目標,需要首先將3-氨基-4-(叔丁基-NNO-氧化偶氮基)氧化呋咱結構轉化為3-氨基-4-(叔丁基-NNO-氧化偶氮基)氧化三唑的結構,這一反應通過加入叔丁胺順利實現了相應的轉化。此結構同時包含氧化偶氮片段和具有強吸電子效應的氧化三唑體系,利用這一體系在H2SO4-HNO3-Ac2O條件下進行硝化環化,順利實現了二氧化四嗪片段的合成,對氧化三唑中所包含的叔丁基完成了同步脫除。需要指出,這一結構同時包含中性的芳香性N-氧化物(N-oxides)和羥胺型N-氧化物結構。

圖20 氧化三唑-1,2,3,4-四嗪1,3-二氧化物的合成Fig.20 Synthesis of 1,2,3-triazole-1-oxide-1,2,3,4-tetrazine 1,3-dioxides
4 結束語
氮氧化富氮骨架是重要的含能材料骨架單元,通過不同結構的基于氮氧化富氮骨架含能材料合成方法及其能量密度水平的對比,可以得出以下結論:
(1)從合成方法角度,單環型結構的合成較為簡單,N-氧化物主要以環系中氮原子的氧化方法為基礎;而串聯型結構較之單環型結構更加復雜,可以通過氧化或者環化的過程形成N-氧化物[60];與前兩者相比,并聯型結構的合成方法最為復雜,不僅直接氧化十分困難,同時環化形成N-氧化物的難度也顯著高于其他體系;
(2)從能量密度水平角度,在N-氧化物片段引入后,由于正氧平衡水平和生成焓水平的提升,整體的能量密度水平得以顯著提升,且容易形成多種含能離子鹽結構,進一步豐富和調節了其能量特性。與此同時,鹽類結構多存在于單環型及串聯型N-氧化物結構當中,并聯型結構由于其結構特殊性,一般較少形成相關鹽類結構;
(3)在單環型結構與串聯型結構中,N-氧化物片段的存在并未顯著降低所得化合物的環系穩定性,同時由于氫鍵等效應的加強,其撞擊感度及摩擦感度等往往會有一定的提升[61];而對于并聯型結構,N-氧化物片段的大量引入,極大提升了整體骨架的致密程度,但骨架穩定性,尤其水解穩定性有所降低,這與稠環結構中N-氧化物提供了更多的活性反應位點有一定關聯。

