白細胞介素-2和信號轉導和轉錄激活因子5在宮頸病變患者血清、宮頸組織和細胞中的表達及意義
杜 靖,李 晨,王曉靜,李婉悅,樊 凱,沙 靜
(1.新疆醫科大學基礎醫學院生理學教研室/新疆地方病分子生物學重點實驗室,新疆 烏魯木齊 830011;2.新疆醫科大學基礎醫學院,新疆 烏魯木齊 830011;3.新疆生產建設兵團醫院,新疆 烏魯木齊 830000)
宮頸癌是全球女性癌癥相關死亡的第四大原因[1]。近年來,中國城鄉婦女宮頸癌病死率呈上升趨勢[2],其中宮頸鱗狀細胞癌(cervical squamous cell carcinoma,CSCC)約占臨床宮頸癌類型的80%[3],與人乳頭瘤病毒(human papilloma virus,HPV)感染密切相關[4]。有研究報道,白細胞介素-2(interleukin-2,IL-2)與白細胞介素-2受體(interleukin-2 receptor,IL-2R)水平與宮頸病變分化程度顯著相關[5]。信號轉導和轉錄激活因子5(signal transducer and activator of transcription 5,STAT5)激活可增強宮頸癌細胞的遷移和侵襲[6]。IL-2和酪氨酸激酶(Janus kinase,JAK)/STAT通路在多種HPV相關癌癥中的具有重要作用,但關于其在HPV相關癌癥輔助診斷及預后評估中的作用的研究報道較少。基于此,本研究比較CSCC、慢性宮頸炎和正常女性血清、宮頸組織蠟塊及宮頸脫落細胞中IL-2、IL-2R和STAT5表達變化,探討IL-2、STAT5在宮頸病變進展中的預測價值,以期為宮頸病變的診斷和預防提供一種新的檢測指標。
1 資料與方法
1.1 一般資料選擇2020年6月至2021年6月新疆生產建設兵團醫院門診或住院的25例CSCC患者(CSCC組)、40例慢性宮頸炎患者(慢性宮頸炎組)為研究對象。病例納入標準:(1)有性生活史;(2)CSCC患者在行婦科檢查發現異常或疑似癌癥,如宮頸柱狀上皮外移、宮頸息肉、贅生物、菜花樣及結節樣腫物,宮頸管增粗或桶狀宮頸;宮頸癌篩查試驗陽性,宮頸細胞學異常,用子宮頸細胞學描述性診斷報告≥非典型鱗狀細胞,并經宮頸液基細胞學、組織病理學診斷確診;(3)慢性宮頸炎患者行婦科檢查時肉眼觀察宮頸有紅、糜爛樣改變,宮頸肥大、白帶增多呈黏液態或膿態,經宮頸液基細胞學、組織病理學診斷確診;(4)患者和(或)家屬知情同意并簽署知情同意書。病例排除標準:(1)具有免疫缺陷以及其他免疫疾病者;(2)合并高血壓、糖尿病或其他惡性腫瘤;(3)近期內曾接受過放化療、干擾素、免疫抑制治療的患者;(4)哺乳期受試者。另外,選擇體檢健康的有性生活史的50例女性為健康對照組。CSCC組患者年齡35~61(45.48±9.48)歲;慢性宮頸炎組患者年齡28~59(42.30±6.43)歲;健康對照組受試者年齡25~69(46.88±9.13)歲;3組受試者年齡比較差異無統計學意義(P>0.05),具有可比性。另收集新疆醫科大學第一附屬醫院和新疆生產建設兵團醫院病理科石蠟包埋的宮頸炎組織35例和CSCC組織87例(高分化30例,中分化42例,低分化15例),所有宮頸組織均經宮頸液基細胞學、組織病理學診斷確診為宮頸炎或者CSCC。
1.2 主要試劑和儀器兔抗人多克隆抗體STAT5、磷酸化STAT5(phosphorylated STAT5,p-STAT5)、IL-2購自武漢博士德生物工程有限公司,IL-2R一抗、二氨基聯苯胺(diaminobenzidine,DAB)顯色試劑盒購自北京中杉金橋公司生物技術有限公司,辣根過氧化物酶標記的山羊抗兔IgG抗體購自武漢伊萊瑞特生物科技股份有限公司,QIAamp RNA Blood Mini Kit試劑盒購自德國Qiagen公司,酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA)IL-2檢測試劑盒購自上海研謹生物科技有限公司;Thin Prep細胞保存液購自北京力普生物技術研究院,RNA引物由鉑尚生物技術(上海)有限公司合成,互補脫氧核糖核酸(complementary DNA,cDNA)檢測試劑盒購自日本TaKaRa公司,HPV分型檢測試劑盒購自豪洛捷醫療科技(北京)有限公司;Klab MRX A2000酶標儀購自上海申蒙檢測技術有限公司。
1.3 方法
1.3.1 宮頸脫落細胞采集及HPV檢測3組受試者樣本采集前24 h內禁止性生活、陰道檢查及陰道內用藥,于非月經期,在窺陰器下暴露宮頸口,無菌棉球擦拭干凈,將取樣刷置于宮頸口,按順時針方向旋轉5圈,取出取樣刷放入保存液中備用;另外,應用HPV取樣器插入宮頸內口位置,旋轉3圈,停留約10 s取出,置于Thin Prep細胞保存液中保存。
1.3.2 血清采集抽取3組受試者晨起空腹靜脈血5 mL,置于乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)管中,4 ℃ 3 000 r·min-1離心5 min,分離血清,置于-20 ℃冰箱儲存。
1.3.3 熒光定量聚合酶鏈反應(polymerase chain reaction,PCR)檢測宮頸脫落細胞中HPV-DNA將Thin Prep細胞保存液于4 ℃ 12 000 r·min-1離心5 min,取沉淀細胞液,加入細胞裂解液,置冰袋上反復吹打;室溫靜置10 min,將裂解液收集到1.5 mL EP管中。加入200 μL氯仿,手動上下顛倒搖晃15 s,室溫靜置3 min,4 ℃ 10 000 r·min-1離心15 min,將上層水相轉移到新的EP管中,加入 500 μL 異丙醇,室溫靜置 10 min,4 ℃、12 000 r·min-1離心10 min,棄上清;加1 mL 體積分數75%無酶乙醇,上下顛倒洗滌,4 ℃、7 500 r·min-1離心 5 min,棄上清,靜置干燥,揮發殘留乙醇,加30 μL DEPC水充分溶解RNA,置于-80 ℃冰箱保存,避免反復凍融。采用熒光定量PCR檢測HPV-DNA,反應體系及擴增條件參照試劑盒說明書;應用Klab MRX A2000酶標儀顯色,根據說明書觀察薄膜上顯像,紫藍色圓點為陽性。
1.3.4 ELISA法檢測宮頸脫落細胞和血清中IL-2水平取宮頸脫落細胞懸液,4 ℃、10 000 r·min-1離心1 min,取上清液待測;另取血清待測。按IL-2 ELISA檢測試劑盒說明書配置標準品,將待測樣品和標準品滴加至16孔酶標板中,覆膜封板,37 ℃孵育90 min,甩干;然后,每孔加生物素化抗體工作液100 μL,酶標板覆膜封板,37 ℃孵育60 min,棄去液體,洗板3次;每孔加酶結合物工作液100 μL,37 ℃孵育30 min,洗板5次,每孔加顯色劑90 μL,37 ℃避光孵育15 min,加終止液50 μL終止反應,應用Klab MRX A2000酶標儀在450 nm波長處測量各孔的光密度值,繪制標準曲線,計算IL-2表達量。
1.3.5 實時熒光定量PCR(real-time quantitative PCR,qRT-PCR)檢測3組受試者宮頸脫落細胞中IL-2、IL-2R、STAT5a和STAT5b mRNA表達取宮頸脫落細胞懸液5 mL,應用柱吸附方法抽提RNA,利用Naodrop 2000 核酸定量儀測定RNA濃度,應用TaKaRa反轉錄試劑盒將RNA反轉錄為cDNA。然后,應用qRT-PCR法檢測IL-2、IL-2R、STAT5a和STAT5b mRNA。反應體系(20 μL):SYBR Premix Ex Taq II(2×)10.0 μL,PCR Forward Primer(10 μmol·L-1)0.8 μL,PCR Reverse Primer(10 μmol·L-1)0.8 μL,ROX Reference Dye II(50×)0.4 μL,DNA模板1.0 μL,用RNase Free ddH2O補足20 μL。反應條件:95 ℃預變性30 s; 95 ℃變性5 s,60 ℃退火30 s,共循環40次;反應融解曲線:95 ℃ 5 s,60 ℃ 30 s,95 ℃ 15 s。每個樣本做2個復孔,以甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)為內參。從美國國家生物技術信息中心數據庫下載IL-2、IL-2R、STAT5a、STAT5b和GAPDH mRNA序列,設計qRT-PCR引物,具體引物序列:IL-2上游引物序列為5′-CTCACAGTAACCTCAACTCCTGCCACAATG-3′,下游引物序列為5′-GTGAGCATCCTGGTGAGTTTGGGATTCTTG-3′,長度為208 bp;STAT5a上游引物序列為5′-TGTTCAGGATCTCACCACTGCACTCGTTG-3′,下游引物序列為5′-TCAACGCCACCATCACGGACATTATCTCAG-3′,長度為248 bp;STAT5b上游引物序列為5′-ACGTGAAGCCACAGATCAAGCAAGTGGTC-3′,下游引物序列為5′-CTACGTCCATTGTGTCCTCCAGATCGAAG-3′,長度為200 bp;IL-2R上游引物序列為5′-GACTGCTCACGTTCATCATGGTGCCTG-3′,下游引物序列為5′-GTTGTCCCAGGACGAGTGGCTAGAG-3′,長度為209 bp;GAPDH上游引物序列為5′-GGCACAGTCAAGGCTGAGAATG-3′,下游引物序列為5′-ATGGTGGTGAAGACGCCAGTA-3′,長度為150 bp。利用ABI Q2 Real-Time PCR儀及軟件進行分析,采用2-△△Ct法計算目的基因相對表達量,△Ct=目標基因Ct-內參Ct值(Ct值代表每個反應管內的熒光信號達到設定閾值時所需循環數)。
1.3.6 免疫組織化學染色法檢測宮頸炎和CSCC組織中STAT5、p-STAT5、IL-2和IL-2R蛋白表達
將宮頸炎和CSCC石蠟組織切片(片厚4.0 μm),常規脫蠟水化,然后在0.01 mmol·L-1檸檬酸抗原修復液中應用微波修復法預處理,應用體積分數 0.3% H2O2孵育10 min阻斷內源性過氧化物酶活性;然后,滴加試劑體積分數10%山羊血清于組織切片上,室溫孵育10 min,加入STAT5一抗(滴度1100)、p-STAT5一抗(滴度1200)、IL-2一抗(滴度1200)和IL-2R一抗(滴度125),陰性對照為等量PBS替代一抗,4 ℃孵育過夜,磷酸鹽緩沖液(phosphate buffered saline,PBS)沖洗5 min,共3次。滴加試劑B室溫孵育10 min,PBS沖洗5 min,共3次;滴加試劑C室溫孵育10 min,PBS沖洗5 min,共3次。滴加新鮮配制的DAB顯色液,室溫顯色2~5 min,蘇木精復染,脫水,二甲苯透明、封片,光學顯微鏡下觀察。結果判定:以宮頸上皮細胞胞質或細胞核染成棕黃色為陽性判定標準。按陽性細胞在組織中所占面積分為5個等級:<5%為陰性(-),5%~25%為弱陽性(+),>25%~50%為陽性(++),>50%~75%為中等度陽性(+++),>75%為強陽性(++++),將+、++、+++、++++計為陽性表達。

2 結果
2.1 3組受試者HPV感染情況比較健康對照組受試者HPV16/18陽性7例(14.0%),HPV16/18陰性43例(86.0%);慢性宮頸炎組患者HPV16/18陽性13例(32.5%),HPV16/18陰性27例(67.5%);CSCC組患者HPV16/18陽性17例(68.0%),HPV16/18陰性8例(32.0%)。3組受試者HPV16/18陽性率比較差異有統計學意義(F=12.640,P> 0.05);慢性宮頸炎組和CSCC組患者HPV16/18陽性率高于健康對照組,差異有統計學意義(χ2=6.762、13.868,P<0.05);CSCC組患者HPV16/18陽性率顯著高于慢性宮頸炎組,差異有統計學意義(χ2=7.870,P<0.05)。
2.2 3組受試者血清和宮頸脫落細胞中IL-2水平比較結果見表1。慢性宮頸炎組和CSCC組HPV16/18陽性患者血清和宮頸脫落細胞中IL-2水平低于健康對照組,CSCC組HPV16/18陽性患者血清和宮頸脫落細胞中IL-2水平低于慢性宮頸炎組,差異有統計學意義(P<0.05);慢性宮頸炎組和CSCC組HPV16/18陰性患者血清和宮頸脫落細胞中IL-2水平低于健康對照組,CSCC組HPV16/18陰性患者血清和宮頸脫落細胞中IL-2水平低于慢性宮頸炎組,差異有統計學意義(P<0.05);3組HPV16/18陽性受試者血清和宮頸脫落細胞中IL-2水平低于HPV16/18陰性受試者,差異有統計學意義(P<0.05)。HPV16/18陽性受試者宮頸脫落細胞與血清中IL-2水平呈正相關(r=0.665,P<0.05)。
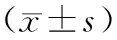
表1 3組受試者血清和宮頸脫落細胞中IL-2水平比較
2.3 3組受試者宮頸脫落細胞中IL-2、IL-2R、STAT5a和STAT5b mRNA相對表達量比較結果見表2。慢性宮頸炎組和CSCC組患者宮頸脫落細胞中IL-2、IL-2R、STAT5a和STAT5b mRNA相對表達量低于健康對照組,CSCC組患者宮頸脫落細胞中IL-2、IL-2R、STAT5a和STAT5b mRNA相對表達量低于慢性宮頸炎組,差異有統計學意義(P<0.05)。
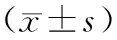
表2 3組受試者宮頸脫落細胞中IL-2、IL-2R、STAT5a和STAT5b mRNA相對表達量比較
2.4 慢性宮頸炎和CSCC宮頸組織中IL-2、IL-2R、STAT5和p-STAT5陽性表達情況比較結果見圖1和表3。IL-2和IL-2R蛋白主要在細胞質內表達,偶見細胞核著色;STAT5和p-STAT5蛋白主要在細胞核內表達。CSCC宮頸組織中IL-2、IL-2R陽性表達率顯著低于慢性宮頸炎組織,STAT5和p-STAT5陽性表達率顯著高于慢性宮頸炎組織,差異有統計學意義(P<0.05)。高分化型CSCC宮頸組織中IL-2、IL-2R陽性表達率顯著高于中分化型和低分化型,STAT5和p-STAT5陽性表達率顯著低于中分化型和低分化型,差異有統計學意義(P<0.05);中分化型CSCC宮頸組織中IL-2、IL-2R陽性表達率顯著高于低分化型,STAT5和p-STAT5陽性表達率低于低分化型,差異有統計學意義(P<0.05)。

表3 慢性宮頸炎和CSCC宮頸組織中IL-2、IL-2R、STAT5和p-STAT5蛋白陽性表達率比較
3 討論
CSCC的發生發展是多因素、長期慢性的過程,從HPV感染到宮頸癌可持續15~30 a[7];在高危型HPV持續感染、低級別宮頸鱗狀上皮內病變到CSCC發展過程中,機體的免疫功能與CSCC的發生、發展密切相關[8]。目前,宮頸癌初篩主要是宮頸脫落細胞HPV-DNA檢測聯合液基薄層細胞法,而宮頸癌診斷的金標準為宮頸組織病理學診斷,雖然已知的生物學檢測指標有鱗狀上皮細胞癌抗原HPVE6/E7、多腫瘤抑制基因1與Ki67蛋白等[9-11],但受檢測方法及腫瘤特異性等因素制約未在臨床上廣泛應用,因此,仍需要探索特異、便捷、可靠的生物學標志物來進一步改善宮頸癌的篩查、診斷和預后評估[12]。
HPV 是一種球形、雙鏈閉環的小 DNA 病毒,屬于乳多空病毒科的乳頭瘤空泡病毒 A 屬。目前已發現的 HPV共有 130個亞型,在眾多亞型中分為高危型 HPV 和低危型 HPV。目前常見的高危型 HPV 主要分為皮膚高危型和黏膜高危型,其中黏膜高危型 HPV 病毒可導致外陰癌、膀胱癌等;而低危型 HPV 主要包括皮膚低危型和黏膜低危型兩大類,皮膚低危型可導致常疣、扁平疣等,黏膜低危型可導致生殖器、口咽部及食管黏膜感染[13]。研究表明,HPV 感染與宮頸病變關系密切,且持續的HPV感染是導致宮頸癌的重要危險因素之一[14]。PAPPA等[15]研究報道,97.7%的宮頸癌患者為HPV陽性,HPV16、18亞型最常見。本研究結果顯示,慢性宮頸炎組和CSCC組患者HPV16/18陽性率高于健康對照組;慢性宮頸炎組患者HPV16/18陽性率低于CSCC,這與PAPPA等[15]研究結果一致,進一步證實HPV16/18感染與宮頸病變進程密切相關。
IL-2由T淋巴細胞分泌,IL-2R來自活化的淋巴細胞膜上IL-2R的A鏈成分。研究報道,Th1細胞可分泌IL-2等細胞因子,而IL-2可誘導單核細胞、巨噬細胞、中性粒細胞等的聚集及浸潤,加重細胞損傷,導致正常細胞發生異常增殖及癌變[16];IL-2不僅調控全身機體免疫,還可滲出于生殖道參與陰道微環境的局部免疫調節。研究表明,HPV相關的宮頸病變患者比健康女性發生顯著的免疫因子改變,如IL-2濃度隨疾病進展而降低,且隨著病變進展,Th1細胞向Th2轉化,Th1/Th2比值降低,表現為免疫抑制[17];本研究結果顯示,慢性宮頸炎組和CSCC組HPV16/18陽性、陰性患者血清和宮頸脫落細胞中IL-2水平均分別低于健康對照組HPV16/18陽性、陰性受試者,CSCC組HPV16/18陽性、陰性患者血清和宮頸脫落細胞中IL-2水平低于慢性宮頸炎組HPV16/18陽性、陰性患者;3組HPV16/18陽性受試者血清和宮頸脫落細胞中IL-2水平低于HPV16/18陰性受試者,HPV16/18陽性受試者中宮頸脫落細胞與血清中IL-2水平呈正相關;且慢性宮頸炎組和CSCC組患者宮頸脫落細胞IL-2、IL-2R mRNA相對表達量低于健康對照組,CSCC組患者宮頸脫落細胞IL-2、IL-2R mRNA相對表達量低于慢性宮頸炎組;另外,免疫組織化學檢測結果顯示,CSCC宮頸組織中IL-2、IL-2R陽性表達率顯著低于慢性宮頸炎,高分化型CSCC宮頸組織中IL-2、IL-2R陽性表達率顯著高于中分化型和低分化型,中分化型CSCC宮頸組織中IL-2、IL-2R陽性表達率顯著高于低分化型患者。這一結果說明,血清IL-2水平隨HPV16/18陽性率增高而降低,且血清IL-2水平和宮頸脫落細胞中IL-2、IL-2R水平隨宮頸病變分化嚴重程度而下降。ZHENG等[18]研究報道,在HPV病變中,IL-2在CSCC中表達最低,提示腫瘤早期免疫反應較強、炎癥反應較弱。另有研究報道,IL-2在HPV引發的宮頸病變組織中的表達隨病變程度加重逐漸下降,而IL-2表達降低導致的機體免疫功能抑制使宮頸癌細胞出現免疫逃逸,從而促進宮頸癌的發生、發展[19-21]。因此,宮頸脫落細胞和血清中IL-2水平可作為預測宮頸病變進展新的標志物。
STAT5基因通過激活共濟失調毛細血管擴張突變基因損傷反應來調節基因組擴增,其在HPV陽性的CSCC細胞中被激活,參與促進細胞周期進程、細胞轉化和抑制細胞凋亡,在CSCC發生、發展過程中發揮重要作用[22-24]。HPV通過先天性和適應性免疫反應逃避監視建立持續感染,其中JAK/STAT途徑是調節先天性免疫反應的主要途徑[25]。IL-2能通過JAK3磷酸化激活和JAK1磷酸化缺失進一步激活STAT家族蛋白STAT5a、STAT5b,導致STAT蛋白易位至細胞核,使其下游基因表達增加,從而直接或間接調控細胞增殖、細胞周期和細胞凋亡[26],其中STAT5a參與調控細胞增殖而STATb可引起機體免疫反應改變[27-28]。有研究發現,p-STAT5在HPV導致的宮頸癌細胞中增加,其不僅促進宮頸癌發生同時也維持癌細胞的過度增殖、轉移、侵襲等惡性表型[29];反之抑制JAK或降低STAT5磷酸化可抑制宮頸癌細胞生長[30]。本研究結果顯示,慢性宮頸炎組和CSCC組患者宮頸脫落細胞中STAT5a和STAT5b mRNA相對表達量低于健康對照組,CSCC組患者宮頸脫落細胞中STAT5a和STAT5b mRNA相對表達量低于慢性宮頸炎組;CSCC宮頸組織中STAT5和p-STAT5陽性表達率顯著高于慢性宮頸炎,高分化型CSCC宮頸組織STAT5和p-STAT5陽性表達率低于中分化型和低分化型,中分化型CSCC宮頸組織中STAT5和p-STAT5陽性表達率低于低分化型;本研究結果與上述研究報道結果[29-30]相符,進一步證實STAT5a和STAT5b在宮頸組織中的表達隨病變分化嚴重程度增高而升高,IL-2可能通過JAK/STAT通路激活STAT家族蛋白STAT5a、STAT5b參與宮頸癌的發生、發展。
綜上所述,HPV16/18陽性者血清和宮頸脫落細胞中IL-2水平顯著低于HPV16/18陰性者,且血清IL-2水平及宮頸病變組織和細胞中IL-2和IL-2R表達水平隨宮頸病變分化嚴重程度加重而下降,STAT5a和STAT5b表達隨宮頸病變程度加重而升高;IL-2可能通過JAK/STAT通路激活STAT家族蛋白STAT5a、STAT5b參與宮頸癌的發生、發展。因此,通過常規檢測宮頸脫落細胞和血清中IL-2水平可預測宮頸病變進展。

