循環炎癥標志物在宮頸腫瘤中的表達水平分析*
鄭佩芹,周海梅,王曉剛
[山東醫學高等專科學校附屬醫院(臨沂市老年病醫院)1.婦產科;2.內分泌科,山東 臨沂276004]
目前,宮頸癌仍然是世界范圍內的主要健康問題。美國的一項調查表面,宮頸癌仍然是20 至39 歲女性癌癥死亡的第二大原因,在美國,該年齡組每周有9 人死亡[1-2]。根據世界衛生組織(WHO)提供的數據,全世界每年約有50 萬女性患上宮頸癌,占女性所有惡性疾病12%。每兩分鐘就有一名女性死于宮頸癌,對于這些女性中的230 000 人來說,這種疾病多是晚期。根據2015 年的數據,在歐洲,有12~30/100 000 名女性受到宮頸癌的影響。欠發達國家的頻率較高,而由于早期的篩查,大多數高度發達國家宮頸癌發生率正在下降。宮頸癌的發病率在女性惡性疾病中排在第二位,僅次于乳腺癌。99.7%的宮頸癌患者被檢出人乳頭瘤病毒(HPV)感染。持續性HPV 感染可能會顯著增加宮頸上皮內瘤變(CIN)進展為宮頸癌的風險[3]。至此,宮頸癌成為世界上唯一病因明確的婦科惡性腫瘤。
高危人乳頭瘤病毒(HR-HPV)被稱為宮頸癌的主要危險因素,可能誘發癌前病變。HPV 本身也可以調節宿主免疫反應,從而影響病變從原位癌發展到宮頸癌,宮頸癌患者中觀察到HPV 相關病變的免疫反應的下調。盡管如此,單獨的HR-HPV 感染不足以誘導宮頸癌的發展。事實上,絕大多數感染HR-HPV 的女性從未發展為宮頸癌,因為足夠的免疫反應可以控制感染并防止任何癌前病變的誘導形成[4]。
越來越多的證據表明宿主炎癥反應在癌癥的發展和進展中起著重要作用。癌癥不僅與病變部位的炎癥有關,還與整體全身免疫反應有關[5],減少炎癥可有效治療和預防多種癌癥類型的進展。為了更好地了解炎癥在宮頸癌中的作用,本研究評估了宮頸癌前病變及宮頸癌患者的炎癥標志物的血清水平,并與健康對照者進行比較,現報道如下。
1 資料與方法
1.1 一般資料
選取2020 年9 月至2021 年9 月山東醫學高等專科學校附屬醫院婦產科收治的162 名患者作為研究對象。其中60 名非宮頸疾病患者作為對照組,年齡40~72歲,平均(54.33±4.23)歲;50 名組織學診斷為宮頸癌前病變患者為癌前病變組,年齡43~71歲,平均(55.22±3.34)歲;52 名組織學診斷為宮頸癌患者為宮頸癌組,年齡45~70歲,平均(59.91±1.13)歲。兩組一般資料比較,差異無統計學意義(P>0.05),具有可比性。
納入標準:①術后病理學檢查確診為宮頸癌前病變或宮頸癌[6];②年齡>18 歲;③經檢查無嚴重內科或外科疾病。④獲得醫院倫理委員會的批準,所有受試者均簽署書面同意書。排除標準:①患有自身免疫性疾病、活動性或慢性感染、心血管疾病、結締組織疾病;②有惡性腫瘤病史;③懷孕和/或<18 歲的女性;④之前接受過免疫抑制治療、放療和/或化療的任何受試者。
1.2 HPV 檢測和基因分型
宮頸上皮組織樣本(來自宮頸癌前病變、宮頸癌患者的活檢,對照組患者的液基宮頸樣本)用于基因組DNA 分離和HPV 狀態確定。使用基于聚合酶鏈反應(PCR)的多重HPV 基因分型試劑盒檢測、區分HPV 24 種基因型。
1.3 血清細胞因子的定量檢測
在手術和癌癥治療之前,每個研究患者抽取靜脈血樣本。每個血樣分離血清并儲存在-80°C直至用于分析。使用商業ELISA 試劑盒(上海碧云天生物科技有限公司)測定干擾素-β(IFN-β)、干擾素-γ(IFN-γ)、白介素-1β(IL-1β)、白介素-2(IL-2)、白介素-6(IL-6)含量。
1.4 蛋白電泳檢測髓樣細胞觸發受體-1(TREM-1)、腫瘤壞死因-α(TNF-α)水平
宮頸上皮組織樣本剪切成細小的碎片,取40 mg 組織,加入500 μL 裂解液,15 000 g 離心5 min,取上清液以備后續實驗,計算樣品蛋白濃度,配膠、電泳、轉膜、孵育一抗二抗、化學發光及凝膠圖像分析。
1.5 觀察指標
收集患者一般資料包括年齡進行組間分析。使用基于PCR 的多重HPV 基因分型試劑盒(寧波海爾施基因科技有限公司,批號:2021010201178)檢測、區分HPV 24 種基因型,統計HPV 陽性率并進行組間比較。使用商業ELISA 試劑盒測定IFN-β、IFN-γ、IL-1β、IL-2、IL-6 含量并分析差異。使用凝膠成像分析系統測定TREM-1、TNF-α蛋白表達水平并進行分析。
1.6 統計學方法
采用SPSS 22.0 統計學軟件進行數據分析。計量資料采用均數±標準差()來表示,采用單因素方差分析(One way ANOVA),方差齊時用LSD-t檢驗,方差不齊時用Dunnett'st檢驗進行兩兩比較。計數資料用百分率(%)表示,比較用χ2檢驗。P<0.05 為有差異有統計學意義。
2 結果
2.1 各組HPV 感染率水平比較
與對照組比較,宮頸癌前病變組及宮頸癌組HPV 感染率水平明顯升高;宮頸癌組HPV 感染率明顯高于宮頸癌前病變組,差異均有統計學意義(F/χ2=60.249,P=0.000),見表1。
表1 各組HPV 感染率水平比較()

表1 各組HPV 感染率水平比較()
2.2 各組炎癥因子數據比較
與對照組比較,宮頸癌前病變組及宮頸癌組IFN-β、IL-1β 水平明顯升高,差異有統計學意義(P<0.05),宮頸癌前病變組及宮頸癌組組間比較,差異無統計學意義(P>0.05),見表2。
表2 各組炎癥因子數據比較(,pg/mL)
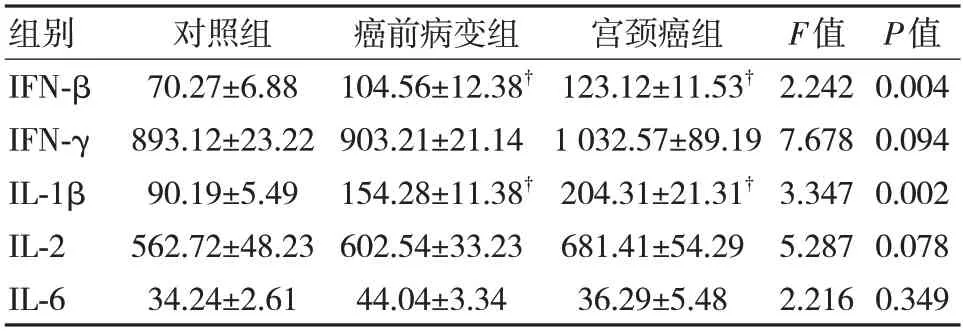
表2 各組炎癥因子數據比較(,pg/mL)
注:?與對照組比較,P<0.05。
2.3 各組TREM-1、TNF-α 蛋白表達水平比較
對照組比較,宮頸癌前病變組及宮頸癌組TREM-1、TNF-α 蛋白明顯升高,差異有統計學意義(P<0.05),宮頸癌前病變組及宮頸癌組比較,差異無統計學意義(P>0.05),見圖1、表3。
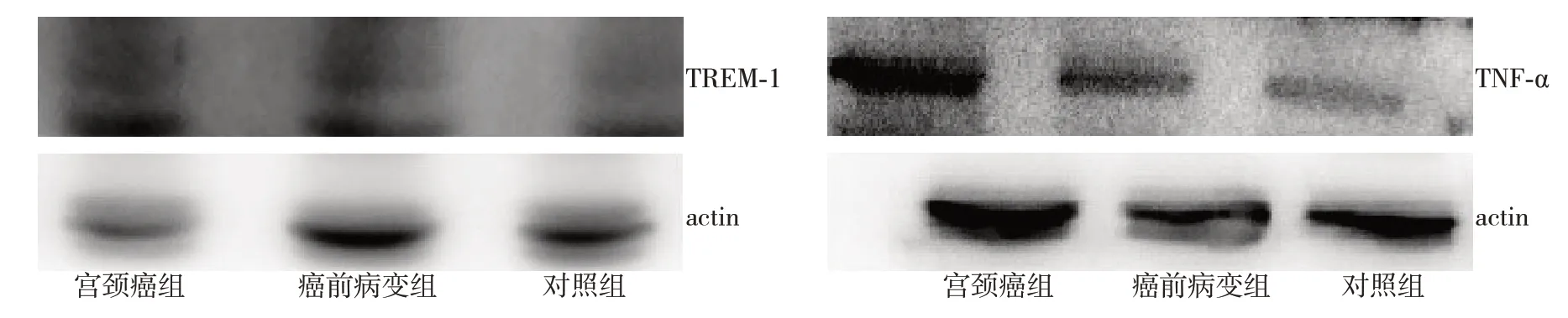
圖1 TREM-1、TNF-α 蛋白表達
表3 各組TREM-1、TNF-α 蛋白比較()

表3 各組TREM-1、TNF-α 蛋白比較()
注:?與對照組比較,P<0.05。
3 討論
本研究揭示了宮頸癌患者存在全身炎癥,即與對照相比,宮頸癌患者HPV 感染率、IFN-β、IL-1β、TREM-1 和TNF-α 水平顯著更高。
HPV 疫苗接種可預防致癌感染和癌前病變。然而,中國的疫苗接種和篩查覆蓋率仍然很低。有證據表明,從宮頸癌前病變發展為宮頸癌需要數年甚至數十年的時間。因此,對宮頸癌前病變做出良好和準確的診斷并防止其惡化是一項持續的醫學研究。已發現HPV 感染對宮頸癌的發病率有顯著影響,是最常見的性傳播感染,而其他途徑包括母嬰傳播和胃腸道感染。
HPV 的基因組包含8 000 個堿基對的雙鏈環狀DNA。迄今為止,已鑒定出100 多種HPV。它們分為兩類:高危型HPV 和低危型HPV。此外,80%的女性在一生中都感染了HPV,然而,大約90%的感染會消失[7]。HPV 基因型的流行與不同的種族、地區和習俗有關[8]。雖然大多數HPV 感染已被證明會在幾個月或幾年內清除,仍有5%~10%的持續感染女性CIN 及宮頸癌癥發病率增加。幾項研究表明,單一HPV 感染占主導地位,而多種HPV 感染在大量人群中普遍存在[9-10]。研究人員對多發HPV 感染與宮頸病變的關系有不同看法。一項研究表明,多重HPV 感染是一種普遍現象,并不會增加CIN 進展的風險。此外,由于競爭,它們可能會引起更有效的免疫反應,從而降低高級別CIN 的發生率[11]。其他研究表明,多種HPV 感染對宮頸癌的發展具有協同作用。與單一HPV 感染相比,CIN1 有多重HPV 感染的患者發展為CIN2 的風險更高[12-13]。
細胞因子已被證明與大多數腫瘤組織有關,并且可能在細胞轉化、癌細胞增殖、存活、侵襲和轉移中發揮作用。一些細胞因子(例如LCN2、IL-1、IL-2、IL-4、IL-6、TNF-α 等)的表達失調與宮頸癌前病變的發生率之間存在顯著關系[14-16]。這些事件之間的潛在聯系是基于這樣一個事實,即免疫刺激性T 輔助細胞因子如TNF-α、IFN-γ、IL-2 和IL-12 可以誘導細胞介導的免疫和腫瘤抑制,它們還可以在宿主中具有促炎作用。相反,抑制性細胞因子(例如IL-4、IL-5、IL-6、IL-8、IL-10)降低細胞介導的免疫并同時誘導體液免疫。因此,上述事實表明,癌癥過程中細胞因子相關的免疫反應是復雜和異質的。另外一種情況,有研究報告[17]了在偶發和持續性HPV 感染的宿主中全身細胞因子水平顯著降低。但更重要的是,IFN-β 和IL-1β 在宿主免疫反應中具有多種作用;因此,關于他們在宮頸癌中的實際變化和角色(如果有)的問題仍有待澄清。
TREM-1 是2000 年發現的一種新型生物標志物。它是一種免疫球蛋白家族成員,存在于中性粒細胞、單核細胞、巨噬細胞和內皮細胞表面。研究發現TREM-1 激活炎癥反應、炎癥介質的合成和抗炎介質的抑制,TREM-1 能夠通過Toll 樣受體(TLR)合成促炎細胞因子,并調節先天炎癥反應增強TLR 介導的信號通路[18-19]。因此,TREM-1水平升高與宮頸癌患者全身炎癥存在一致。TREM-1 的表達被描述為在各種腫瘤模型中促進腫瘤發生并支持腫瘤生長,包括腸癌和肺癌[20]。在非小細胞肺癌(NSCLC)患者中,TREM-1 的表達與腫瘤復發和低生存率相關。這些NSCLC 患者的血液單核細胞與肺癌細胞共培養導致單核細胞中TREM-1 上調,并且在同一研究中,shRNA 抑制TREM-1 表達與肺癌細胞侵襲性降低有關[21]。
TNF-α 是一種多功能細胞因子,通過兩種受體發揮作用,參與細胞凋亡、細胞存活、炎癥和免疫。TNF-α 是一種17-kDa 的蛋白質,由157 個氨基酸組成。在人類中,該基因被映射到第6 號染色體。其生物活性主要受可溶性TNF-α 結合受體的調節。TNF-α 主要由活化的巨噬細胞、T 淋巴細胞和自然殺傷(NK)細胞產生。TNF-α 在多種其他細胞中低表達,包括成纖維細胞、平滑肌細胞和腫瘤細胞。在細胞中,TNF-α 被合成為前TNF(26 kDa),它是膜結合的,并在其前結構域被TNF 轉換酶(TACE)切割后釋放。TNF-α 有助于感染期間的炎癥和清除感染后的抗炎/組織修復過程。其在低表達水平下的作用有助于腫瘤發生。暴露于炎癥刺激后,TNF-α 以及IL-1 和其他趨化因子主要由活化的巨噬細胞和其他髓系細胞產生,這些細胞將嗜中性粒細胞和單核細胞吸引并激活到腫瘤部位。在腫瘤中,腫瘤細胞上的TNF-α 主要與TNF-R2 相互作用,通過產生活性氧中間體和通過神經酰胺發出信號來促進腫瘤細胞的清除。因此,膜形式的瘤內保存(具有較低的瘤內TACE活性)與更好的預后相關。TNF-α 的抗腫瘤作用已通過血管破壞和腫瘤壞死對原發性腫瘤產生顯著的抗癌作用得到證實。活化的巨噬細胞主要分泌TNF-α,這有助于解釋為什么在發燒、敗血癥、癌癥、阿爾茨海默病和腸易激綜合征期間TNF-α的循環水平會增加。在目前的研究中,與對照相比,宮頸癌患者的全身TNF-α 水平顯著上調,該結果與以往宮頸癌與TNF-α 關系的研究結果相一致[22-24]。但是宮頸癌患者體內TNF-α 升高的具體原因及TNF-α 對宮頸癌組織的作用還需要進一步研究。
總之,本研究發現在宮頸癌患者中血清IFN-β、IL-1β 增加,宮頸上皮組織TREM-1 和TNF-α 表達增加,這表明它們在宮頸癌的病理生理學中具有一些重要作用。觀察到的表達變化很可能與宮頸癌相關,并支持全身炎癥參與宮頸癌的假設。然而,需要更多的研究來闡明這些細胞因子改變在宮頸癌的發生、發展中的具體機制。

