共價有機框架的合成及其在生物醫學領域應用研究進展
黎婧怡,成雨純,謝 輝,陳 楠
(上海師范大學化學與材料科學學院,上海 200234)
0 引言
共價有機框架(COFs)是由碳(C)、氫(H)、氧(O)、硼(B)和氮(N)等輕元素通過共價鍵而合成的一類多孔結晶性有機聚合物[1-5].其共價連接的分子結構單元在網狀化學的引導下可延伸至二維(2D)或三維(3D).COTE等[6]在2005年首次報道了通過縮合反應合成2種2D COFs的方法,隨后,不同種類的COFs及其衍生物被設計和合成.COFs具有結構穩定、密度低、比表面積大、結構可設計、孔徑大小均一且可調節、易于合成后修飾等諸多優點,因而被開發應用于多個領域,例如氣體吸收和分離、催化、傳感、光電、質子傳導、能量存儲等[1,7-11].作為一類生物兼容性良好的多孔材料,COFs被認為在生物傳感、抗菌以及腫瘤治療等生物醫學研究中具有潛在應用前景.與模塊化多孔晶體材料的另一個主要成員,即金屬有機框架(MOFs)相比較[12],COFs具有一些獨特的優勢.首先,更穩定的共價化學鍵提高了COFs在復雜生物環境中的穩定性,而無金屬離子釋放則降低了其細胞毒性.其次,通過預先設計,可以很方便地合成尺寸和形狀可控的納米結構[13],均勻的納米孔和開放的通道使COFs可以更有效地搭載生物活性物質,并為其提供擴散通道.經過研究人員的不懈努力,COFs在生物醫學領域的應用已經取得了實質性的進展,本研究主要綜述了COFs的制備方法及其在生物學應用方面的研究進展.
1 COFs的制備方法
形成高度有序和結晶的COFs的關鍵是共價鍵形成過程中對于熱力學平衡的調節,研究者們往往根據后續應用所需的材料孔隙率以及尺寸結構等因素來選擇COFs材料合成所需的結構單元,并設計合成路線.目前已開發了多種COFs的合成方法,其中較為常用的方法包括:溶劑熱合成法、離子熱合成法、機械化學合成法以及界面合成法等.
1.1 溶劑熱合成法
溶劑熱合成法因其合成方式簡單、制備的材料顆粒大小和形貌可控等優點,已成為目前制備COFs的常用方法之一.例如XU等[14]通過2,4,6-三(4-氨基苯氧基)-1,3,5-三嗪(TPT-NH2)和2,4,6-三(4-甲酰基苯氧基)-1,3,5-三嗪(TPT-CHO)以及對苯二甲醛在溶劑熱條件下進行縮合反應,合成了2種新型的2D COFs(TPT-COF-1和TPT-COF-2),后續實驗表明,所制備的TPT-COF-1具有高結晶度和較大比表面積(1 589 m2·g-1),如圖1(a)所示.此外,XIONG等[15]以2,6-二氨基對苯二酚(DAAQ)和1,3,5-三甲基間苯三酚(TFP)為原料,采用溶劑熱法合成了COFDAAQ-TFP電致變色薄膜.該2D COF相鄰層之間堆疊的π軌道以及垂直于堆疊方向的納米孔,為電致變色過程中的電荷轉移提供了方便.最近,YANG等[16]提出了一種在溶劑熱合成過程中加入表面活性劑,并與酸調節相結合的策略,用于設計β-酮烯胺連接的COFs,成功制備了直徑低至20 nm、長度高達幾微米的COFs納米纖維,以及厚度為18 nm的COFs納米板.
溶劑熱合成法的反應條件高度依賴于構建塊的溶解性、反應性以及反應的可逆性.此外,反應時間、反應溫度、溶劑條件和催化劑濃度也是溶劑熱法制備晶態多孔COFs的關鍵影響因素,諸多復雜因素的影響使該方法耗時較長,且較難用于COFs的大規模生產.
1.2 離子熱合成法
應對大規模的工業生產和應用需求,開發一種簡單、溫和、綠色的COFs材料合成路線是非常必要的.離子液體(IL)是一種低熔點的有機鹽,由液態離子組成,具有低蒸汽壓、不可燃、液體范圍寬、對有機和無機化合物溶解性好和結構可設計等優勢,因而作為合成晶態材料的一種綠色、安全的反應介質受到了廣泛的關注.例如,KUHN等[17]首次通過簡單的策略,以離子液體為綠色溶劑,制備了一系列含COFs的3D離子液體(3D-IL-COFs),如圖1(b)所示.這些3D-IL-COFs顯示出高結晶度、良好的BET表面積和對CO2/N2和CO2/CH4具有吸附選擇性.
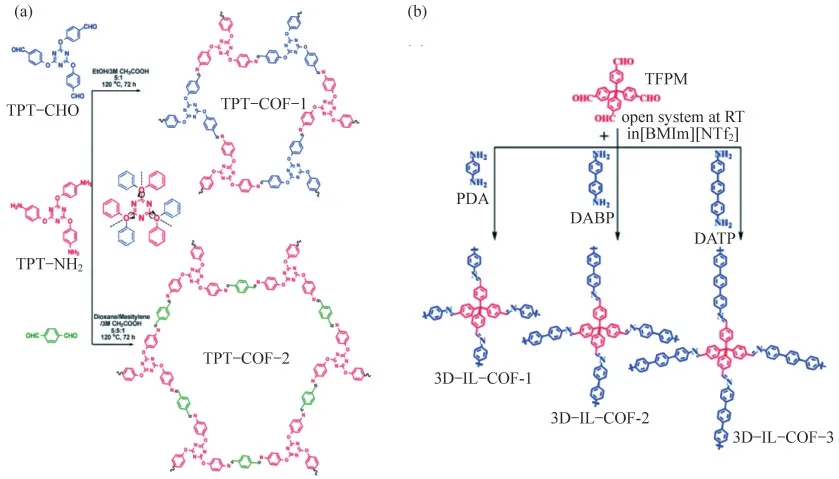
圖1 COFs的合成方法示意圖.
1.3 機械化學合成法
考慮到溶劑熱法的反應條件較為復雜,而通過簡單、經濟和環境友好的途徑構建的機械化學合成法可以克服以上方法的局限性.例如,BISWAL等[18]采用常溫、無溶劑、化學研磨的方法合成了3種具有良好熱穩定性和化學穩定性的網狀COFs.在無溶劑的條件下,利用席夫堿醛-胺縮合反應,將1,3,5-三甲酰基間苯三酚(TP)和對苯二胺(PA-1)放置在研缽中,通過在室溫下用研杵研磨得到COFs,如圖2(a)所示.所合成的COFs結晶度和孔隙率適中,在沸水、酸和堿中均具有顯著的穩定性,且相較于溶劑熱法所合成的母體COFs,該COFs的層剝離與COFs的形成可以同時發生.機械化學合成法的優點在于簡單、安全、環保,但采用該方法合成的COFs結晶度和孔隙率略差.
1.4 界面合成法
大多數傳統的COFs合成方法對材料的形態控制不佳,而界面合成策略是一種制備COFs薄膜并能同時控制其厚度的新穎方法.例如,DEY等[19]在環境條件下利用液-液界面作為模板,制備了厚度50~200 nm高度結晶的COFs.該薄膜是在沒有任何支撐的情況下以獨立形式生長而成的,表現出顯著的溶劑滲透和溶質排斥性能,可以進一步轉移到任何需要的基底上.而后MATSUMOTO等[20]將1,3,5三(4-氨基苯基)苯(TAPB)和對苯二甲醛(PDA)合成亞胺連接的TAPB-PDA COFs.在路易斯酸催化劑(Sc(OTf)3)催化下,TAPB-PDA COF通過界面聚合形成的自支撐膜.如圖2(b)所示.這種方法合成的亞胺連接的COFs連續膜,其橫向尺寸由聚合容器的尺寸決定,而膜的厚度則由初始單體的濃度控制,這種方法可以制備厚度4~50 nm的COFs薄膜,實現了納米尺度COFs的精確控制與合成.
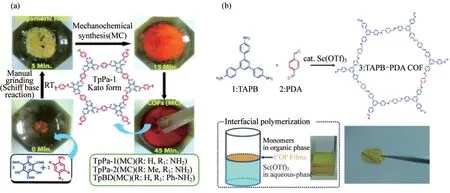
圖2 利用機械化學合成法和界面合成法制備COFs.
綜上所述,溶劑熱合成法運用比較廣泛,但難以用于大規模生產;離子熱合成法實現了COFs材料的大規模生產,并且該方法合成簡單、溫和;機械力化學合成法合成方式簡單,但合成的COFs結晶度稍差;界面合成法克服了傳統COFs合成方法對其形態難以控制的缺點,實現了COFs薄膜制備的同時,并實現了對其厚度的控制.
2 COFs的生物學應用
COFs材料的化學性質穩定,可設計性強,因而成為了材料科學的研究熱點.隨著相關合成策略的發展和豐富,COFs的種類也更加多樣化.由于COFs具有低的骨架密度、高的熱化學穩定性、大的比表面積及孔隙率、可控的化學物理性質、開放的孔道結構等特點,在催化技術、氣體分離及儲存、光電材料、環境與能源等諸多領域中展現出廣闊的應用前景.然而COFs在生物醫藥領域的應用研究還處于起步階段.與其他的多孔有機骨架材料,如MOFs等相比,COFs具有更好的穩定性、不含有毒金屬離子等優勢[21],使其在生物學應用方面具有良好的潛力,并已經被嘗試應用于生物傳感、抗菌制劑、抗腫瘤治療等領域.以下重點介紹其在生物傳感器以及腫瘤治療方面的應用.
2.1 生物傳感器
由于COFs具有良好的生物相容性、較低的細胞學毒性,且在水溶液中保持高穩定性,在生物傳感領域得到廣泛應用.與其他晶體型多孔材料相比,COFs的優勢之一在于能通過合成改性后引入不同的官能團,從而賦予其獨特的功能,如催化活性.研究者們基于COFs自身的催化活性,探索了其在生物傳感領域的應用.例如,WANG等[22]采用合成后改性的方法,合成了一種基于鐵卟啉的COFs材料(Fe-COF),如圖3(a)所示.Fe-COF具有很強的辣根過氧化物酶(HRP)擬酶活性,能在3,3′,5,5′-四甲基聯苯胺(TMB)存在條件下,用于過氧化氫(H2O2)的比色分析和檢測,并獲得了較寬的檢測范圍和較低的檢測限.當Fe-COF與葡萄糖氧化酶(GOx)聯用時,進一步實現了對葡萄糖的比色分析和定量測定,其檢測范圍為5~350 μmol·L-1,檢測極限為1.0 μmol·L-1.該Fe-COF具有制備簡單、穩定性好和催化活性高的優點,從而被成功地應用于人血清樣品中葡萄糖的測定.
COFs良好的生物相容性可以為生物分子提供合適的微環境,且COFs的多孔結構使其具有更高的表面自由能和更大的活性比表面積,有助于實現對目標分子的高效負載.此外,COFs的有序晶體結構可以加速電荷載流子的遷移,改善生物傳感器的響應速率.因此,COFs與電化學生物傳感器的交叉融合為多種生物分子的檢測提供了新的策略.例如,FENG等[23]設計了一種HRP-Ab2-Au-COF復合探針,如圖3(b)所示,用于心肌鈣蛋白I(cTnI)的高靈敏度電化學測定.COF的高孔隙率確保了HRP的高負載,COFs表面修飾的金納米粒子既為抗體Ab2提供了連接平臺,又提高了COFs的電導率.在H2O2和HRP的協同作用下,溶液中的對苯二酚(HQ)被催化氧化為苯醌(BQ),然后BQ在電極表面還原,產生電化學信號.基于H2O2-HRP-HQ信號放大系統,該cTnI生物傳感器的線性響應范圍為5 pg·mL-1~10 ng·mL-1,檢測限為1.7 pg·mL-1,并在實際樣品測試中表現出良好的回收率和重現性.
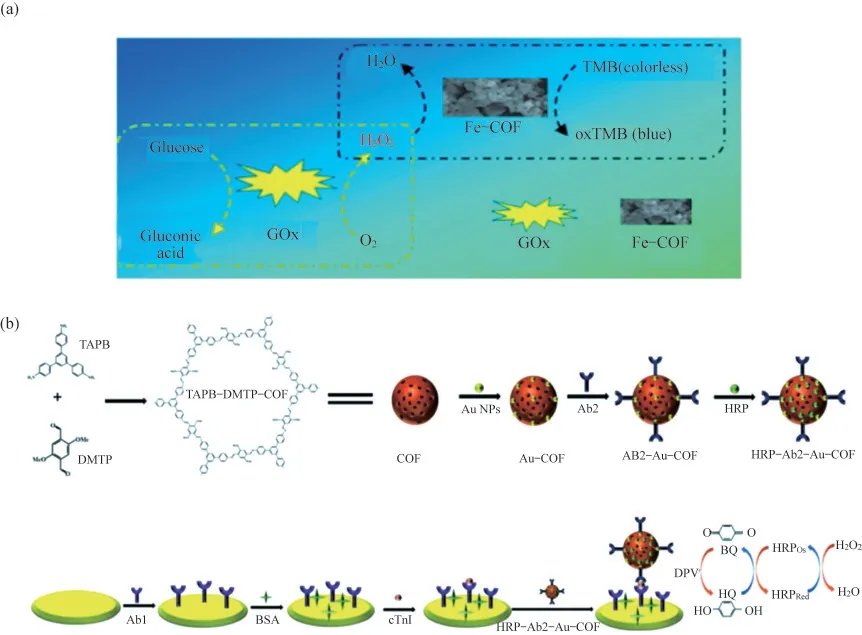
圖3 COFs在生物傳感方面的應用.
2.2 腫瘤治療
除了用于構建生物傳感器外,COFs在發展腫瘤治療新方法及其應用方面也非常具有潛力,其被認為是用作藥物載體、光熱療法(PTT)、光動力療法(PDT)和構建腫瘤協同治療平臺的優良材料.
2.2.1 藥物遞送
化療是最廣泛使用的腫瘤治療方法,特別是針對有擴散和轉移趨勢的腫瘤.許多小分子化療藥物[24-25],如阿霉素(DOX)、順鉑和紫杉醇等,腫瘤靶向能力往往較差,并伴隨較為明顯的副作用.納米藥物遞送系統被證明具有較高的載藥量、精確的靶向性以及可控的副作用,對改進傳統化療具有重要意義.COFs以其高比表面積、可調節的孔形狀、大孔隙率、良好的生物相容性、較好的生物降解性和易于改性等優點,在藥物傳遞領域引發了廣泛關注.例如,LIU等[26]以1,3,5-三(4-氨基苯基)苯(TAPB)和2,5-二甲氧基對苯二甲醛(DMTP)為原料,首次用一鍋法成功地實現了阿霉素(DOX)的原位包埋,合成了DOX@TAPBDMTP-COF(DOX@COF),如圖4(a)所示.這一簡單而快速的載藥策略不僅縮短了藥物攝取的時間,也實現了較高的載藥效率(負載率為32.1%).DOX@COF表現出pH響應釋放的特性,能夠在弱酸性的腫瘤微環境中有效釋放DOX.體外和體內實驗均證明其具有良好的生物相容性和較高的腫瘤抑制效率.
2.2.2 PDT
PDT是指將光敏劑(PSs)遞送至腫瘤部位,利用特定波長的光進行激發,將氧激發成單線態氧(1O2),從而導致腫瘤細胞壞死和凋亡的一種非侵入性治療方法[27].由于大多數傳統的PSs在水中的溶解性很差,其PDT效果通常受到細胞攝取率低的限制.將PSs修飾或負載于納米載體上可以克服這一缺陷,從而改善PDT抗腫瘤治療的效果.COFs非常適合作為PSs的納米載體,用作PDT治療,一些新型的COFs材料已經被合成,并應用于腫瘤的PDT.例如,CHEN等[28]設計并合成了一類基于碳點的納米級COFs.該工作以對苯二胺和氟硼二吡咯(BODIPY)為模型單體,與含醛的碳點反應,構建得到了2種納米級COFs,分別命名為CCOF-1和CCOF-2,如圖4(b)所示.經聚乙二醇(PEG)修飾后,生成了更好穩定性和分散性的CCOF-1@PEG和CCOF-2@PEG.實驗結果表明,CCOF-2@PEG具有更好的生理穩定性和生物相容性,以及具有強大的活性氧產生能力,有潛力成為一種優良的光動力治療劑.
2.2.3 PTT
PTT是PDT之外另一種得到廣泛應用的非侵入性腫瘤治療方法.該方法利用近紅外(NIR)激光觸發光熱轉導劑(PTAs),能量轉移產生的熱量會引起腫瘤部位的溫度升高,從而選擇性地殺死腫瘤細胞.與手術和化療等傳統方法相比,PTT具有微創和高效的特點,適用于安全有效的腫瘤消除.納米級的COFs可以作為PTAs的載體,實現其在腫瘤部位的有效富集和可控釋放.例如,WANG等[29]首次采用無模板溶液陳化法,將對苯二胺(Pa)、Tp和乙酸在室溫下混合,制備得到了均勻微米級的多層TpPa-COF,如圖4(c)所示,經過三價鐵離子(Fe3+)對均勻微米級分層COF(HCOF)進行合成后金屬化,使其具備了光熱劑(PTA)的性質.在激光照射下,合成的Fe-HCOF具有良好的光熱效應和體內抗腫瘤效果(效果達到87.8%),該工作通過合成后修飾使COFs功能化成為可能.
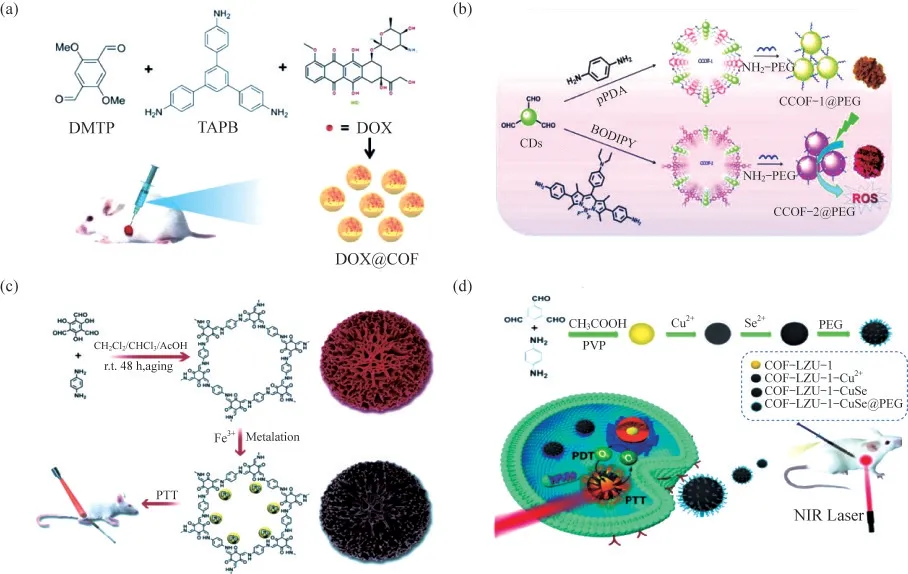
圖4 COFs在腫瘤治療中的應用.
2.2.4 協同治療
由于腫瘤的異質性和復雜性,單一療法往往效果有限,很難實現對腫瘤組織的根除,而協同治療可以克服單一療法的缺點,進一步提高腫瘤治療的效果.COFs獨特的理化性質決定其很適合作為一個多功能的納米平臺,實現多種療法的組合和協同作用.例如,HU等[30]制備了一種基于COFs的多功能納米治療劑,將PDT與PTT這2種療法進行協同治療.在室溫下采用溶液相合成法制備了高度單分散的COF,所合成的COFs納米粒子在650 nm和808 nm激光照射下表現出良好的光動力效應.將原位形成的銫化銅(CuSe)納米粒子與COFs偶聯,構建了COF-CuSe治療平臺,如圖4(d)所示.該納米復合材料具有較高的光熱轉換效率和增強的光動力學效應,體外和體內實驗均證明了COF-CuSe通過協同光熱效應和光動力效應,具有顯著的抗腫瘤效果.在另一項工作中,GUAN等[31]報道了一種基于納米COFs的納米復合試劑.該復合物表面修飾了作為PSs的BODIPY-2I,并包埋了碳酸鈣(CaCO3)納米粒子,最后在表面修飾了能夠靶向腫瘤細胞表面CD44受體的糖胺聚糖(Gag),命名為CaCO3@COF-BODIPY-2I@Gag.該納米復合物能夠特異性靶向腫瘤細胞,光觸發產生的1O2不僅能夠直接殺死腫瘤細胞,還導致了線粒體功能障礙,失去鈣調節功能,而線粒體的鈣緩沖能力是細胞內鈣離子的重要調節機制,破壞該功能很容易產生鈣超載.這樣,即使在較溫和的PDT條件下,PDT與1O2觸發的鈣超載協同治療,也可以獲得有效的抗腫瘤治療效果.
3 結論與展望
總結和比較了目前較為常見的幾種COFs合成方法,重點介紹了COFs在生物傳感和腫瘤治療等生物醫學領域的研究進展.現有的研究結果已經充分證明了COFs在生物學應用中的適用性和無限潛力.然而,作為一類新型材料,COFs進一步的生物學應用仍然面臨許多挑戰.例如,要將COFs用作生物制劑,其長期生物毒性和代謝結果還需進行系統分析和評估;細胞攝取對材料的大小有要求,材料形貌越均勻,尺度越小,則越易被攝取,現有的合成方法還難以實現大規模制備形貌和尺度均一性良好的COFs材料,因此還需要優化納米COFs的合成方法.此外,目前COFs作為納米載體主要用于小分子藥物和PSs等的載帶,而COFs在核酸、蛋白等生物活性分子的遞送方面還有很大的拓展空間.在成功解決這些基本問題后,COFs作為一種納米材料平臺,在生物醫學方面的運用將會越來越廣泛.

