大黃免煎顆粒通過miR-135a/FAM129A分子軸影響胰腺泡細胞損傷的作用機制
程冰潔 郭霞 戴雅琴 陳佩 李長雪
(1湖北省第三人民醫(yī)院中醫(yī)科,湖北 武漢 430033;2武漢科技大學中醫(yī)康復科;3湖北省第三人民醫(yī)院 藥學部)
胰腺炎是外科中常見的無菌性胰腺炎癥,致病因素多為酒精濫用和膽結石等,具有復雜多樣臨床表現(xiàn)〔1,2〕。輕中度胰腺炎不需特殊治療,重癥胰腺炎伴有多種并發(fā)癥和全身過度炎癥,病死高達30%~40%〔3〕。研究發(fā)現(xiàn),胰腺泡細胞損傷是胰腺炎發(fā)生和發(fā)展中發(fā)揮重要作用〔4,5〕,因此,減輕胰腺泡細胞損傷對治療胰腺炎具有重要的意義。大黃免煎顆粒在治療重癥胰腺炎方面歷史悠久〔6~8〕,但其對胰腺泡細胞損傷作用機制尚待研究。大量研究表明,miRNAs在多種疾病的發(fā)生發(fā)展中扮演著重要的角色,如miR-23b〔9〕、miR-25-3p〔10〕、miR-135a〔11〕和miR-140-5p〔12〕等miRNAs通過調控下游蛋白對多種疾病關鍵細胞的增殖和凋亡具有重要的調控作用。本研究探討大黃免煎顆粒通過miRNAs調控下游蛋白對胰腺泡細胞損傷的作用機制。
1 材料與方法
1.1細胞株及主要試劑 大鼠胰腺泡細胞AR42J購于美國ATCC。DMEM培養(yǎng)基、牛膽酸鈉、青霉素-鏈霉素溶液和胎牛血清購于美國Sigma公司;各引物序列、miR-135a mimics/inhibitor和pcDNA-FAM129A由中國Biomics Biotech公司設計和合成;Trizol、反轉錄試劑盒和實時定量PCR試劑盒購于美國Amresco公司;二喹啉甲酸(BCA)試劑盒及RIPA裂解液購自中國beyotime公司;脂質體2000轉染試劑盒、脂肪酶及淀粉酶試劑盒購于法國EP公司;CCK-8試劑盒和膜聯(lián)蛋白(Annexin) V-異硫氰酸熒光素(FITC)/碘化丙啶(PI)試劑盒購于美國BD公司。FAM129A一抗及二抗購于美國CST公司。
1.2細胞培養(yǎng)及轉染 將大鼠胰腺泡細胞AR42J培養(yǎng)于含1%青霉素-鏈霉素溶液和10%胎牛血清的DMEM培養(yǎng)基中,并放于37℃、5%條件下的培養(yǎng)箱中培養(yǎng)。細胞融合率為85%時進行傳代。將AR42J細胞隨機分為空白對照(NC)組、模型(Model)組、大黃免煎顆粒(DHG)組、miR-135a抑制物(miR-135a inhibitor)組、過表達FAM129A(pcDNA-FAM129A)組及miR-135a模擬物+過表達FAM129A(miR-135a mimic+pcDNA-FAM129A)組。NC組為空白對照;Model組用500 μmol/L牛膽酸鈉處理;DHG組用500 μmol/L牛膽酸鈉和1.25 μmol/L大黃免煎顆粒處理;miR-135a inhibitor用500 μmol/L牛膽酸鈉、1.25 μmol/L大黃免煎顆粒和轉染miR-135a inhibitor處理;pcDNA-FAM129A組用500 μmol/L牛膽酸鈉、1.25 μmol/L大黃免煎顆粒和轉染pcDNA-FAM129A處理;miR-135a mimic+pcDNA-FAM129A組用500 μmol/L牛膽酸鈉、1.25 μmol/L大黃免煎顆粒及轉染miR-135a mimic和pcDNA-FAM129A處理。細胞轉染過程參考脂質體2000轉染試劑盒。
1.3RT-qPCR檢測AR42J細胞及損傷模型中miRNAs的表達水平 取NC組、Model組、DHG組、miR-135a inhibitor組中處于對數(shù)生長期的AR42J細胞,Trizol溶液提取AR42J細胞總RNA,定量分析后,參考反轉錄試劑盒將總RNA反轉錄為cDNA。然后以U6為內參,進行實時定量PCR試劑盒進行miRNAs的定量分析,引物U6正義:5′-CTCGCTTCGGCAGCACA-3′、反義:5′-AACGCTTCACGAAT-TTGCGT-3′;miR-23b正義:5′-GGGTTCCTGGCATGCTGATT-3′、反義:5′-TCGTGGTTGCGTGGTAATCC-3′;miR-25-3p正義:5′-TGTTGAGAGGCGGAGACTTG-3′,反義:5′-GCACTGTCAGACCGAGACAA-3′;miR-135a正義:5′-AGCTGTCGTGTCTTATGGCT-3′,反義:5′-TGACTGCGTGTTTAGTGGC-3′;miR-140-5p正義:5′-TCTGTGTCCTGCCAGTGGTT-3′、反義:5′-CCAGTATCCTGTCCGTGGTTC-3′。qPCR體系:10 μl TB Green Premix Ex Taq Ⅱ,各0.8 μl PCR正反引物,0.4 μl ROX Reference Dye,2 μl DNA模板及6 μl H2O2。qPCR條件:95℃ 5 min,94℃變性30 s,60℃退火30 s,進行35個循環(huán)。實驗結果采用2-ΔΔCt法進行計算。
1.4Western印跡檢測各組AR42J細胞中FAM129A的表達水平 取Model組、pcDNA-FAM129A組及miR-135a mimic+pcDNA-FAM129A組中處于對數(shù)生長期的AR42J細胞,冰上通過RIPA裂解液裂解后,BCA試劑盒進行蛋白定量分析。進行10%的十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE),電泳3 h后,半干轉膜法轉印至聚偏二氟乙烯膜上,用含5%脫脂牛奶的TTBS封閉1 h后,加入FAM129A一抗(1∶10 00),4℃孵育過夜,洗滌4次,加入FAM129A二抗(1∶2 000),再次洗滌4次,加入電化學發(fā)光(ECL)底物,在GIS凝膠成像系統(tǒng)中顯影并拍照,用Image J進行條帶灰度值分析。
1.5雙熒光素酶報告基因驗證miR-135a和FAM129A的靶向關系 采用Starbase生物信息學數(shù)據(jù)庫(http://www.starbase.sysu.edu.cn/)預測miR-135a和FAM129A潛在結合區(qū)域。將WT-FAM129A-3′-UTR和MUT-FAM129A-3′-UTR區(qū)域構建至pGLO-basic載體螢火蟲熒光素酶基因下游,然后分別與miR-NC和miR-135a inhibitor共轉染入至293T細胞中。在37℃、5% CO2培養(yǎng)箱培養(yǎng)8 h,用含10%胎牛血清的DMEM培養(yǎng)基培養(yǎng)48 h后,收集細胞,參考雙熒光素酶試劑盒說明書,以海腎熒光值作為內參,采用酶標儀檢測熒光素酶活性。
1.6CCK-8檢測各組AR42J細胞活力 取NC組、Model組、DHG組、miR-135a inhibitor組、pcDNA-FAM129A組及miR-135a mimic+pcDNA-FAM129A組中對數(shù)生長期AR42J細胞種于96孔板中(5×103個/孔),并置于37℃、5% CO2培養(yǎng)箱培養(yǎng)24 h后,每孔加入10 μl CCK-8溶液,培養(yǎng)箱孵育2 h,然后使用酶標儀在450 nm處測定OD值,并利用各時間點的測定OD值繪制細胞增殖曲線。
1.7Annexin V-FITC/PI檢測各組AR42J細胞凋亡水平 用預冷的PBS重懸NC組、Model組、DHG組、miR-135a inhibitor組、pcDNA-FAM129A組及miR-135a mimic+pcDNA-FAM129A組中對數(shù)生長期AR42J細胞,2 000 r/min離心10 min,并洗滌細胞,加入300 μl去離子水稀釋的1×結合緩沖液,再加入5 μl Annexin V-FITC和500 μl預冷緩沖液,室溫避光孵育15 min,然后加入2.5 μl PI,最后補加200 μl的1×結合緩沖液上機檢測細胞凋亡情況。
1.8脂肪酶和淀粉酶試劑盒檢測脂肪酶和淀粉酶活性 脂肪酶和淀粉酶試劑盒利用耦聯(lián)酶促反應來檢測NC組、Model組、DHG組、miR-135a inhibitor組、pcDNA-FAM129A組及miR-135a mimic+pcDNA-FAM129A組中對數(shù)生長期AR42J細胞中脂肪酶及淀粉酶活性。脂肪酶在波長為570 nm處進行比色,淀粉酶在波長為405 nm處進行比色,步驟參考脂肪酶和淀粉酶試劑盒說明書。
1.9統(tǒng)計學方法 采用SPSS20.0統(tǒng)計學軟件進行t檢驗,單因素方差分析。相關圖片采用Graphpad 8.0軟件進行繪制。
2 結 果
2.1牛膽酸鈉構建胰腺泡細胞損傷模型 采用梯度濃度牛膽酸鈉處理大鼠胰腺泡細胞AR42J,CCK-8結果顯示,隨著牛膽酸鈉處理濃度(50,100,200,400,800,1 600,3 200,6 400 μmol/L)的上升,AR42J細胞活力抑制率〔(17.12±2.21)%;(20.87±3.04)%;(32.26±3.91)%;(42.96±4.53)%;(64.18±6.09)%;(80.13±7.05)%;(86.18±7.86)%;(90.75±6.02)%〕顯著上調,且牛膽酸鈉的半抑制濃度(IC50)為522.8 μmol/L。故后續(xù)試驗采取500 μmol/L處理AR42J細胞作為大鼠胰腺泡細胞損傷模型,并設為Model組。
2.2miR-135a在胰腺泡細胞損傷模型中異常高表達,且大黃免煎顆粒能抑制其表達 RT-qPCR結果顯示,Model組中miR-23b、miR-25-3p、miR-135a及miR-140-5p的表達水平顯著高于NC組(P<0.05);且Model組中miR-135a的表達水平顯著高于miR-23b、miR-25-3p及miR-140-5p的表達水平(P<0.05),見表1。此外,后續(xù)試驗探討了大黃免煎顆粒對Model組中miR-135a表達水平的影響,NC組miR-135a表達為(0.99±0.07),Model組(0 μmol/L大黃免煎顆粒)miR-135a表達為(1.86±0.05),DHG組(0.25、0.50、1.25、2.50、5.00 μmol/L大黃免煎顆粒)miR-135a表達分別為(1.74±0.06,1.43±0.03,1.05±0.04,0.64±0.04,0.40±0.03),結果表明,DHG組大黃免煎顆粒能顯著抑制Model組中miR-135a的表達水平(P<0.05);且當DHG組中大黃免煎顆粒處理濃度為1.25 μmol/L時,miR-135a的表達水平與NC組無顯著性差異。提示胰腺泡細胞損傷模型中,miR-135a異常高表達,且大黃免煎顆粒能夠抑制胰腺泡細胞損傷模型中miR-135a表達。
2.3大黃免煎顆粒通過miR-135a對胰腺泡細胞模型損傷的影響 RT-qPCR結果顯示,Model組中miR-135a的表達水平顯著高于NC組、DHG組及miR-135a inhibitor組(P<0.05);DHG組miR-135a的表達水平顯著高于miR-135a inhibitor組(P<0.05),且與NC組無顯著性差異(P>0.05);miR-135a inhibitor組miR-135a的表達水平顯著低于NC組(P<0.05)。CCK-8結果顯示,Model組中AR42J細胞活力顯著低于NC組、DHG組及miR-135a inhibitor組(P<0.05);DHG組AR42J細胞活力顯著低于miR-135a inhibitor組(P<0.05),且與NC組無顯著性差異(P>0.05);miR-135a inhibitor組AR42J細胞活力顯著高于NC組(P<0.05)。Annexin V-FITC/PI及脂肪酶和淀粉酶試劑盒結果顯示,Model組中AR42J細胞凋亡及脂肪酶和淀粉酶水平顯著高于NC組、DHG組及miR-135a inhibitor組(P<0.05);DHG組AR42J細胞凋亡及脂肪酶和淀粉酶水平顯著高于miR-135a inhibitor組(P<0.05),且與NC組無顯著性差異(P>0.05);miR-135a inhibitor組AR42J細胞凋亡及脂肪酶和淀粉酶水平顯著低于NC組(P<0.05),見表2和圖1。由以上結果可知,大黃免煎顆粒通過抑制胰腺泡細胞損傷模型中miR-135a的表達水平,從而促進AR42J細胞損傷模型增殖,并抑制其凋亡及脂肪酶和淀粉酶水平,進而緩解AR42J細胞的損傷。

表1 miR-140-5p胰腺泡細胞損傷模型細胞中miRNA的相對表達

表2 miR-135a對胰腺泡細胞模型損傷細胞的功能影響
2.4miR-135a和FAM129A的靶向關系驗證 通過生物信息學數(shù)據(jù)庫Strabase預測miR-135a的潛在靶基因,結果顯示,F(xiàn)AM129A是miR-135a的潛在靶基因,兩者潛在靶向序列見圖2A。此外,雙熒光素酶報告基因結果顯示,miR-135a mimic能夠顯著抑制野生型FAM129A載體的熒光素酶活性(P<0.05),見表3,且對突變型FAM129A載體的熒光素酶活性無顯著抑制作用。進一步,Western印跡結果顯示,miR-135a mimic組中FAM129A蛋白的表達水平顯著低于NC組(P<0.01),見圖2B。由以上實驗結果可知,F(xiàn)AM129A是miR-135a的靶基因,且miR-135a靶向負調控FAM129A蛋白的表達水平。
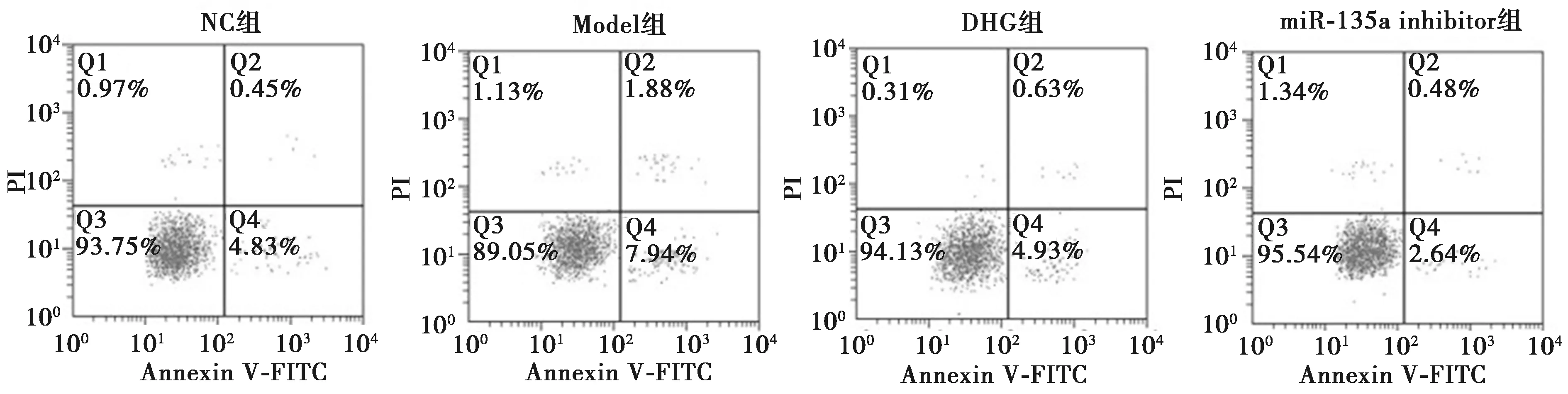
圖1 miR-135a對胰腺泡細胞模型損傷細胞的凋亡影響

表3 雙熒光素酶報告基因實驗驗證miR-135a和FAM129A的靶向關系
2.5大黃免煎顆粒通過miR-135a/FAM129A分子軸對胰腺泡細胞模型損傷的影響 Western印跡結果顯示,pcDNA-FAM129A組中FAM129A蛋白的表達水平顯著高于DHG組和miR-135a mimic+pcDNA-FAM129A組(P<0.05),見圖3;且DHG組與miR-135a mimic+pcDNA-FAM129A組無顯著性差異。CCK-8結果顯示,pcDNA-FAM129A組中AR42J細胞活力顯著高于DHG組和miR-135a mimic+pcDNA-FAM129A組(P<0.05);且DHG組與miR-135a mimic+pcDNA-FAM129A組無顯著性差異。Annexin V-FITC/PI及脂肪酶和淀粉酶試劑盒結果顯示,pcDNA-FAM129A組中AR42J細胞凋亡及脂肪酶和淀粉酶水平顯著低于DHG組和miR-135a mimic+pcDNA-FAM129A組(P<0.05);且DHG組與miR-135a mimic+pcDNA-FAM129A組無顯著性差異,見表4和圖4。由以上實驗結果可知,大黃免煎顆粒通過抑制miR-135a上調FAM129A蛋白的表達水平,從而促進AR42J細胞損傷模型增殖,并抑制其凋亡及脂肪酶和淀粉酶水平,進而緩解AR42J細胞的損傷。

圖2 miR-135a和FAM129A的靶向關系

1~3:DHC組,pcDNA-FAM129A組,miR-135a mimic+pcDNA-FAM129A組圖3 3組FAM129A表達

表4 miR-135a/FAM129A分子軸對胰腺泡細胞模型損傷細胞的功能影響

圖4 miR-135a/FAM129A分子軸對胰腺泡細胞模型損傷細胞FAM129A蛋白和凋亡率的影響
3 討 論
胰腺炎前中期是自限性的,中度的疾病,多數(shù)患者經(jīng)過胃腸減壓、手術清除壞死胰腺組織等治療方法均可痊愈,但是在臨床上胰腺炎易發(fā)為重癥胰腺炎,并進一步發(fā)展為胰腺癌,因此在外科中一直是危重癥〔13〕。胰腺炎病理特征表現(xiàn)為胰蛋白酶異常激活,其會引起急性炎癥反應并導致胰腺損傷,且進一步會導致全身炎癥反應及多器官功能障礙綜合征〔14〕。研究表明,在胰腺炎中,胰腺泡細胞增殖活力降低和凋亡水平的升高等損傷生物學行為會加重胰腺炎病情〔15〕,因此,探討緩解胰腺泡細胞的損傷是胰腺炎治療的理想途徑之一。大黃免煎顆粒性味寒苦,具有瀉火清熱、祛瘀活血、瀉下攻積和解毒清熱等功效,在治療急性重癥胰腺炎具有預后良好的療效。研究表明〔16〕,采用大黃免煎顆粒中的主要成分大黃治療重癥胰腺炎患者,能有效降低患者體內促炎細胞因子水平,從而減輕炎性反應程度,進而緩解或消除重癥胰腺炎患者繼發(fā)感染。但是大黃免煎顆粒對胰腺泡細胞損傷的作用機制尚待研究,本研究發(fā)現(xiàn),大黃免煎顆粒能有效促進胰腺泡細胞增殖并抑制其凋亡及脂肪酶和淀粉酶水平,從而緩解胰腺泡細胞損傷。此外,還發(fā)現(xiàn)其能抑制胰腺泡細胞損傷模型中異常高表達miR-135a水平。
miRNAs由內源基因編碼的非編碼單鏈RNA分子,它們通過轉錄后基因表達的調控〔17〕。研究表明,多種miRNAs對胰腺炎的發(fā)生發(fā)展中起到重要的調控作用。例如,Wen等〔18〕發(fā)現(xiàn),miR-374a-5p在胰腺炎胰腺泡細胞中表達明顯下調,其通過調節(jié)肌酸激酶(NCK)1和基質金屬蛋白酶(MMP)14表達介導核轉錄因子(NF)-κB和p38信號通路參與早期胰腺炎的發(fā)展進程;Wan等〔19〕發(fā)現(xiàn),miR-155通過抑制3-MA表達介導自噬功能受損,從而促進胰蛋白酶激活,腺泡細胞異常分泌和壞死,進而推進胰腺炎進程。本研究發(fā)現(xiàn),胰腺泡細胞損傷模型較正常胰腺泡細胞中miR-135a異常高表達,且敲降miR-135a能夠緩解牛膽酸鈉誘導的胰腺泡細胞損傷。此外,通過生物信息學數(shù)據(jù)庫和雙熒光素酶報告基因實驗證實,F(xiàn)AM129A是miR-135a的靶基因,且miR-135a靶向負調控FAM129A蛋白的表達水平。
細胞凋亡調節(jié)因子(NIBAN1/FAM129A)調控包括EIF2A、EIF4EBP1和RPS6KB1在內的一系列參與翻譯調控的蛋白的磷酸化,進而參與內質網(wǎng)應激反應和p53通路介導的細胞凋亡。研究發(fā)現(xiàn),F(xiàn)AM129A通過促進FAK的磷酸化,從而上調MMP2和細胞周期蛋白(Cyclin)D1的表達水平,進而促進非小細胞肺癌細胞的增殖和的侵襲〔20〕;此外,Zhang等〔21〕發(fā)現(xiàn),上調FAM129A蛋白表達水平能抑制雨蛙肽誘導的胰腺炎模型促炎癥細胞因子的表達。本研究發(fā)現(xiàn),過表達FAM129A促進胰腺泡細胞損傷模型增殖并抑制其凋亡及脂肪酶和淀粉酶水平,從而緩解胰腺泡細胞損傷。
綜上,大黃免煎顆粒通過抑制miR-135a表達上調FAM129A蛋白的表達水平,從而促進AR42J細胞損傷模型增殖,并抑制其凋亡及脂肪酶和淀粉酶水平,進而緩解AR42J細胞的損傷,進一步緩解胰腺炎的發(fā)展進程。

