基于老年營養風險指數構建老年射血分數保留型心力衰竭患者的預后模型
張銘煬 王佐翔 顧怡鈺 蔣廷波
江蘇省蘇州大學附屬第一醫院心血管內科,江蘇蘇州 215000
心力衰竭(heart failure,HF)是一種臨床綜合征,其特征是存在心臟結構和/或功能的異常,引起靜息和/或負荷時心輸出量減少和/或心內壓力增高,從而導致的呼吸困難等典型癥狀,也可伴有頸靜脈壓升高、肺部啰音等體征。目前按照左室射血分數(left ventricular ejection fraction,LVEF)的不同,其可分為射血分數保留的HF(heart failure with preserved ejection fraction,HFpEF)、射血分數降低的HF(heart failure with reduced ejection fraction,HFrEF)和射血分數中間值的HF(heart failure with mildly reduced ejection fraction,HFmrEF)三種[1]。在發達國家,HF 患病率為1.5%~2.0%,隨著年齡增加,超過70 歲人群患病率≥10%,并且HFpEF患者生存率與另外兩型HF 比較并無顯著差異[2-3]。HF患者由于胃腸道淤血、營養吸收障礙及全身炎癥反應等,部分患者存在營養不良。患者的營養狀況失衡,又會進一步加重HF 患者的癥狀及病死率[4]。但國內目前鮮有運用營養狀況對老年HFpEF 患者的預后進行的研究,故本研究旨運用老年營養風險指數(geriatric nutritional risk index,GNRI),探究營養狀況在評價老年HFpEF 患者預后中的價值,并建立了一個預測HFpEF 患者預后的列線圖模型。
1 對象與方法
1.1 研究對象
回顧性收集2018 年1 月至2020 年1 月就診于蘇州大學附屬第一醫院的HFpEF 患者共135 例為研究對象。納入標準:①年齡≥65 歲;②符合《中國心力衰竭診斷和治療指南2018》[1]中定義的HFpEF;③經規范化治療后按醫囑隨訪。排除標準:①嚴重肝腎功能不全;②嚴重心臟瓣膜病、先天性心臟病等器質性心臟病;③急性心肌梗死、心肌炎、腦血管意外、惡性腫瘤;④數據缺失和失訪。
1.2 研究方法
收集患者的基本信息,既往病史,實驗室相關檢查等。計算患者GNRI,公式為GNRI=1.489×白蛋白(g/L)+[41.7×(實際體重/理想體重)][5];如果實際體重大于理想體重,則比值按1 計算。其中理想體重根據Lorenz 公式得出,即:理想體重(男)=身高-100-[(身高-150)/4];理想體重(女)=身高-100-[(身高-150)/2.5][5]。主要不良心血管事件(major adverse cardiovas cular events,MACE)包括:全因死亡、心源性休克、非致死性心肌梗死、HF 再住院等。對所有患者進行12 個月的隨訪,記錄隨訪期間內是否發生MACE。將隨訪期間內發生MACE 事件的患者定義為病例組,沒有發生MACE 的患者定義為對照組。
1.3 統計學方法
采用SPSS 26.0 軟件對所得數據進行統計分析。符合正態分布的計量資料以均數±標準差()表示,采用t 檢驗。不符合正態分布的計量資料以中位數和四分位數[M(P25,P75)]表示,采用Mann-Whitney U 檢驗。計數資料以例數或百分比表示,采用χ2檢驗。運用多因素logistic 回歸分析患者隨訪期間內發生MACE 事件的獨立危險因素。使用R 語言(4.1.2)構建列線圖預測模型Nomogram,使用Bootstrap 法行內部驗證。使用ROC 曲線下面積(area under the curve,AUC)判斷模型對于MACE 事件的預測準確度。以P <0.05 為差異有統計學意義。
2 結果
2.1 兩組基線數據比較
本研究共納入135 例HFpEF 患者,其中發生MACE事件共44 例,占比32.59%。基線數據結果提示病例組患者的年齡,美國紐約心臟病學會(New York Heart Association,NYHA)分級≥Ⅲ級、合并糖尿病的比例,肌酐、高敏肌鈣蛋白T、N 末端腦鈉肽前體、肺動脈壓力高于對照組,差異有統計學意義(P <0.05);而血紅蛋白、白蛋白、GNRI 低于對照組,差異有統計學意義(P <0.05)。兩組性別、合并冠心病比例,左心房內徑、谷丙轉氨酶比較,差異無統計學意義(P >0.05)。見表1。

表1 兩組基線數據比較
2.2 隨訪期間內發生MACE 的獨立危險因素及預測價值
將單因素分析中差異有統計學意義(P <0.05)的相關指標進行相關性分析,發現白蛋白和GNRI 存在共線性,其方差膨脹因子分別為10.507 和11.607,且白蛋白AUC(0.697)小于GNRI(0.747)(Z=2.012,P=0.044),故不納入白蛋白進入多因素logistic 回歸分析中。結果顯示,NYHA 分級≥Ⅲ級、合并糖尿病比例是老年HFpEF 患者1 年內發生MACE 的危險因素(OR >1,P <0.05);GNRI 升高是其保護因素(OR <1,P <0.05)。見表2。計算GNRI 的ROC 曲線下面積為0.747(95%CI:0.654~0.839)。

表2 1 年內發生MACE 相關危險因素的多因素logistic 回歸分析
2.3 列線圖模型的構建及預測性能評估
在logistic 回歸基礎上,使用R 語言構建老年HFpEF 患者出院后1 年內發生MACE 的Nomogram模型見圖1。繪制Calibration 曲線對模型進行內部驗證見圖2。經過Hosmer-Lemeshow 檢驗,計算模型的C 指數為0.816,經過Bootstrap 隨機抽樣驗證后的C 指數為0.796,其χ2=3.379,P=0.185,擬合結果良好。該模型的AUC 為0.816(95%CI:0.734~0.897,P <0.01)。將Nomogram 模型與GNRI 兩者的ROC 曲線進行比較,通過Z 檢驗得出Z=2.034,P=0.042。證實Nomogram 模型的預測能力優于GNRI 評分,見圖3。

圖1 預測老年HFpEF 患者1 年內發生MACE 風險的列線圖模型
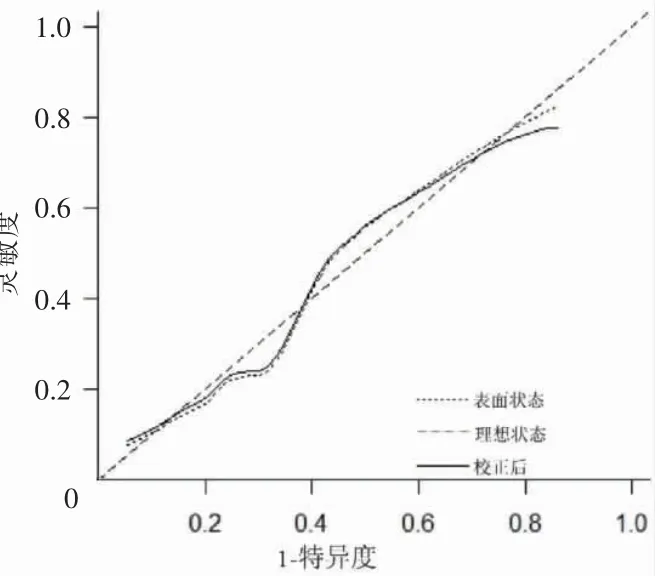
圖2 模型校準圖形
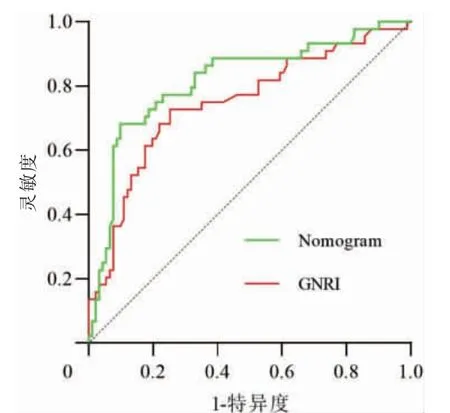
圖3 GNRI 和Nomogram 的ROC 曲線
3 討論
目前認為HFpEF 涉及心、肺、骨骼肌、血管和炎癥等方面,本病預后與多種因素相關[6]。既往已有研究提示營養不良是HFpEF 患者不良預后的獨立危險因素[7]。
現評估患者營養狀況的方式有微型營養評定、營養不良通用篩查工具等。但其存在著使用復雜、需要老年人群的密切配合且存在一定的主觀性,運用受限[8]。而Bouillanne 等[9]通過白蛋白及體重指數客觀計算得出GNRI,且發現能預測住院老年患者的死亡率。Rasheedy 等[10]證實GNRI 評估營養狀況的特異度優于微型營養評定等指標,其目前已運用于HF 患者預后評估中[11]。在對TOPCAT 實驗中的1 677 例患者進行的研究中,Minamisawa 等[12]發現,與高GNRI 的HfpEF比較,低GNRI 者心血管死亡和全因死亡風險顯著增加。
本研究亦發現,高水平GNRI 是老年HFpEF 患者1 年內發生MACE 的獨立保護因素。①營養不良會使得體內炎癥因子增加[13],炎癥反應將降低一氧化氮的利用度、減弱環磷酸鳥苷的反應,加速心肌細胞的萎縮和纖維化,造成舒張功能障礙[14-15]。②營養不良患者體內蛋白水平低,血管內膠體滲透壓降低,水鈉潴留重,造成心臟容量負荷過重,造成心臟結構性改變[16]。③營養不良患者腸道功能受損,造成腸道菌群移位[17],腸道菌群的代謝產物如短鏈脂肪酸、吲哚及其衍生物等可作為“信使”激活各種途徑作用于腦細胞,影響宿主食欲和內分泌調節,導致生長激素、胰島素樣生長因子減少[18-19]。老年HFpEF 患者隨著疾病的進展將會逐漸影響到自身的營養狀況,甚至出現心臟惡病質可能[20]。
HFpEF 患者的心腔尺寸更小,心室壁更厚,壁應力更低[21],當HFpEF 患者心室負荷已達較高水平時,出現了呼吸困難的癥狀,心室受刺激分泌的腦鈉肽水平仍較低,即患者NYHA 分級更能體現HF 的嚴重程度。糖尿病患者長期處于高糖狀態,觸發心肌血管氧化應激[22],增加活性氧水平,降低內皮一氧化氮的生物利用度,導致內皮驅動的血管舒張功能受損[23]。高糖亦會增加間質蛋白的糖基化,其產物進一步造成心肌纖維化的增加,導致心室僵硬和心室舒張功能受損[24]。
本研究存在一定程度的局限性,一方面本研究是單中心的回顧性研究,患者數量較少,可能由于樣本量不足產生偏倚;另一方面本研究可能存在未考慮在內的混雜因素,會對研究結果產生影響。
綜上所述,本研究基于GNRI 建立的列線圖模型使用簡便[25],且能夠有效預測老年HFpEF 患者1 年內發生MACE 的概率,具有一定的臨床應用價值。