優化營養路徑對結直腸癌術后胃腸功能及免疫指標的影響
熊蘭彩 駱 炯 徐小瑋
江蘇省連云港市第一人民醫院腫瘤一科,江蘇連云港 222000
我國結直腸 癌(colorectal cancer,CRC)年發病37 萬例[1]。CRC 伴體重丟失或營養不良者占比超過20%。《結直腸癌診療規范》[2]指出CRC 根治性手術是CRC 首選治療方案。部分患者由于術前營養不良而延誤手術,甚至錯失手術最佳時機。《結直腸癌圍手術期營養治療中國專家共識》[3]指出,在CRC 治療中利用多學科綜合治療協作模式,為CRC 患者營養管理提供幫助。從護理角度,既往營養篩查及管理方式局限于遵醫囑護理及對癥處置,護理人員對CRC 營養管理缺乏流程管控意識[4]。為此對既往CRC 營養管理路徑加以改進,設立優化營養路徑。為明確優化營養路徑對CRC 術后胃腸功能及免疫指標影響,進行本項研究。
1 資料與方法
1.1 一般資料
選取2018 年4 月至2021 年5 月于江蘇省連云港市第一人民醫院(以下簡稱“我院”)行根治術的CRC 患者136 例,采用隨機數字表法將其分為常規組(68 例)及優化組(68 例)。納入標準:①同意參與本研究;②年齡50~75 歲;③存在排便習慣改變、便血、腹瀉等癥狀;④行擇期CRC 根治性手術;⑤經術后病理學確診為CRC。排除標準:①預期生存期<3 個月,卡氏功能狀態評分<60 分;②伴發腸梗阻等不適合腸內營養治療;③伴發不全或完全腸梗阻;④轉移性CRC;⑤用藥過敏。常規組男36 例,女32 例;年齡50~75 歲,平均(65.26±3.19)歲;腹腔鏡結腸癌手術50 例,腹腔鏡直腸癌手術18 例。優化組男34 例,女34 例;年齡50~75 歲,平均(65.14±3.46)歲,腹腔鏡結腸癌手術48 例,腹腔鏡直腸癌手術20 例。兩組性別、年齡、手術方式比較,差異無統計學意義(P >0.05),具有可比性。本研究經我院醫學倫理委員會審議并通過(20180122A)。
1.2 護理方法
1.2.1 常規組
采用常規營養護理,術前24 h 行腸道準備,口服葡萄糖液,護理人員對營養風險加以評估,評估工具為數字評分法2002(numeric rating scale 2002,NRS2002)評分(歐洲腸外腸內營養學會研發并推薦用于營養風險篩查工具)[5],不留置胃管,術后早期拔除尿管、合理飲食及早期活動等常規護理措施。
1.2.2 優化組
采用優化營養路徑。
1.2.2.1 優化營養路徑團隊 由消化科、營養科、腫瘤科護士長、主治醫師各1 名,護士5 名遵循循證醫學理論,研究方向為探求CRC 營養支持時間、支持途徑、配方管理。
1.2.2.2 循證支持 利用“結直腸癌”“營養”“colorectal cancer”“nutrition”“nourishment”“pabulum”等作為關鍵詞,以中國知網、萬方數據庫、PubMed 等中外數據庫,用以搜尋循證醫學證據,最終納入指南類文獻2 篇、系統評價3 篇、實證研究1 篇。研究者們對證據真實性、可靠性及實用性加以評估,并制訂優化營養路徑支持方案。
1.2.2.3 優化營養路徑方案 由營養路徑管理團隊中護士為責任護士進行優化營養路徑應用進行培訓,嚴格遵循路徑示意圖中營養篩查及營養支持方案進行臨床護理,主要措施:①NRS2002 評分<3 分,術前4 h,復查NRS2002,當NRS2002 無營養不良時,進行PGSGA 量表(由Bauer 等對腫瘤設計改編主觀評估法)[6]評測,PG-SGA 量表介于0~1 分,以口服營養素補充為主。PG-SGA 量表評分>1 分,術后24 h,腸外營養(糖∶氨基酸∶脂肪比例為1∶1∶0.5,L-精氨酸0.25 g/d,L-谷氨酰胺0.1 g/次,3 次/d,持續7 d);術后48 h,均增加安素液(30%日所需熱量)口服或管飼。術后72 h,改為術后48 h 安素液量2 倍口服或管飼。術后96 h 起,安素液口服或管飼,予以全部熱量,持續至可經口飲食為止。②NRS2002 評分≥3 分,PG-SGA 評分2~3 分,營養干預方式與NRS2002 評分<3 分者相同。當PGSGA 評分≥4 分時,術前7 d 施行整蛋白標準腸內營養制劑,必要時應采用低濃度(1/2~1/3 標準),每日300~500 ml 小劑量,然后逐漸增加。術前10 h,口服碳水化合物飲品800 ml,蛋白/氨基酸攝入量在1.0~1.5 g/(kg·d)。減少食物殘渣及腸道內糞便積聚,降低感染風險。術前4 h 行再評估流程,復查NRS2002,如無營養不良進行PG-SGA 量表評測,仍存在營養風險者繼續營養支持,以口服營養素補充為主。術前4 h,復查NRS2002、PG-SGA 評測結果,仍存在營養風險者延遲手術。
1.3 觀察指標
1.3.1 胃腸功能恢復時間
記錄患者腸鳴音出現、首次肛門排氣、術后首次排便、術后首次進食、術后恢復普食的時間。
1.3.2 免疫指標情況
術前1 d、術后7 d 時采集患者空腹肘靜脈血,用流式細胞儀檢測CD4+調節性T 細胞(CD4+)、CD8+調節性T 細胞(CD8+)、CD4+/CD8+值水平,檢測方法為間接熒光免疫法。
1.3.3 營養風險評分
入組時、術后7 d 對患者進行NRS2002 評分,分數越高營養風險越大,當評分≥3 分時存在營養風險。
1.3.4 術后并發癥發生情況
記錄患者術后7 d 并發癥發生情況,包括切口感染、電解質紊亂、低白蛋白血癥、腹脹、腹瀉。
1.4 統計學方法
采用SPSS 24.0 對所得數據進行統計學分析。計量資料采用均數±標準差()表示,比較采用t 檢驗;計數資料采用例數和百分率表示,比較采用χ2檢驗。以P <0.05 為差異有統計學意義。
2 結果
2.1 兩組胃腸功能恢復時間比較
優化組術后腸鳴音出現、首次肛門排氣、術后首次排便、首次進食及恢復普食時間均短于常規組(P <0.05)。見表1。
表1 兩組胃腸功能恢復時間比較()
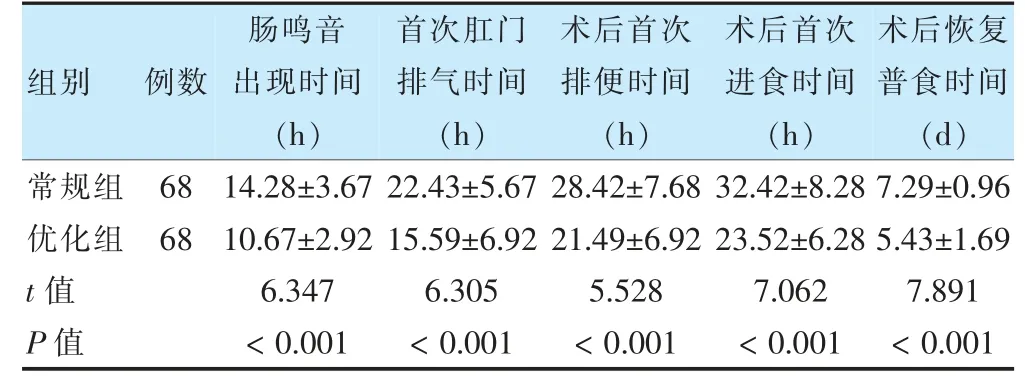
表1 兩組胃腸功能恢復時間比較()
2.2 兩組術前1 d、術后7 d 免疫功能情況比較
術前1 d,兩組CD4+、CD8+、CD4+/CD8+水平比較,差異無統計學意義(P >0.05);兩組術后7 d,CD4+、CD8+、CD4+/CD8+水平均低于本組術前1 d,且優化組CD4+、CD4+/CD8+水平高于常規組,但CD8+水平低于常規組(P <0.05)。見表2。
表2 兩組術前1 d、術后7 d 免疫功能情況比較()
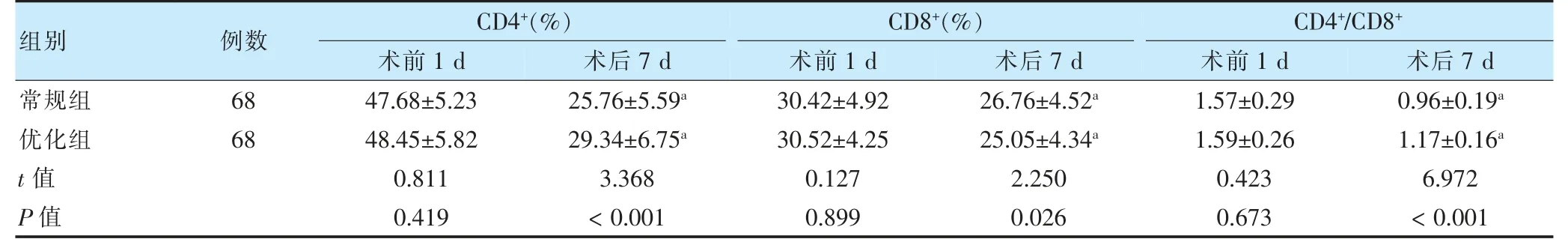
表2 兩組術前1 d、術后7 d 免疫功能情況比較()
注 與本組術前1 d 比較,aP <0.05
2.3 兩組入組時、術后7 d 營養風險評分比較
兩組入組時營養風險評分比較,差異無統計學意義(P >0.05);兩組術后7 d 營養風險評分低于入組時,且優化組低于常規組(P <0.05)。見表3。
表3 兩組入組時、術后7 d 營養風險評分比較(分,)

表3 兩組入組時、術后7 d 營養風險評分比較(分,)
2.4 兩組術后并發癥發生情況比較
優化組術后電解質紊亂1 例,并發癥發生率為1.47%(1/68);常規組術后切口感染2 例、電解質紊亂3 例、低白蛋白血癥2 例、腹脹3 例、腹瀉2 例,并發癥發生率為17.65%(12/68)。優化組并發癥發生率低于常規組(χ2=8.505,P=0.004)。
3 討論
CRC 術后胃腸功能恢復關系著術后快速康復效果[7]。CRC 受手術創傷影響,存在免疫功能抑制,術后并發癥發生風險升高[8]。早期營養支持主要旨在維持氮質平衡,為細胞營養物質正常代謝,促進各組織、器官生理及免疫功能恢復[9-10]。常規營養支持多通過對癥處置、遵醫囑處理,在CRC 根治術營養存在一定不適用性[11]。如手術麻醉過程、術前禁食等因素會增加機體應激作用,甚至導致代謝紊亂[12]。不同營養補充方式對腸道細菌過度繁殖,機體免疫力會產生不同影響[13]。可見,CRC 圍手術期營養管理需要符合機體生理營養需求。
本研究顯示,優化營養路徑術后腸道功能恢復時間明顯縮短。考慮與適當應用整蛋白標準腸內營養制劑,促進胃腸道功能恢復有關[14]。同時,術前10 h 應用口服碳水化合物飲品800 ml,可有效降低圍手術期不適感[15]。之后依次將術前4 h、術后24、48、72、96 h 作為優化營養路徑節點,分別利用糖∶氨基酸∶脂肪科學比例聯合口服L-精氨酸、L-谷氨酰胺補充機體所需營養。從本研究對術后7 d 免疫功能指標CD4+、CD4+/CD8+水平觀察可知,優化營養路徑能夠有效改善術后7 d 機體免疫功能指標。究其原因,精氨酸能夠通過信號轉導對腫瘤細胞凋亡產生誘導作用[16-17]。研究證實,術后應用精氨酸能夠增加CD4+水平[18]。谷氨酰胺能夠促使巨噬細胞、淋巴細胞分裂增殖,增加循環中CD4+/CD8+比率,繼而改善機體免疫功能[19]。術后機體對蛋白質、脂肪、碳水化合物均存在明顯需求,如術后肌蛋白分解[20]、兒茶酚胺升高[21]、胰高血糖素[22]及糖皮質激素[23]會產生協同作用,尤其是腫瘤[24],對脂肪、蛋白質、氨基酸類物質需求量驟增[25]。通過科學配比高糖∶氨基酸∶脂肪乳劑營養補充液來加速機體營養水平提升。優化營養路徑方式應用后NRS2002 評分及術后并發癥均有所改善,且術后7 d 營養水平更高。可見,以營養支持為主線,遵循循證醫學框架,形成優化營養路徑管理方式,能夠有效促進營養水平改善,降低術后并發癥。但本研究結果仍存在一定局限性,如樣本觀察時間較短,仍無法確立遠期并發癥干預效果。未來筆者將利用多中心研究進一步確認研究結果準確性。
綜上所述,在CRC 采用優化營養路徑,能夠提升胃腸功能、改善免疫指標及營養水平,減少術后并發癥發生風險。