藍莓果渣多糖提取工藝的響應面優化及其抗氧化活性
杜佳,金桂勇,陳芝飛,鄭峰洋,羅燦選,宋偉民,張曉平,劉鵬飛,席高磊
(1.河南中煙工業有限責任公司技術中心,河南 鄭州 450016;2.河南農業大學煙草學院/河南省香精香料與調香工程技術研究中心,河南 鄭州 450002)
植物多糖亦稱植物多聚糖,是植物代謝過程中聚合而成的天然高分子聚合物,起到維持植物正常生命活動的功能[1]。大量研究表明植物多糖具有抗氧化[2]、抗腫瘤[3]、抗菌[4]和抗病毒[5]等生理和藥理活性,并且無毒無害,是醫藥、食品和化妝品等領域[6]開發產品的重要原料。目前科研工作者已將人參多糖[7]、黃芪多糖[8]和枸杞多糖[9]等制成注射液或膠囊廣泛用于臨床治療和保健品[10]。
藍莓多糖是指從藍莓鮮果、葉或果渣等原料中提取出來的植物多糖[11]。已有提取方法包括微波輔助法、超聲輔助法、熱水浸提法和酶法[12-15]。但這些方法仍存在一定局限性,比如微波輔助法和超聲輔助法在提高多糖提取率的同時會改變多糖微觀結構,影響多糖活性[16];酶法成本較高,對提取條件較為苛刻[17]。熱水浸提法對設備需求較低,操作簡單,備受關注。朱金艷等[18]采用熱水浸提法對藍莓果渣中多糖進行提取,并用單因素試驗結合正交試驗對提取工藝進行了優化,但提取率仍較低,且未系統研究藍莓多糖的抗氧化活性。因此,進一步優化提取技術,提高提取率,仍是今后實現藍莓果渣多糖高效利用的重要基礎。
本研究以藍莓果渣為原料,選用熱水浸提法提取藍莓多糖,采用單因素試驗和響應面法對提取工藝進行優化,并通過抑制自由基氧化DNA反應和淬滅自由基反應系統研究藍莓果渣粗多糖和精多糖的抗氧化活性,以期為藍莓果渣多糖的合理利用提供理論依據。
1 材料與方法
1.1 試驗材料及主要儀器與試劑
藍莓果渣,由河南中煙工業有限責任公司提供。N-1300型旋轉蒸發儀、NVP-10006A型循環水真空泵(上海愛郎有限公司),LYOVAC GT2型冷凍干燥機(德國SRK公司),FA2004型分析天平(上海上平儀器有限公司),UV-1800PC紫外-可見分光光度計(上海菁華科學儀器有限公司)。
氯仿、磷酸、無水乙醇:分析純,天津市科密歐化學試劑有限公司;2-硫代巴比妥酸(TBA):分析純,國藥集團化學試劑有限公司;脫氧核糖核酸鈉鹽(DNA)、2,2’-偶氮二異丁基脒二鹽酸鹽(AAPH):標準品,ACROS ORGANICS公司;還原型谷胱甘肽(GSH)、四氯氫醌(TCHQ):分析純,上海源葉生物科技有限公司;三氯乙酸(TCA)、乙二胺四乙酸二鈉(EDTA)、正丁醇、二甲基亞砜(DMSO):分析純,上海達瑞精細化學品有限公司;2,2’-偶氮-雙-(3-乙基苯并噁唑啉-6-磺酸)二銨鹽自由基(ABTS·+)、二苯苦味酰肼自由基(DPPH·)、2,6-二叔丁基-(3,5-二叔丁基-4-氧代-2,5-環己二烯)-對-甲苯氧自由基(Galvinoxyl·):標準品,美國Sigma-Aldrich公司。
1.2 試驗方法
1.2.1 藍莓果渣多糖的提取 參考文獻[18]的方法:藍莓果渣經無水乙醇脫脂2 h后,于55°C烘箱干燥72 h,粉碎過60目篩,得藍莓果渣干粉。稱取2.00 g藍莓果渣干粉,加一定體積蒸餾水,在一定溫度下提取一定時間,提取兩次,提取液4000 r/min離心10 min,上清液即為藍莓果渣多糖溶液。
1.2.2 標準曲線繪制及多糖得率測定 配制40 μg/mL的葡萄糖工作液。分別吸取0.2、0.4、0.6、0.8、1.0 mL工作液于10 mL試管,用蒸餾水補至1 mL,分別加1 mL 5%苯酚溶液和3 mL硫酸,搖晃均勻,冷至室溫后在波長490 nm處測定吸光度。以葡萄糖質量濃度為橫坐標,吸光度為縱坐標,制得標準曲線A=0.0138x+0.2452,R2=0.9990。式中:A為吸光值;x為濃度,μg/mL。取適量藍莓果渣多糖溶液,按下述公式計算多糖得率:
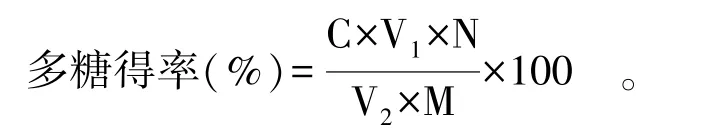
式中:C為稀釋后多糖濃度,μg/mL;V1為多糖提取液體積,mL;V2為測試的樣品體積,mL;N為稀釋倍數;M為藍莓果渣干粉質量,μg。
1.2.3 單因素試驗 稱取2.00 g藍莓果渣干粉,固定提取2次,提取時間5 h,提取溫度70℃,考察不同液料比(30、40、50、60、70 mL/g)對藍莓果渣多糖得率的影響。
稱取2.00 g藍莓果渣干粉,固定提取2次,提取時間5 h,液料比60 mL/g,考察不同提取溫度(50、60、70、80、90℃)對藍莓果渣多糖得率的影響。
稱取2.00 g藍莓果渣干粉,固定提取2次,提取溫度70℃,液料比60 mL/g,考察不同提取時間(2、3、4、5、6 h)對藍莓果渣多糖得率的影響。
1.2.4 響應面試驗 在單因素試驗基礎上,采用Design Expert 8.0.6軟件設計響應面優化試驗,以藍莓果渣多糖得率為響應值Y,以液料比(A)、提取溫度(B)和提取時間(C)為變量因子,因子編碼和水平見表1。

表1 響應面試驗設計因子和水平
1.2.5 藍莓果渣粗多糖的純化 藍莓果渣多糖溶液濃縮至原體積1/5,加無水乙醇至乙醇體積分數為75%,4℃冰箱過夜,4000 r/min離心后取沉淀物凍干得藍莓果渣粗多糖。采用文獻[19]的方法對藍莓果渣粗多糖進行脫蛋白、脫色和透析等操作后得藍莓果渣精多糖。
1.2.6 抗氧化活性測試 采用文獻[20]的方法對藍莓果渣粗多糖和精多糖進行抑制AAPH、GS·和HO·引發的DNA氧化反應測試。多糖濃度為6 mg/mL。
1.2.7 淬滅自由基性能測試 分別配制1、2、3、4、5、6 mg/mL的多糖溶液,VC為陽性對照。ABTS·+清除試驗根據文獻[21]的方法進行,DPPH·清除試驗根據文獻[22]的方法進行,Galvinoxyl·清除試驗參考文獻[23]的方法稍加修改。
1.3 數據處理與統計分析
試驗均設3次平行。用Design-Expert 8.0.6軟件進行多糖提取工藝優化,用Origin 2018軟件進行數據處理和繪圖。顯著性檢驗方法為Duncan’s多重比較,顯著水平為5%。
2 結果與分析
2.1 單因素試驗結果
2.1.1 液料比對藍莓果渣多糖得率的影響 增加溶劑能夠提高液料間的多糖濃度梯度差,導致液相傳質動力變大,有利于多糖的溶出[24]。從圖1可知,當液料比從30 mL/g增加到50 mL/g時,藍莓果渣多糖得率顯著增加,在液料比60 mL/g時達到最大值1.93%。但繼續提升液料比,藍莓果渣多糖得率有所降低,這可能是因為溶劑過多時溶出較多雜質,從而影響多糖的溶出[25]。另外,液料比過大會浪費溶劑且不利于回收。因此選擇液料比60 mL/g為響應面試驗的中心值。
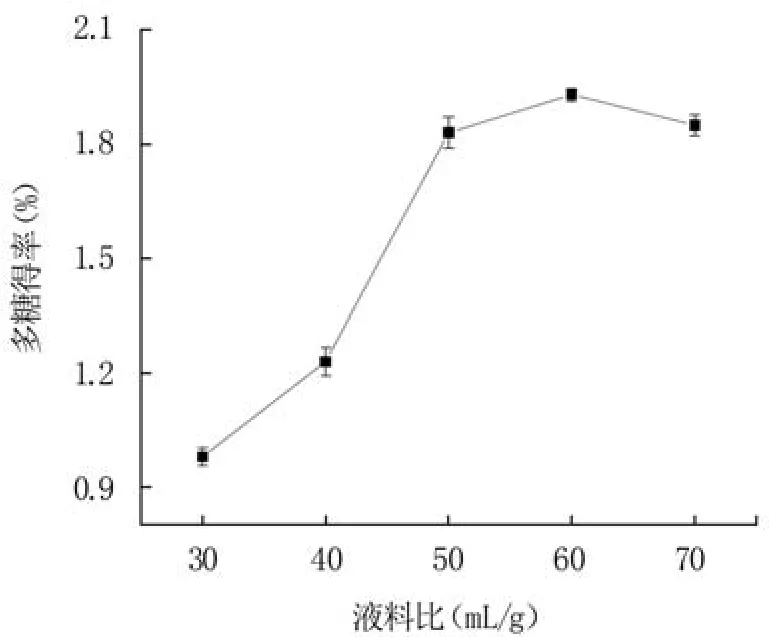
圖1 液料比對藍莓果渣多糖得率的影響
2.1.2 提取溫度對藍莓果渣多糖得率的影響 從圖2可知,隨提取溫度的升高,藍莓果渣多糖得率先升高后略有降低。升高溫度有利于細胞破碎,促使多糖溶出[26]。當提取溫度升至80℃時,藍莓果渣多糖得率達到最大值2.23%,繼續升高則有所下降。這可能是因為溫度過高導致部分多糖分解,從而降低多糖得率[27]。因此選擇80℃作為響應面試驗的中心值。
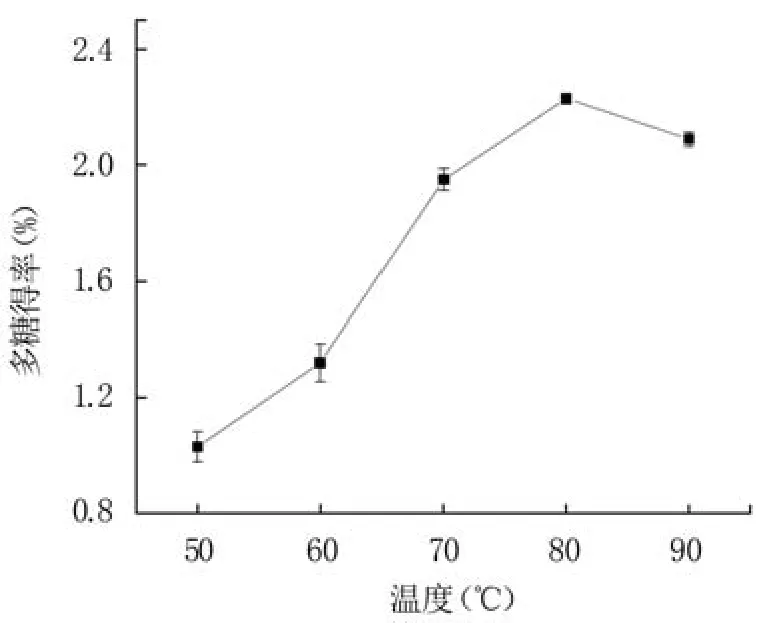
圖2 提取溫度對藍莓果渣多糖得率的影響
2.1.3 提取時間對藍莓果渣多糖得率的影響 從圖3可看出,隨提取時間的延長,藍莓果渣多糖得率呈現先迅速上升而后趨于穩定的趨勢。提取時間從2 h增加到4 h,藍莓果渣多糖得率顯著增加,提取時間為5 h時達到最大值2.13%,而繼續延長提取時間可能導致多糖降解或雜質溶出,影響多糖得率[27]。因此,選擇5 h作為響應面試驗的中心值。
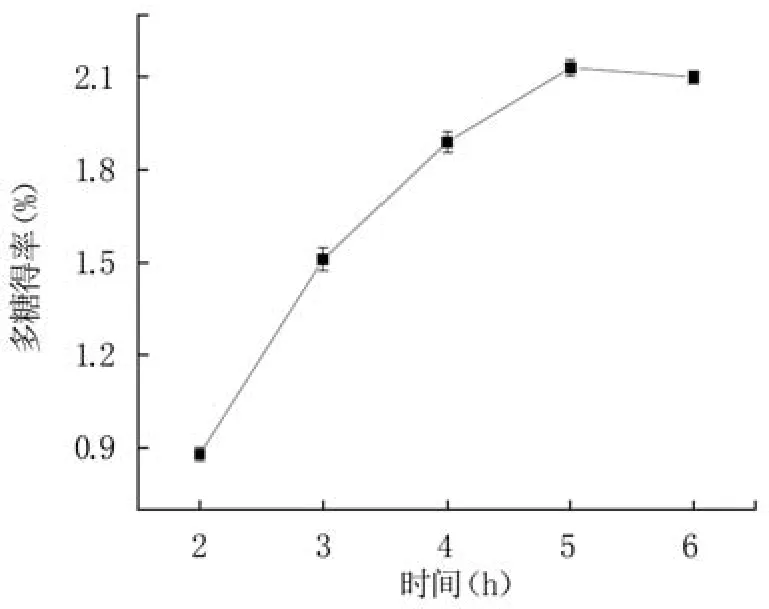
圖3 提取時間對藍莓果渣多糖得率的影響
2.2 響應面試驗結果
2.2.1 Box-Behnken試驗設計及結果 根據單因素試驗結果進行3因素3水平的響應面試驗,結果見表2。
通過軟件Design-Expert 8.0.6對表2數據進行方差分析,結果見表3。經分析,3因素擬合得到的回歸方程為:Y=2.326-0.0125A+0.02375B+0.08125C-0.065AB-0.07AC-0.0725BC-0.18425A2-0.21675B2-0.14175C2。模型P<0.01,表明該模型極顯著,試驗可靠。模型決定系數R2=0.9135,擬合度較高,表明該模型與實際試驗的擬合程度較好,說明上述回歸方程可用于藍莓果渣多糖提取的分析與優化。由F值可知,各因素對藍莓果渣多糖得率的影響大小順序為提取時間>提取溫度>液料比。
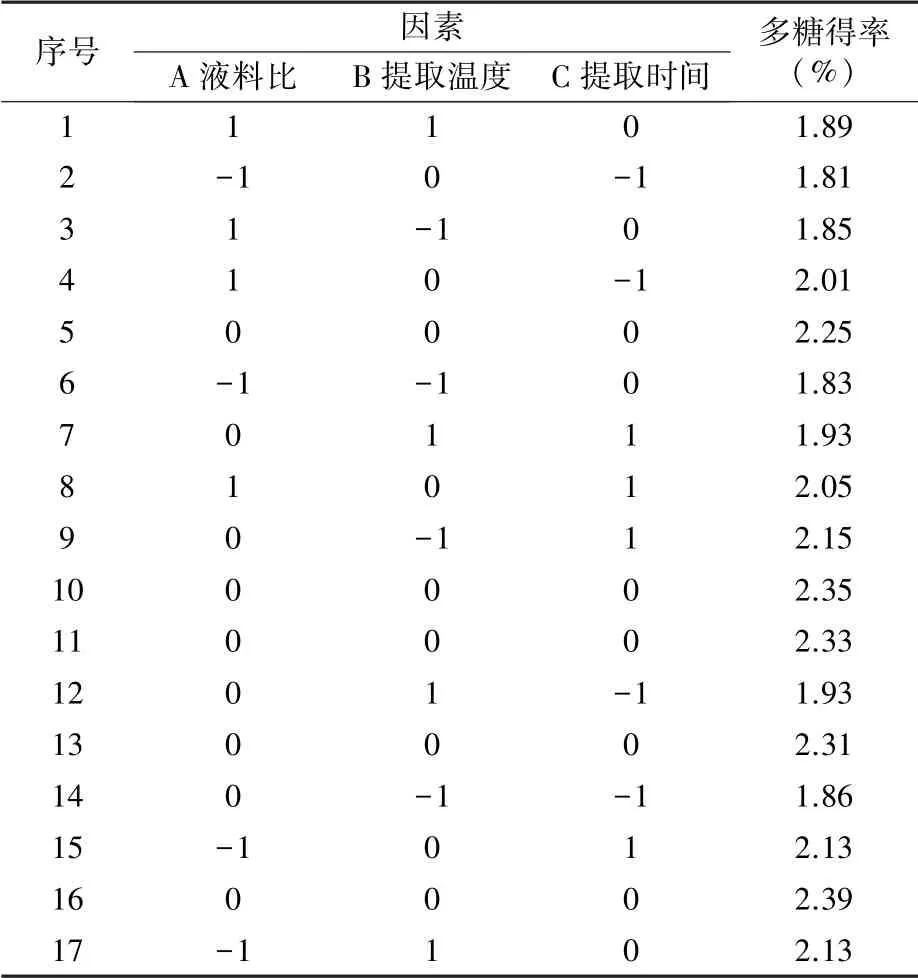
表2 響應面試驗設計及結果
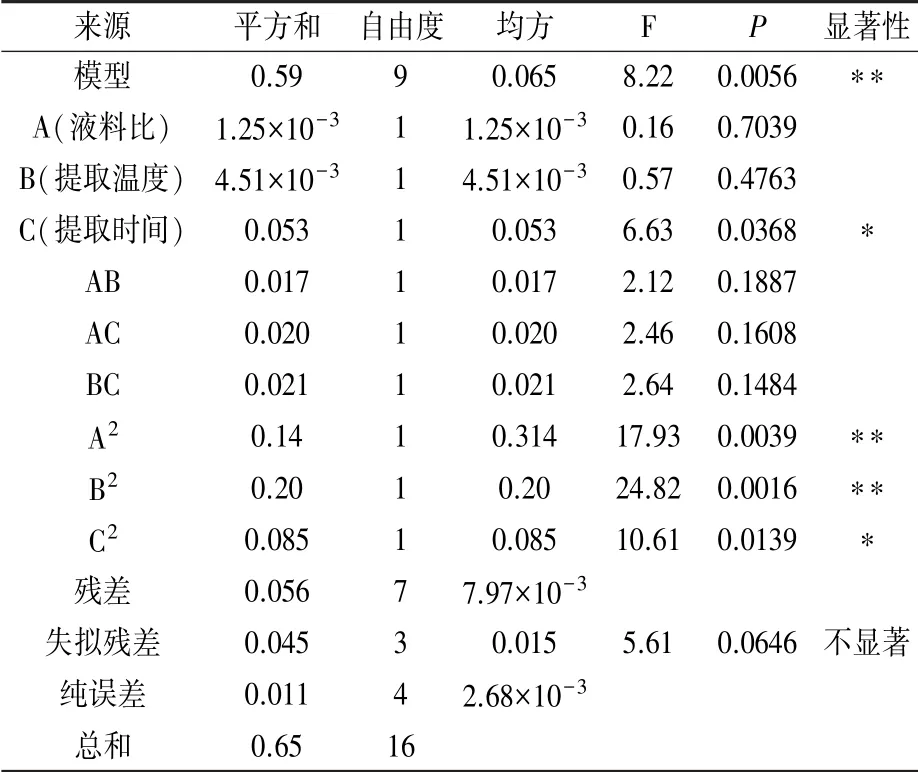
表3 回歸系數的顯著性分析
2.2.2 因素間交互作用結果 響應面圖和等高線圖反映了液料比、提取溫度和提取時間兩兩交互作用對響應值的影響。響應面曲面越陡峭、等高線圖越接近橢圓,說明兩因素間交互作用越強,反之越弱。由圖4(A)可知,當提取時間固定時,液料比與提取溫度的交互曲面較為陡峭,而等高線近似圓形,表現為不顯著;由圖4(B)和圖4(C)可知,提取溫度與提取時間、液料比與提取時間兩組交互作用的曲面均較為平緩,等高線均近似圓形,交互作用也并不顯著。同時,影響多糖得率最顯著的因素是提取時間,表現為其響應面的弧度最大,其次為提取溫度和液料比,與表3結果一致。優化得到的最佳提取工藝為:液料比59.04 mL/g、提取溫度80.18℃、提取時間5.30 h,在此條件下藍莓果渣多糖得率為2.34%。
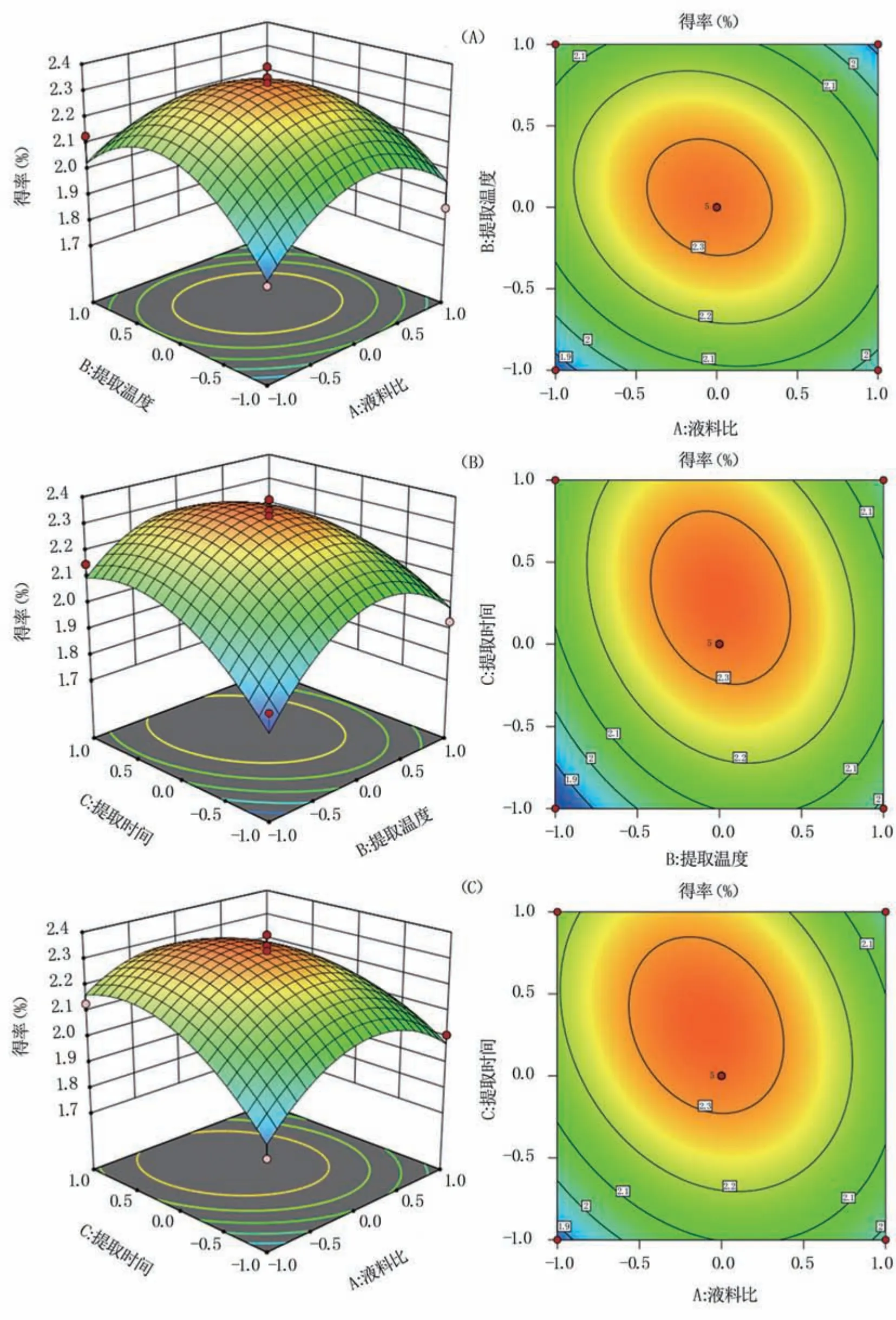
圖4 各因素交互作用響應曲面和等高線圖
2.2.3 驗證試驗 根據2.2.2所得結論,選取液料比59 mL/g、提取溫度80℃、提取時間5.30 h,進行3組重復試驗,所得多糖提取率平均值為2.33%,與2.2.2節所得理論值基本吻合,進一步說明該回歸方程能夠較真實反映各因素對多糖得率的影響。
2.3 抗氧化活性測試
2.3.1 抑制AAPH氧化DNA結果分析 在AAPH氧化DNA體系中,以加0.1 mL蒸餾水為空白組,加0.1 mL多糖溶液為測試組,測得的TBARS吸光度值分別為A空白和A多糖。空白組TBARS百分數為100%,多糖抗氧化能力可采用相對于空白組吸光度值的百分數(TBARS百分數)進行衡量[28],TBARS百分數計算公式為TBARS百分數(%)=(A多糖/A空白)×100。
如圖5所示,藍莓果渣粗多糖和精多糖的TBARS百分數均低于空白組的100%,說明粗多糖和精多糖均具有抑制AAPH引起DNA氧化的能力。其中,粗多糖的TBARS百分數為90.38%,低于精多糖的94.97%,說明粗多糖的抑制能力較精多糖強。這表明,藍莓果渣粗多糖經純化后其抑制AAPH引起DNA氧化的能力降低。
2.3.2 抑制GS·氧化DNA結果分析 參考2.3.1中的方法求得多糖抑制GS·氧化DNA的TBARS百分數。如圖5所示,粗多糖和精多糖的TBARS百分數分別為87.48%和91.41%,均小于空白的100%,說明兩者均可抑制GS·氧化DNA,且粗多糖的抑制能力更強,強于文獻報道的水溶性維生素E(TBARS百分數為88.30%)[29]。這一結果與2.3.1中的結論一致,同樣說明純化過程降低了多糖的抗氧化性能。另外,粗多糖和精多糖抑制GS·氧化DNA的TBARS百分數均低于相應抑制AAPH氧化DNA的體系,說明兩者抑制GS·引起DNA氧化的能力更強。
2.3.3 抑制HO·氧化DNA結果分析 參考2.3.1中的方法求得藍莓果渣多糖TBARS百分數。如圖5所示,粗多糖的TBARS百分數為94.36%,小于精多糖的TBARS百分數(97.70%),但均低于空白的100%,表明粗多糖和精多糖均能夠抑制HO·氧化DNA,具有抗氧化的性能,粗多糖抗氧化能力大于精多糖。而且兩者的TBARS百分數均高于相應抑制AAPH和GS·氧化DNA體系,說明其抑制HO·氧化DNA的能力弱于上述兩種體系。
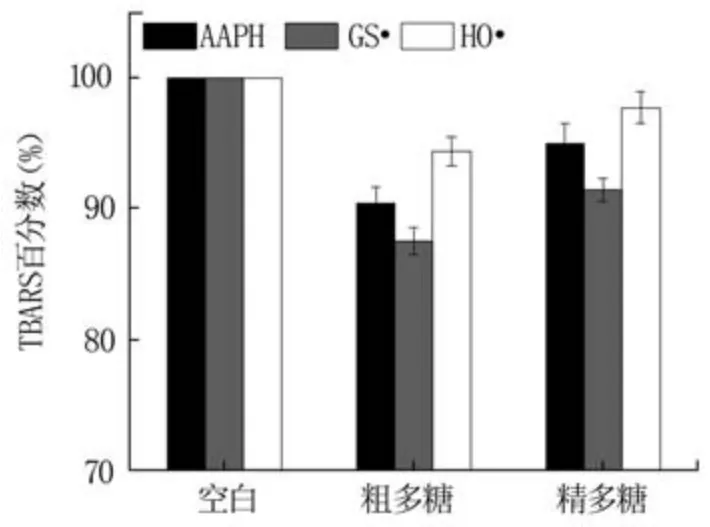
圖5 藍莓果渣多糖抑制AAPH、GS·和HO·引發DNA氧化反應的TBARS百分數
2.4 抑制清除自由基性能
2.4.1 清除ABTS·+性能分析 ABTS被氧化成ABTS·+后其顏色變為藍綠色,當抗氧化劑與其孤對電子配對后變為無色,因此可通過顏色變化來評估清除ABTS·+能力。由圖6可知,粗多糖和精多糖均具有清除ABTS·+的能力,且隨著濃度的增加,其清除能力明顯增強,表明兩者的質量濃度與ABTS·+清除率呈量效關系。在多糖濃度為6 mg/mL時,粗多糖和精多糖的ABTS·+清除率分別為68.85%和54.42%,說明粗多糖的清除能力明顯強于精多糖,但與VC相比仍有差距。
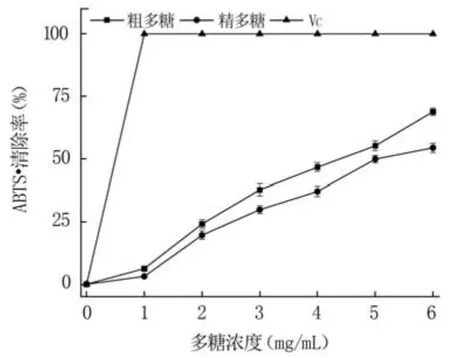
圖6 多糖的ABTS·+清除率
2.4.2 清除DPPH·性能分析 由圖7可知,粗多糖和精多糖均能夠清除DPPH·,且隨著多糖濃度的增加,DPPH·清除率逐漸增大,粗多糖的DPPH·清除率始終大于精多糖。在多糖濃度為6 mg/mL時,粗多糖和精多糖的DPPH·清除率分別為23.53%和16.87%,但均明顯低于VC,說明純化過程降低了藍莓果渣多糖清除DPPH·的能力。
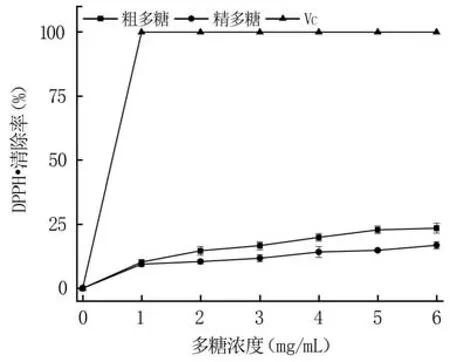
圖7 多糖的DPPH·清除率
2.4.3 清除Galvinoxyl·性能分析 Galvinoxyl·是一種C-中心自由基,在乙醇溶液中顯淡黃色,最大吸收波長為428 nm。如圖8所示,隨著多糖濃度的增加,粗多糖和精多糖的Galvinoxyl·清除率增加趨勢較弱,在多糖濃度為6 mg/mL時,兩者的Galvinoxyl·清除率分別為13.39%和11.58%,粗多糖清除率略高于精多糖,但明顯低于VC。
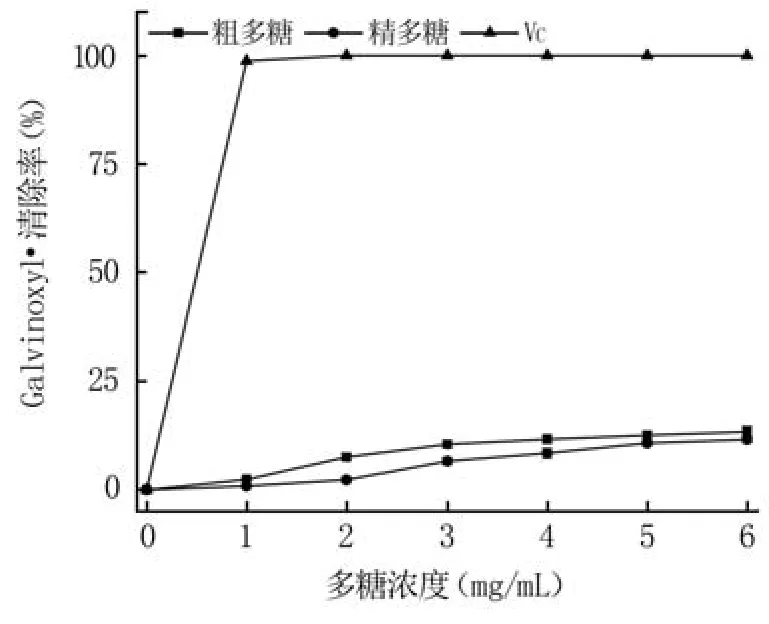
圖8 多糖的Galvinoxyl·清除率
3 討論與結論
3.1 藍莓果渣多糖提取工藝優化
單因素試驗表明提取時間和提取溫度都不宜過高,超過閾值會破壞多糖結構導致得率降低,與魏增云等[27]的研究結果一致;隨液料比的增大,多糖得率呈先增加后降低的趨勢,在液料比為60 mL/g時多糖得率最大。這是因為液料比較小時多糖不能充分溶出,而液料比過大時雜質會逐漸溶出,不僅影響多糖的溶出速率,而且降低了多糖純度。進一步采用響應面優化試驗研究提取溫度、時間和液料比對藍莓果渣多糖得率的影響,結果表明,提取時間對多糖得率的影響最大,提取溫度次之,液料比影響最小;各因素之間交互作用并不顯著。綜上,藍莓果渣多糖的最佳提取工藝為液料比59 mL/g、提取溫度80℃、提取時間5.30 h,在此條件下多糖得率為2.33%。朱金艷等[18]通過正交試驗得出藍莓果渣多糖提取參數為:液料比60 mL/g、溫度90℃、時間4 h,藍莓果渣多糖得率為2.108%。與之相比,本試驗的提取溫度更低、節省能源且易于控制,多糖得率也有所增加,具有一定的工業應用前景。
3.2 藍莓果渣多糖抗氧化性能評價
6個抗氧化體系研究結果顯示,粗多糖和精多糖均能有效抑制自由基、氧化DNA和清除自由基且粗多糖的抗氧化能力優于精多糖。這與陳琳等[30]的研究結果一致,其原因可能是粗多糖在純化過程中,某些非糖的抗氧化物質被除去,而這類物質的抗氧化性能遠高于多糖。再如,楊燕敏[31]對哈密大棗多糖提取時,發現粗多糖的多酚類物質未完全除去,導致其ABTS·+清除率高于精多糖。龔雯等[32]研究發現,金花茶多糖的結構不同也會影響多糖的抗氧化能力,β-吡喃糖構型的金花茶多糖HO·清除率與VC相似,因此,純化前后藍莓果渣多糖抗氧化能力的改變也可能是因為多糖的結構發生了改變。但另有研究表明,粗多糖經純化后,抗氧化能力增強,這可能是因為粗多糖經純化后多糖含量提升而導致自由基清除能力增強。綜上,多糖的抗氧化能力與多種因素有關,如多糖的純度、結構、單糖組成等[33,34],而有關藍莓果渣多糖純化前后抗氧化性能的構效關系有待進一步研究。
綜上,本研究結果可為藍莓果渣的合理利用提供理論參考,另外有關純化前后粗多糖和精多糖的結構、單糖組成及其與抗氧化性能之間的關系有待進一步研究。

