曲妥珠單抗聯合FLOT方案圍手術期治療可手術HER-2陽性進展期胃癌的療效和安全性
候玉龍
(佳木斯市中心醫院腫瘤外一科,黑龍江 佳木斯 154002)
胃癌是發生率、死亡率均較高的一種惡性腫瘤[1]。近年來隨著臨床治療手段的不斷增加,有效提高了疾病治愈率,但是進展期胃癌的預后較差。在進展期胃癌患者根治性治療中,手術是重要手段,但術后的轉移、復發風險較高,遠期生存率并不高[2]。圍手術期化療對于人表皮生長因子受體-2(HER-2)陽性進展期胃癌患者預后的改善具有重要作用,但不同化療方案所取得療效存在差異[3],另外化療藥物聯合靶向藥物能夠進一步提升療效,故本文就FLOT方案聯合曲妥珠單抗應用在可手術HER-2陽性進展期胃癌患者圍手術期中的效果進行分析,以SOX方案為對照,旨在為臨床選擇更加理想的治療方案提供參考。
1 資料與方法
1.1一般資料:選取2018年6月~2021年6月本院收治可手術HER-2陽性進展期胃癌患者92例為研究對象,隨機分為對照組與觀察組各46例。對照組:男30例,女16例;年齡42~70歲,平均(56.54±4.71)歲。腫瘤原發部位:胃竇26例,胃底7例,胃體9例,全胃4例。病理鑒別:高分化12例,中度分化15例,分化差或未分化19例。臨床分期:Ⅱ期11例,Ⅲa期10例,Ⅲb期22例,Ⅲc期3例。HER-2狀態:免疫組化(2+)和熒光原位雜交技術檢測(+)10例,免疫組化(3+)36例。觀察組:男28例,女18例;年齡44~71歲,平均(56.65±4.80)歲。腫瘤原發部位:胃竇25例,胃底8例,胃體8例,全胃5例。病理鑒別:高分化11例,中度分化14例,分化差或未分化21例。臨床分期:Ⅱ期10例,Ⅲa期11例,Ⅲb期21例,Ⅲc期4例。HER-2狀態:免疫組化(2+)和熒光原位雜交技術檢測(+)9例,免疫組化(3+)37例。兩組一般資料比較,差異無統計學意義(P>0.05)。具有可比性。
納入標準:①經胃鏡病理學檢查確診為胃腺癌,經免疫組化、熒光原位雜交技術檢測顯示HER-2陽性;②影像學檢查證實為進展期,未發現遠處轉移,且病灶可測量;③預計生存期超過3個月者;④入組前未接受過放化療者;⑤無手術禁忌證者。
排除標準:①血常規異常或肝、腎等臟器功能障礙者;②既往存在心肌梗死、充血性心力衰竭病史者;③存在消化道大出血、胃腸梗阻或穿孔等嚴重并發癥者;④左心室射血分數低于50%者;⑤因嚴重不良反應而退出此次研究者。
1.2方法:對照組:采用SOX方案。第1天,將奧沙利鉑注射液130 mg/m2溶入濃度為5%的葡萄糖溶液500 ml中,在3 h內完成靜脈滴注,1次/d。第1~14天,替吉奧膠囊2片/次,口服,2次/d。一個周期為21 d,在術前、術后各治療3個周期。
觀察組:采用曲妥珠單抗聯合FLOT方案。第1天,多西他賽注射液50 mg/m2、奧沙利鉑注射液85 mg/m2、注射用亞葉酸鈣200 mg/m2、5-氟尿嘧啶注射液2 600 mg/m2持續泵入,1次/d,靜脈滴注2 h/次,第2周重復用藥,2 w為1個周期,術前、術后均治療4個周期。第1天,首次靜脈滴注曲妥珠單抗8 mg/kg,1次/d,后續給藥劑量為6 mg/kg,3 w為1個周期,術前、術后各治療3個周期。
兩組在治療期間若經影像學檢查顯示腫瘤增大,可進行手術治療,圍術期3 w進行化療。根據腫瘤部位選擇近遠端或全胃切除術聯合D2清掃術。按照病理結果選擇后續治療方案,如療效為完全緩解、部分緩解或穩定患者,采用原方案治療,若是疾病進展,則采用mFOLFOX6方案治療3個月,結合患者耐受情況調整化療藥物劑量。
1.3評價指標及判定標準:①抽取兩組患者治療前、治療后的空腹靜脈血10 ml。其中5 ml血液樣本進行離心處理,速率為3 000 r/min,離心時間為10 min,取上層血清,應用全自動生化分析儀、電化學發光法測定血清癌胚抗原(CEA)、糖類抗原199(CA199);應用酶聯免疫吸附法測定單核細胞趨化因子-1(MCP-1)、血管內皮生長因子(VEGF)、趨化因子受體-4(CXCR4)、基質衍生因子-1(SDF-1)、骨髓相關蛋白-14(MRP-14)、纖維母細胞特異性蛋白-1(FSP-1)。另外5 ml血液樣本應用流式細胞儀對T淋巴細胞進行測定。②根據實體瘤的療效評價標準(RECIST 1.0)評估兩組的近期療效,具體標準:病灶消失且持續4 w以上為完全緩解;病灶最長徑之和減少超過30%為部分緩解;病灶最長徑之和變化≤20%即為疾病穩定;病灶最長徑之和增加超過20%,出現新病灶,即為疾病進展。療效控制率=(完全緩解例數+部分緩解例數+疾病穩定例數)/總例數×100%。③觀察兩組患者治療期間的藥物不良反應發生情況。④應用PCR-直接測序法測量兩組患者治療前、治療后外周血中的基因突變情況,計算P53、EGFR表達陽性率。⑤應用癌癥患者生活質量評分量表(FACT-G v4.0)評估兩組患者治療前、治療后的生存質量,共計4個領域27個條目,每個條目分值范圍為0~4分,總分為108分,分值越低,則生存質量越差。
1.4統計學處理:采用SPSS25.0統計學軟件進行t檢驗與χ2檢驗。
2 結果
2.1兩組腫瘤標志物水平比較:兩組患者治療前的血清腫瘤標志物水平比較,差異無統計學意義(P>0.05);兩組患者組內治療前后、組間治療后的血清腫瘤標志物水平比較,差異有統計學意義(P<0.05)。見表1。

表1 兩組腫瘤標志物水平比較
2.2兩組T淋巴細胞水平比較:治療前,兩組T淋巴細胞水平比較,差異無統計學意義(P>0.05);治療后,觀察組T淋巴細胞水平與對照組比較,差異有統計學意義(P<0.05)。見表2。

表2 兩組T淋巴細胞水平比較
2.3兩組近期療效比較:與對照組比較,觀察組的疾病控制率更高,差異有統計學意義(P<0.05)。見表3。

表3 兩組近期療效比較[n(%),n=46]
2.4兩組不良反應發生情況比較:兩組不良反應分級主要為Ⅰ級~Ⅱ級,觀察組的不良反應發生率顯著低于對照組,差異有統計學意義(P<0.05)。見表4。

表4 兩組不良反應發生情況比較[n(%),n=46]
2.5兩組P53、EGFR表達陽性率比較:兩組患者治療前的P53、EGFR表達陽性率比較差異無統計學意義(P>0.05);治療后,兩組患者的P53、EGFR表達陽性率均低于治療前,且觀察組低于對照組,差異有統計學意義(P<0.05)。見表5。

表5 兩組P53、EGFR表達陽性率比較[n(%),n=46]
2.6兩組生存質量評分比較:治療前,兩組生存質量評分比較,差異無統計學意義(P>0.05);治療后,兩組生存質量評分均較治療前增高,差異有統計學意義(P<0.05),且觀察組更高,差異有統計學意義(P<0.05)。見表6。
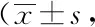
表6 兩組生存質量評分比較分,n=46)
3 討論
進展期胃癌在胃癌患者中占80%左右[4]。手術治療該疾病的5年生存率為30%左右。HER-2在健康人體內的少量表達,在機體組織出現癌變時會出現異常高表達狀態[5],會促使癌細胞增殖過快,增加侵襲性,還會加重腫瘤惡性程度,促使腫瘤細胞對化療藥物的敏感性下降,對療效、預后產生不利影響[6-7]。
臨床在HER-2陽性進展期胃癌患者圍術期應用SOX方案雖然能夠在一定程度上對癌細胞浸潤、生長、轉移進行抑制[8-9],但是疾病控制率并不理想。FLOT方案中通過多西他賽、奧沙利鉑、亞葉酸鈣、5-氟尿嘧啶可起到較好的抗腫瘤作用,但是不良反應較大,部分患者難以耐受,會導致治療依從性、臨床療效下降。靶向治療可使腫瘤細胞特異性死亡,不會損傷正常組織細胞,同化療相比具有特異性抗腫瘤作用、不良反應少等特點[10-11]。
此次研究中,治療后,觀察組的腫瘤標志物水平、T淋巴細胞水平均更優,疾病控制率更高,不良反應少、P53、EGFR表達陽性率更低,生存質量評分更高,充分表明了FLOT方案聯合曲妥珠單抗的效果顯著。曲妥珠單抗作為一種靶向治療藥物,能對HER-2介導的生物學功能進行拮抗[12],對細胞周期進展以及HER-2的轉錄、表達進行抑制,阻止血管生成,從而可提升化療效果。同時曲妥珠單抗能夠抑制HER-2、P53、EGFR的異常表達水平,對腫瘤細胞增殖活性進行抑制,減少腫瘤局部新生血管的形成[13-14],促使癌細胞凋亡,有利于增強免疫球蛋白的抗腫瘤活性,因此與FLOT方案聯用能夠減少對免疫功能影響的同時更好地提升抗腫瘤效果,減輕化療藥物的不良反應,提升患者的生存質量。同時根據血清腫瘤標志物水平的變化可判斷該病患者的病程進展、療效[15],有助于后續治療方案的調整,以更好地改善預后。
綜上所述,曲妥珠單抗與FLOT方案聯合應用在可手術HER-2陽性進展期胃癌患者中具有較高的有效性和安全性。

