左旋氨氯地平拆分技術研究進展
趙明蕊 劉 陽 閆青青 羅明錦 郭亭玉 施秀芳
1.河南醫(yī)學高等專科學校藥學系,河南 鄭州 451191;2.鄭州大學藥學院,河南 鄭州 450000
氨氯地平(amlodipine)是第三代鈣離子通道拮抗劑,化學名為6-甲基-2-(2-氨基乙氧基)甲基-4-(2- 氯苯基)-1,4- 二氫-3,5- 吡啶二甲酸甲乙酯,是美國Pfizer 公司于20 世紀80 年代研制上市的藥物,商品名為絡活喜,臨床上主要用于治療高血壓、心絞痛等[1]。與其他鈣通道拮抗劑相比,氨氯地平生物利用度高,起效緩慢,且作用持續(xù)時間長[2],是臨床上治療高血壓的一線藥物,約占15.78%的市場份額。由于溶解度問題,目前市場上的氨氯地平原料藥主要以苯磺酸氨氯地平、馬來酸氨氯地平、甲磺酸氨氯地平等消旋體和手性化合物苯磺酸左旋氨氯地平等形式存在。
1 左旋氨氯地平的構型確定
氨氯地平屬于二氫吡啶(1,4-Dihydropyridines,1,4-DHPs)化合物,該類化合物最早由德國化學家亞瑟·魯?shù)婪颉ろn奇(Arthur Rudolf Hantzsch)在1881 年研發(fā),但直到1975 年,第一個二氫吡啶類藥物硝苯地平片(商品名:心痛定)藥物才在德國拜耳公司問世,1985 年尼莫地平片(商品名:尼膜同)上市。氨氯地平是在尼莫地平的基礎上開發(fā)出來的手性藥物[2]。由于二氫吡啶環(huán)4 位連接了2’-氯苯基,2、3、5、6 位為不同的基團取代,由于氯原子的阻轉效應,造成分子的不對稱性,4-位碳成為手性中心,可產(chǎn)生一對對映體,即左旋氨氯地平和右旋氨氯地平。見圖1。
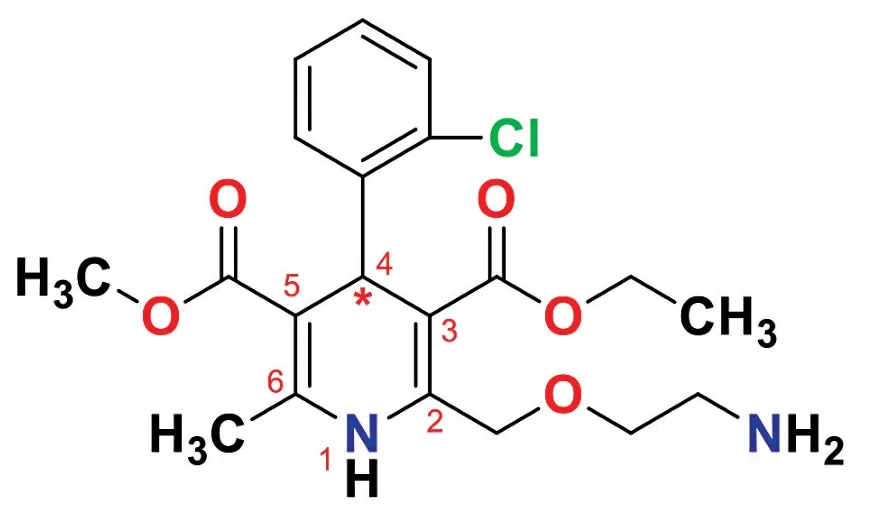
圖1 氨氯地平分子結構
1986 年,Arrowsmith 等[3]通過動物實驗對手性氨氯地平的鈣離子拮抗性能和藥物代謝進行了評價,發(fā)現(xiàn)左旋氨氯地平比右旋氨氯地平的生物活性高1000 倍。但是其認為活性好的左旋氨氯地平是R 構型,與1989 年輝瑞公司專利EP0331315A2 中氨氯地平疊氮酸辛可尼丁中間體的拆分以及1991 年拜爾公司對手性氨氯地平構型的指認均錯誤[4]。直到1992 年,拜爾公司的Goldmann 等[5]用(1S)-(-)-樟腦酸對氨氯地平進行了拆分,通過形成的氨氯地平樟腦酸的非對映異構體的單晶結構,最終確認具有較高藥理活性的左旋氨氯地平為S-構型。另外,4-取代苯基二氫吡啶骨架是地平類化合物的結構特征,研究發(fā)現(xiàn)二氫吡啶呈假船式構象,4-苯基以直立鍵占據(jù)船頭,2’位氯原子的阻轉效應迫使苯環(huán)平面與二氫吡啶船面呈垂直態(tài)排布,構成穩(wěn)定的構型(圖2)。郭棟[6]通過研究尼莫地平及氨氯地平的集成手性廣譜,將其絕對構型與ECD 光譜關聯(lián),初步建立了手性1,4-DHPs 鈣通道阻滯劑的絕對構型關聯(lián)的通用規(guī)則。
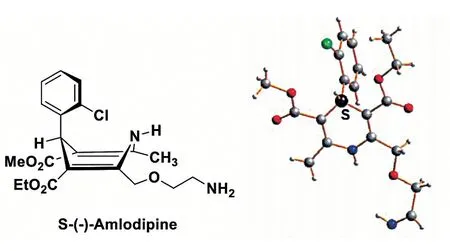
圖2 S-(-)-Amlodipine 的構象及晶體結構(晶胞圖[6])
美國Sepracor 公司1993 年發(fā)布的專利WO9310779[7]揭示左旋氨氯地平可以避免頭痛頭暈、肢端水腫、面部潮紅等副作用,并證明了氨氯地平的副作用來自其右旋體。美國輝瑞公司1995 年發(fā)表了用手性酒石酸拆分消旋氨氯地平的專利US5750707[8]中指出:S-(-)- 氨氯地平是比R-(+)氨氯地平更有效的鈣通道阻滯劑,而后者可用于防治動脈粥樣硬化。
氨氯地平問世以來,臨床療效顯著。但我國中科院長春應用化學研究所張喜田研究員通過六年多反復實驗,用六氘代二甲基亞砜(DMSO-d6)取代二甲基亞砜(dimethyl sulfoxide,DMSO)拆分得到光學純度更高的苯磺酸左旋氨氯地平(US6646131)[9],1999 年由吉林省施慧達藥業(yè)集團上市,商品名為施慧達,開創(chuàng)了我國化學方法拆分得到光學純手性藥物的先河,也是世界首例經(jīng)手性拆分獲得的抗高血壓藥物。
2 氨氯地平拆分方法的研究進展
對 于 含 有4- 芳 基-1,4- 二 氫 吡 啶(1,4-DHPs)骨架的大多數(shù)地平類化合物來講,由于其化合物大都呈中性,很難利用酸性(或堿性)拆分劑對其進行化學拆分,但是考慮到地平類結構中3、5 位的酯基,一般利用其中間體的酸性,選擇堿性拆分劑進行化學拆分。但由于氨氯地平是帶有氨基的堿性化合物,現(xiàn)在一般采用酸性拆分劑進行拆分。
2.1 化學拆分法
化學拆分的原理是利用形成的非對映體溶解度的不同,通過分步結晶來進行分離,從而得到所需的光活性物質。化學拆分法成功的關鍵是選擇合適的拆分劑,使生成的非對映體溶解度差別較大。目前已報道可用于氨氯地平的拆分劑有 2- 甲氧基-2- 苯乙醇、樟腦酸、疊氮酸辛可尼定鹽、扁桃酸、[ 二-(S)- 扁桃酸]-3- 硝基鄰苯二甲酸酯、酒石酸、O,O’- 二苯甲酰基酒石酸等,其中輝瑞公司采用L-(+)-酒石酸或D-(-)-酒石酸作為拆分劑,以DMSO 作為手性助劑,可分別得到R 和S 構型的光學純氨氯地平。但是要得到S-氨氯地平需要用到價格昂貴的非天然D-酒石酸(圖3)[8]。

圖3 輝瑞公司開發(fā)的氨氯地平拆分方法
為了克服D- 酒石酸的成本問題,印度Emcure 公司將溶劑DMSO 換為二甲基甲酰胺(dimethylformamide,DMF)-水的混合溶劑,開發(fā)了一種廉價便捷的溶劑誘導的拆分方法。研發(fā)人員發(fā)現(xiàn)當以DMF 為拆分助劑時,消旋氨氯地平堿中的S-氨氯地平優(yōu)先與L-酒石酸成鹽析出。當調整DMF 中的水百分比為15%時,得到S-氨氯地平光學純度為99%ee,拆分效率為70%(圖4)[10]。把這種在手性拆分劑構型不變的條件下,通過改變結晶溶劑來控制拆分產(chǎn)物構型的方法稱為溶劑誘導的手性開關拆分法。
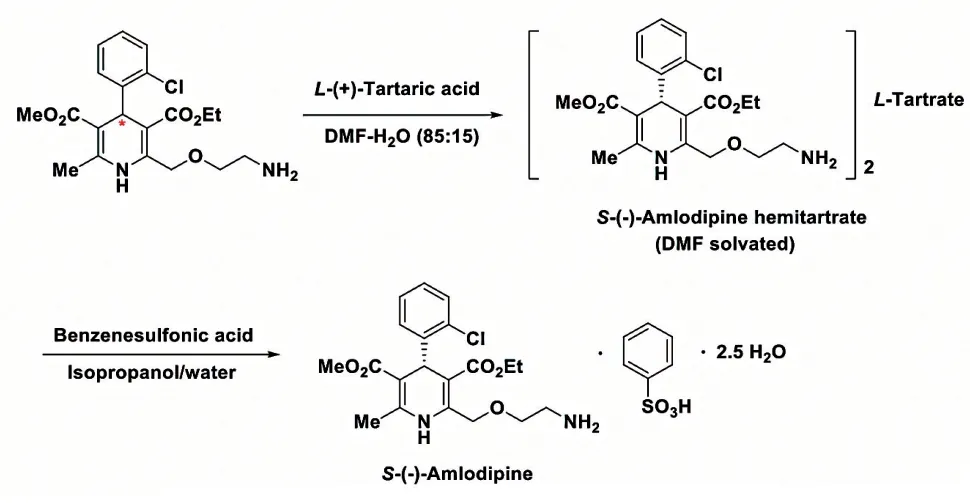
圖4 Emcure 公司開發(fā)的氨氯地平拆分法
最近,B?nhegyi 課題組[11]開發(fā)了一種新型的串聯(lián)拆分方法,將外消旋氨氯地平和0.25 mol 的L-酒石酸溶解在合適的溶劑中,形成的非對映體沉淀分離后將剩余的外消旋部分與0.5 當量的延胡索酸反應,最后得到了光學純的氨氯地平對映體。類似的,0.25 mol 的L-酒石酸加入母液中,可以得到另一對映體(圖5)。另外,研究發(fā)現(xiàn)當加入和溶劑DMSO、DMF、N,N-二甲基丙烯酰胺(N,N-dimethylacrylamide,DMAA)結構類似的非手性試劑(尿素和硫脲)時,可以通過形成共晶化合物而使非對映體分級沉淀而分離。該串聯(lián)拆分方法的優(yōu)點是使用一種拆分劑,通過分步結晶可以得到2 種對映異構體。

圖5 氨氯地平的串聯(lián)拆分
然而,由于化學拆分法拆分過程冗長,且拆分劑和溶劑的選擇是經(jīng)驗性的,所得產(chǎn)品產(chǎn)率不高,常浪費一半的原料,而且拆分得到的產(chǎn)物,對映體過量值常不夠高。還有不少手性有機物,難用化學方法轉變成非對映體[12]。隨著組合拆分技術的發(fā)展,相信會有更多的拆分劑家族被開發(fā)出來。
2.2 毛細管電泳拆分法
毛細管電泳拆分法是以毛細管為分離通道、以高壓直流電場為驅動力的新型液相分離技術。Nojavan等[13]用毛細管電泳拆分法對氨氯地平對映體進行拆分,以麥芽糊精作為手性選擇劑,15℃時,R-氨氯地平的停留時間為31.17 min,S-氨氯地平的停留時間為31.65 min,分離系數(shù)達到1.94。Xu 等[14]采用氨基修飾介孔二氧化硅納顆粒與甲基丙烯酸縮水甘油酯、乙炔二甲基丙烯酸酯原位共聚制備固定相,填充毛細管色譜柱分離氨氯地平,達到基線分離。
2.3 色譜拆分法
色譜作為手性藥物檢測與分離的常用手段,已應用于氨氯地平對映體的拆分。它包括薄層色譜、模擬移動床色譜、高效液相色譜拆分法等。張美等[15]先合成手性金屬- 有機骨架材料[Zn(2 D-Cam)(2 4,4’-bpy)]n(簡 稱 為Zn-MOF),然后取該手性金屬-有機骨架材料Zn-MOF 混合GF254 硅膠制備薄層色譜板,以乙腈-仲丁醇(30 ∶70,V/V)為展開劑,所得斑點大小均一,比移值>0.27,苯磺酸氨氯地平外消旋體實現(xiàn)了有效分離,分離度約為2。楊超等[16-18]采用高效液相色譜法拆分氨氯地平手性對映體,分別確立了氨氯地平對映體的拆分條件。見表1。

表1 色譜法拆分氨氯地平手性對映體的拆分條件
2.4 分子印跡拆分法
分子印跡技術是一種設計、合成對目標分子具有特異選擇性和親和力的人工聚合物,即分子印跡聚合物(molecularly imprinted polymer,MIPs)的技術[19-20]。分子印跡聚合物是一種能夠特異性識別和結合目標分子的物質,最早用于化合物的分離分析、傳感器和模擬酶催化方面,現(xiàn)在手性拆分方面廣泛應用。制備MIPs 主要有兩種方法,一種是可逆共價印跡,另一種是非共價印跡。由于非共價印跡主要靠氫鍵、離子相互作用、范德華力等形成,適用范圍廣,目前已成為合成MIPs 的主要方法(圖6)[21]。Luo等[22]以甲基丙烯酸(MAA)為功能單體,乙二醇二甲基丙烯酸酯被選用為交聯(lián)劑,甲苯為致孔劑,多步沉浸與聚合制備MIP 用于血漿中S-氨氯地平的分離。劉敏[23]利用介孔二氧化硅制得S-苯磺酸氨氯地平溫敏型表面分子印跡微球,以固定化咪唑基L-谷氨酸離子液體為固相手性選擇劑、氨氯地平水溶液為水相、有機溶劑為油相,液-液-固萃取法手性拆分氨氯地平對映體。在優(yōu)化的實驗條件下,得到R-氨氯地平分配系數(shù)為13.65,而S-氨氯地平的分配系數(shù)為8.50,對映體選擇性達到1.61,水相中S-氨氯地平對映體過剩值為32.28%。

圖6 非共價分子印跡機制圖[21]
2.5 手性萃取拆分法
萃取拆分技術是利用手性試劑將外消旋化合物的兩個對映體選擇性地從一個液相萃取到另一個與之不相溶的液相中,且要求兩個互相接觸的液相至少有一相要有旋光性。Lelin 等[24]開發(fā)了一種多相萃取-原位耦合結晶(MPE-CC)的新方法用于制藥廢水中氨氯地平(AD)的富集和對映體分離。以含P507(2-乙基己基膦酸單-2-乙基己基酯)的正庚烷溶液作萃取劑,(D)-酒石酸或(L)-酒石酸的二甲亞砜為手性溶出劑(也作為結晶母液)。在優(yōu)化的萃取條件下重復萃取,提取率高至86.3%,原位生成(S)-氨氯地平(D)酒石酸晶體,得到(S)-氨氯地平晶體的對映體過量值為92.2%,實現(xiàn)了廢水中的外消旋氨氯地平的分離。
Niti 等[25]建立了分離氨氯地平的模型并進行了實驗驗證。結果表明,以中空纖維支撐液膜拆分氨氯地平對映體過程中,手性拆分劑選擇O,O’-二苯甲酰(2S,3S)-酒石酸[(+)-DBTA 絡合],萃取劑選擇含拆分劑的有機溶液,由于毛細作用在中空纖維膜內形成疏水的液膜,使S-氨氯地平以氫鍵與液膜中的手性拆分劑結合,從而實現(xiàn)對映體分離。
Lai 等[26-27]制備了聚偏氟乙烯分子印跡中空纖維復合膜,使用(D)-酒石酸和磺丁基醚-β-環(huán)糊精雙手性添加劑,對苯磺酸氨氯地平進行錯流萃取分離。最佳對映異構體過量值達到了17.84%。分離原理見圖7。
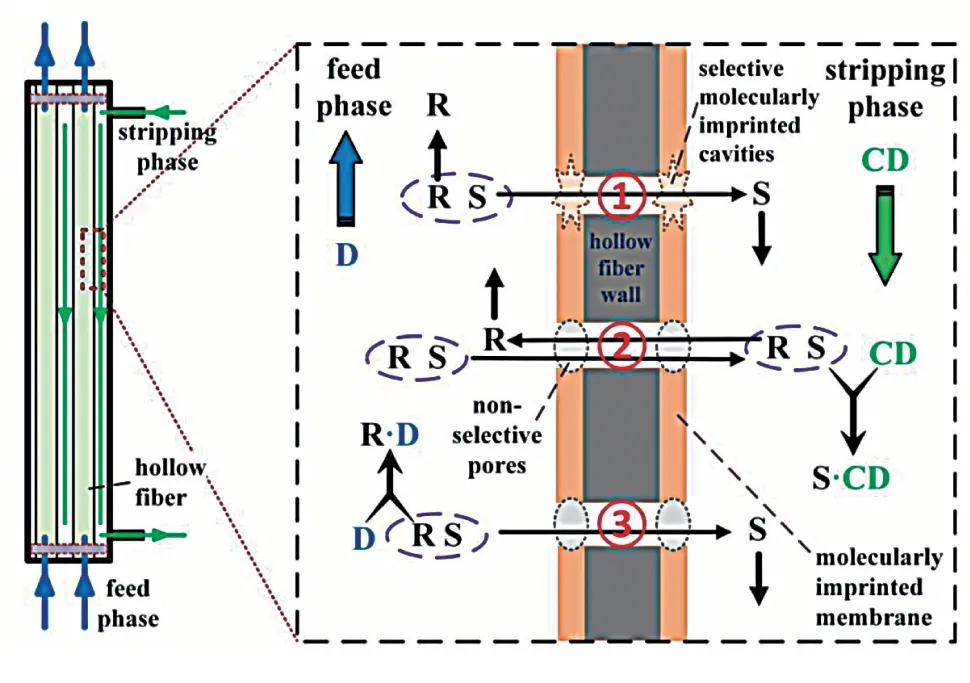
圖7 錯流萃取分離過程的三重識別機制
2.6 酶拆分法
生物酶拆分技術是利用生物酶活性中心中不對稱的結構能特異性地識別消旋體,這種生物酶識別對映體后能誘導底物進行原位消旋,特異性地生成單一手性產(chǎn)物,實現(xiàn)動力學拆分[28]。由于酶法拆分反應條件溫和、選擇性好而被廣泛應用于許多外消旋體的拆分。然而未發(fā)現(xiàn)酶法拆分在氨氯地平拆分中的應用報道。Satish 等[29]應用分子對接技術研究溶菌酶氨基酸殘基與氨氯地平的相互作用,發(fā)現(xiàn)氨氯地平與溶菌酶蛋白質絡合形成配合物結晶,或許可以利用這一性質拆分氨氯地平對映體。另外隨著酶定向化技術的發(fā)展,將來會開發(fā)出更多高選擇性的酶用于氨氯地平的手性拆分。
3 結語
隨著手性拆分技術的發(fā)展,氨氯地平對映體拆分的技術和方法將越來越多,同時氨氯地平對映體的拆分研究將加快高純度左旋氨氯地平的獲得及其工業(yè)化應用。手性藥物研究領域具有巨大的潛在應用價值,期待我國化學及藥學基礎研究工作者投身這一重要研究領域,共同推動手性藥物拆分領域的發(fā)展。

