‘京紅’桃芽變縫合線局部早熟分子機制的探究
劉璐琪,申艷紅,宋立琴,石天磊,武軍凱,張立彬
(河北科技師范學院 園藝科技學院,河北省特色園藝種質挖掘與創新利用重點實驗室,河北秦皇島 066004)
桃果實是典型的呼吸躍變型果實,采后迅速軟化、腐爛變質,特別是有些桃品種果實縫合線局部早熟,主要表現是縫合線局部凸起、軟化、變色,當整個果實達到適采成熟度時,因該部位過軟而無法運輸銷售。縫合線軟化是當今桃生產中存在的重要問題之一,有些品種發病率超過50%,嚴重影響品質和商品價值[1-2]。有研究發現,縫合線軟化部位的木質部和韌皮部面積相對較大,維管束發達粗大,糖代謝和相關酶活性都較旺盛[3-4]。桃縫合線部位的生長素(IAA)和玉米素(ZT)含量與縫合線局部軟化具有相關性[5]。學者們對導致縫合線軟化的原因進行了分析,有學者認為屬于生理性障礙,與缺鈣有關[6]。劉志民等[2]認為,與品種關系較大,‘大久保’、‘燕紅’等品種發病率較高,種仁充水、呼吸加強使其提早釋放乙烯,是縫合線軟化的主要原因。目前,關于桃縫合線早熟的相關研究大都局限于生理生化水平,相關分子機理研究還鮮見報道。
本課題組在‘京紅’桃中獲得了一個芽變。該芽變具有兩個特性,一是晚熟,突變體比野生型的成熟期約晚2周;二是芽變縫合線部位具有局部早熟特性,縫合線部位比果面部位提前兩周變紅,是研究縫合線局部早熟的好材料。基因差異表達是調節桃果實不同部位成熟進程差異的根本原因,通過轉錄組測序技術挖掘重要功能基因已經被廣泛應用。本研究以‘京紅’野生型果實為對照,采用轉錄組測序技術對芽變果實的縫合線和果面部位差異表達基因進行比較,挖掘桃果實縫合線提前成熟相關基因,分析其表達規律,從分子水平上分析果實不同部位成熟調控分子機制。
1 材料和方法
1.1 試驗材料及取樣
供試材料為桃品種‘京紅’[Prunuspersica(L.) Batsch. cv. Jinghong wild type,JHW]及其芽變(Jinghong mutant,JHM)的果實,采自河北省秦皇島市撫寧區桃園。在桃花后40、60、66、73、82和90 d進行果實采樣,當天運回實驗室進行處理。每份樣品選擇果實大小一致、無病蟲害、無損傷的9個果實進行硬度測定。然后,將9個果實分為3組,將每組3個果實削去果皮后,將縫合線部位和果面部位的果肉分別切成小塊后混勻,樣品分別編號為WSP(JHW縫合線果肉)、WP(JHW果面果肉)、MSP(JHM縫合線果肉)、MP(JHM果面果肉),后續用于花青素含量的測定以及轉錄組測序。
1.2 果實硬度的測定
桃果實硬度采用TA.XTC-18質構分析儀(上海保圣實業發展有限公司)進行測量,選用TA/2N型號探頭,TPA模式,設定觸發點30 gf,目標量30 gf,測試速度2 mm/s,得出測定參數。隨機選取9個果實測定縫合線和果面處硬度,用探頭在削去果皮后的果肉處進行測定,每個部位測定3次。
1.3 果肉花青素含量的測定
果肉花青素含量的測定參照楊夫臣等[7]的方法。取1.0 g果肉樣品,液氮研磨成粉末后,置50 mL離心管中,加0.1 mol·L-1HCl溶液15 mL,置32 ℃溫箱中浸提8 h,期間搖動數次,離心,取上清液裝入光徑為1 cm的比色杯中,于530 nm下比色,記錄吸光度值(OD)。3次重復。
1.4 轉錄組測序及差異表達基因篩選
將花后66 d的4個果實樣品(WSP、WP、MSP、MP)送到廣州基迪奧生物科技有限公司,使用第二代高通量Illumina HiSeqTM2500測序技術進行轉錄組測序,對得到的數據進行過濾得到clean data后,將reads比對到參考基因組(基因組版本:GCF_000346465.2)上,并利用Cufflinks組裝轉錄本,得到已知轉錄本與新轉錄本。基因表達量的計算使用FPKM(fragments per kilobase of transcript per million fragments mapped reads)法,按照edgeR的一般過濾標準[log2|fold change(FC)| >1 & FDR (false discovery rate) <0.05]篩選差異表達基因,將篩選得到的差異表達基因做GO(gene nntology)和KEGG(kyoto encyclopedia of genes and genomes)富集分析。
1.5 差異表達基因的實時熒光定量表達分析
以北京博邁德生物技術有限公司的植物RNA提取試劑盒分別提取‘京紅’及其晚熟芽變果面及縫合線處的RNA,逆轉錄為cDNA。參照候選基因序列設計熒光定量引物(表1),以桃PpTEF2為內參,20 μL熒光定量PCR反應體系為:2.0 μL cDNA,0.5 μL上游引物,0.5 μL下游引物,10 μL SYBR Premix Ex TaqTM(TaKaRa,日本),7.0 μL滅菌水。反應程序為:95 ℃退火30 s,95 ℃ 5 s,60 ℃ 15 s,39次循環。使用購自美國伯樂有限公司的熒光定量PCR儀(Bio-Rad CF CONNECTTMReal-Time System)檢測基因的表達量。2-ΔΔCT法[8]分析基因表達的相對變化。進行3次生物學重復測定,采用Excel軟件作圖。

表1 熒光定量引物序列
2 結果與分析
2.1 桃果實形態、硬度及花青素含量隨發育期變化特征
‘京紅’野生型(JHW)及其芽變(JHM)不同發育時期的果實形態比較可以看出,芽變果實具有晚熟特性,比野生型果實晚成熟約2周;除此之外,芽變果實縫合線部位比果面部位局部早成熟。在花后66 d,野生型果實約為七成熟,此時果皮已轉白,縫合線部位和部分果面均為紅色;而花后66 d的突變體果實,果面仍為綠色,縫合線部位為紅色,此時其果面與縫合線部位成熟度差異較大,用于后續轉錄組測序(圖1,A)。隨著果實的生長發育,JHW和JHM果肉硬度均逐漸降低,尤其在花后66 d開始明顯下降;同時,兩種材料果面硬度均大于相應時期縫合線部位的硬度,芽變果面和縫合線硬度基本大于同期的野生型(圖1,B)。另外,如圖1,C所示,隨著桃果實的逐漸成熟,野生型和突變體果實果面以及縫合線部位的花青素含量均呈上升趨勢;在花后66 d開始明顯上升,且野生型始終高于突變體,突變體中又表現為縫合線始終高于果面。

WP. 野生型果面;WSP. 野生型縫合線;MP. 突變型果面;MSP. 突變型縫合線;下同
2.2 轉錄組數據質量分析與基因注釋
將花后66 d的‘京紅’野生型及其芽變果實的果面和縫合線4個樣品(WP、WSP、MP、MSP)進行轉錄組測序,轉錄組測序數據組裝和注釋情況見表2。其中,去除接頭、Ploy A、低質量序列以及核糖體RNA后,4個樣品WP、WSP、MP、MSP的干凈讀長(Clean Reads)分別為56 527 760、50 253 068、54 834 138、54 811 850,GC含量分布在45.79%~46.06%之間,并且Q20均大于98%,表明測序數據質量優良,可以進行后續試驗。對所有樣品檢測基因數目進行統計,共檢測到20 108個基因,占桃參考基因組基因總數(23 128)的86.94%。

表2 測序數據組裝和注釋統計表
2.3 差異基因數目統計與Pathway功能顯著性富集分析
以FDR<0.05且|log2FC|>1為條件篩選差異基因。如圖2所示,WSP相對于WP、MSP相對于MP的差異表達基因分別為1 297和1 889個;其中,WSP相對于WP的差異表達基因中561個基因上調表達,736個基因下調表達;MSP相對于MP的差異表達基因中1 308個基因上調,581個基因下調。由此可見,突變體縫合線與果面之間差異表達基因數目遠多于野生型,尤其是上調表達基因數量大大增加,這些基因在縫合線與果面之間的差異表達促進了縫合線部位的提早成熟。另外,對突變體縫合線與果面的1 889個差異基因進行分析發現,其共參與112種代謝通路,其中Top 20的代謝通路見圖3,主要富集在代謝途徑(metabolic pathways)、次生代謝產物的生物合成(biosynthesis of secondary metabolites)、植物激素信號轉導(plant hormone signal transduction)、苯丙素的生物合成(phenylpropanoid biosynthesis)等代謝通路。因此,‘京紅’桃突變體果實縫合線比果面提早軟化和變紅,與這些代謝途徑、次生代謝產物的生物合成、植物激素信號轉導、苯丙素的生物合成有關。

圖2 差異基因數目統計

圖3 MSP與MP之間KEGG富集前20代謝途徑氣泡圖
2.4 桃縫合線部位提前成熟相關候選基因的篩選與分析
比較突變體桃果面與縫合線部位間差異基因的表達,篩選出24個縫合線提前成熟相關的候選基因,包含5個細胞壁降解相關基因、9個色素合成相關基因、5個乙烯合成與信號轉導相關基因、3個生長素應答基因、2個NAC轉錄因子(表3)。

表3 桃果實縫合線和果面的差異表達基因
首先,細胞壁降解相關基因中包括4個果膠降解酶基因和1個纖維素降解酶基因,分別為果膠酯酶(pectinesterase domain-containing protein,PME)、果膠裂解酶(pectate lyase 5,PL5)、內聚半乳糖醛酸酶(endo-polygalacturonase,PG)、β-半乳糖苷酶(beta-galactosidase protein,BGAL)和木葡聚糖內轉糖基酶/水解酶(xyloglucan endotransglucosylase/hydrolase protein 33,XTH33)基因,它們在突變體縫合線部位的表達量顯著高于果面中的表達量。
其次,色素合成相關基因包含2個卟啉葉綠素合成途徑基因,分別為血紅素加氧酶(heme oxygenase 1,HO1)和原葉綠素酸酯氧化還原酶(protochlorophyllide reductase,PORA)基因;5個花青素合成途徑基因,分別為查爾酮合酶(chalcone synthase,CHS)、查爾酮異構酶(chalcone flavonone isomerase,CHI)、黃烷酮3-羥化酶(flavanone 3-hydroxylase,F3H)、二氫黃酮還原酶(dihydroflavonol 4-reductase,DFR)、原花色素雙加氧酶(leucoanthocyanidin dioxygenase,ANS)基因;2個花青素合成調節轉錄因子,分別為MYB轉錄因子(R2R3 MYB transcription factor 10,MYB10)、bHLH轉錄因子(transcription factor bHLH111-like isoform X1,BHLH)。葉綠素合成途徑關鍵基因PORA在突變體縫合線部位表達量低于果面部位,而5個花青素合成途徑基因與2個轉錄因子的表達趨勢則與PORA相反,在縫合線部位表達量顯著高于果面處,這與縫合線部位紅色、果面部位綠色密切相關。
再次,乙烯在桃果實成熟的過程中起關鍵作用,共篩選出5個乙烯合成與信號轉導相關基因。2個乙烯合成關鍵基因分別為ACC合成酶(1-aminocyclopropane-1-carboxylate synthase,ACS1)、ACC氧化酶(1-aminocyclopropane-1-carboxylate oxidase,ACO1)基因,在突變體縫合線部位表達量是果面部位的數倍,說明縫合線部位乙烯合成速率顯著高于果面;3個乙烯轉導相關基因分別為1個乙烯受體(ethylene receptor 2,ETR2)、2個乙烯應答因子(ethylene-responsive transcription factor,ERF),它們在突變體縫合線部位和果面部位的表達差異也達到顯著水平。
另外,有研究表明,生長素可能是桃果實成熟期乙烯釋放的先決因素,篩選的3個Aux/IAA家族基因在縫合線部位表達量顯著高于果面部位。此外,還篩選了2個參與果實成熟調控的NAC轉錄因子——NAC2和NAC72,二者具有相似的表達趨勢,在縫合線部位的表達量均低于果面部位,NAC2在縫合線部位的表達量約為果面部位的1/2。
進一步對差異表達基因進行了熱圖分析(圖4)可知, 24個差異表達基因的表達模式聚類為三大組。一組是PORA、NAC72、NAC2和ERF105,這4個基因在野生型縫合線和果面的表達量相當,而在突變體縫合線部位的表達量顯著高于果面;一組是花青素合成相關基因BHLH、MYB10、ANS、CHI、CHS、F3H、DFR,以及細胞壁降解基因BGAL、XTH33,這一大組基因在野生型桃果實的縫合線和果面表達量較低且無顯著差異,而在突變體縫合線部位大量表達,且表達量顯著高于果面;另一組是剩余的11個基因,它們在野生型桃果實中的表達量較高,在突變體縫合線與果面中差異表達。
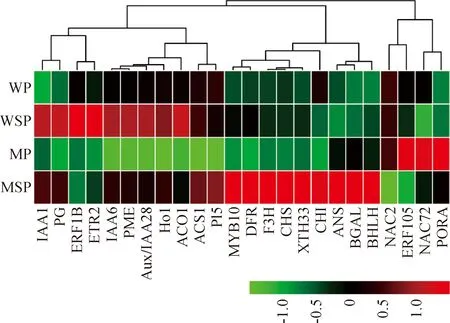
圖4 差異表達基因的熱圖分析
2.5 轉錄組數據驗證
對12個差異表達候選基因進行了熒光定量驗證,結果如圖5所示,對比熒光定量與RNA-seq兩種技術獲得的差異基因表達趨勢,二者基本一致,這進一步證明了轉錄組數據的可靠性。
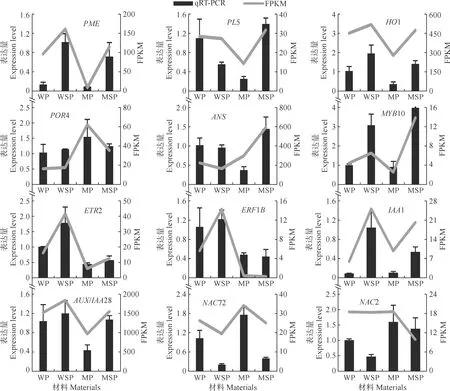
圖5 用熒光定量PCR分析12個差異表達基因的相對表達量
3 討 論
纖維素和果膠的降解是導致果實軟化的直接原因。劉志民等[2]發現,縫合線易軟桃品種在果實成熟初期縫合線部位的果膠酶活性較高,說明果膠降解在縫合線軟化中起作用。通過比較‘京紅’突變體縫合線與果面部位基因的差異表達,篩選了5個細胞壁降解相關基因,其中PME、PL5、PG和BGAL參與果膠降解,在縫合線部位的表達量顯著高于果面數倍,尤其是PG基因在突變體縫合線的_fpkm值高達360,是突變體果面_fpkm(44)的8倍,說明縫合線提前軟化與PG基因的高表達密切相關,PG在多種果實軟化中的重要作用已經被證實[9-10]。另外,纖維素降解酶基因XTH33在縫合線中的表達量也顯著高于果面,超過了10倍,說明在縫合線果膠降解的同時也伴隨著纖維素降解。
桃果實顏色與葉綠素、類胡蘿卜素和花青素含量相關[11-12]。在桃果實成熟過程中,綠色逐漸褪去,紅色逐漸出現,說明桃果實轉色伴隨著花青素含量增加和葉綠素的減少。本研究篩選出了9個色素合成相關基因。其中,HO1和PORA為卟啉與葉綠素代謝途徑基因,隨著果實成熟葉綠素合成關鍵基因PORA表達量降低,減少了葉綠素合成;同時,CHS、CHI、F3H、DFR、ANS為花青素合成途徑基因,在突變體縫合線處表達量為果面處的2倍以上,其中CHS與DFR基因的MSP/MP_fpkm倍數最高,分別為17和10,說明CHS和DFR基因的高表達促進了桃縫合線部位提早變紅,這與Tsuda等[13]的CHS和DFR為花青素合成關鍵基因的結果一致。另外,前人已經證實,R2R3-MYB和bHLH類轉錄因子在花青素合成中具有重要調控作用[14-15]。在本研究中,MYB10與bHLH在‘京紅’野生型縫合線與果面部位的表達量相當,而在突變體的兩部位間表達量差異顯著,變化趨勢與花青素合成途徑基因一致,推測它們是桃花青素合成調控的重要轉錄因子。
桃是呼吸躍變型果實,乙烯含量增加會促進果實迅速成熟衰老[16-17]。在桃縫合線易軟品種中,縫合線處的乙烯含量明顯高于果面處[18-19]。ACC合成酶(ACS1)與ACC氧化酶(ACO1)是乙烯合成過程中的限速酶,本研究中ACS1與ACO1在突變體縫合線部位的表達量是果面部位的3倍,顯著提高了縫合線部位的乙烯合成速率;同時還檢測到差異表達的乙烯受體基因ETR2,以及2個乙烯應答因子ERF1B和ERF105。研究表明,有些ERF參與了果實成熟過程,甜橙CitERF6通過上調葉綠素降解基因CitPPH的表達促進果實褪綠;桃PpeERF2、番木瓜CpERF9通過抑制相關細胞壁降解酶基因的表達,推遲果實軟化[20-21]。本研究篩選的ETR2與ERF基因在桃突變體縫合線成熟過程中的具體作用還需進一步研究。除了以上基因,有些生長素相關基因也通過調控乙烯釋放量參與果實成熟調控。在桃果實成熟過程中,ACS1與生長素合成限速酶基因YUCC11的表達趨勢相同[22];生長素原初響應基因(Aux/IAA)與ACS1、YUCC11基因共表達,可能參與了桃果實成熟調控[23]。本研究中的3個Aux/IAA家族基因在突變體縫合線部位的表達量高于果面,與ACS1和ACO1表達趨勢一致,這與前人研究結果相符。
此外,桃縫合線部位的早熟也與其特殊的結構相關。桃果實為真果,由單心皮雌蕊發育而成,雌蕊由葉子演化而來,縫合線相當于葉子的葉緣位置,發育為種子的胚珠著生在縫合線上。在縫合線易軟桃品種中縫合線部位維管束粗大發達,韌皮部和木質部面積也相對較大,腺腔發達[3]。
綜上所述,‘京紅’桃芽變縫合線部位比果面部位局部早成熟約2周,在花后66 d,縫合線與果面部位差異表達基因1 889個,從中篩選到24個縫合線早熟相關基因,包含5個細胞壁降解相關基因,9個色素合成、調控相關基因,5個乙烯合成與轉導相關基因,3個生長素應答基因和2個NAC轉錄因子。通過分析這些基因的差異表達推測縫合線部位局部早熟的原因。桃種仁產生的乙烯從縫合線向周圍擴散,促進ACS1和ACO1等基因的轉錄,合成了較多乙烯,乙烯又進一步調控該部位PG、XTH33、CHS、DFR等細胞壁降解與色素合成相關基因的表達,導致該部位的提前成熟。

