脂肪與肥胖相關基因FTO對肝細胞增殖效果研究*
王 倩 折瑞蓮 沙文瓊 林湖濱 曹雨之
廣東省深圳市人民醫院 518020
機體健康與肝臟關系密切,肝臟疾病發病率逐年提高,嚴重影響人們的生活質量[1]。肝臟疾病發病不區分人群,如青少年肥胖、孕婦妊娠期脂肪肝[2-3]。一些常見的肝臟疾病由過度肥胖導致,如脂肪肝[4-5]。因此,探索與肥胖相關的因素顯得尤為重要。
脂肪與肥胖相關基因(Fat mass and obesity-associated protein gene,FTO)于1999年在研究小鼠融合趾被發現,起初,認為與細胞程序性凋亡有關[6]。2007年,通過全基因組關聯分析研究發現FTO是肥胖敏感性基因,與肥胖率、能量吸收率有關,編碼m6A去甲基化酶[7]。2011年,FTO被鑒定為脂肪與肥胖相關基因,并與代謝性疾病、腫瘤發生發展存在密切關系[8-9]。在大鼠疾病模型研究中,發現FTO過表達導致體重顯著增加、糖尿病等。FTO編碼的去甲基化酶作用與代謝相關的信號通路分子,引起能量代謝失調,進而可能導致肥胖、糖尿病等代謝性疾病[10-11]。此外,有研究發現,脂肪組織細胞FTO表達水平改變會增加外周血細胞FTO等位基因高表達的風險[12]。在正常肝細胞中還不清楚其如何調控肝細胞的增殖活性。本研究旨在利用人肝正常細胞模型研究FTO如何調控肝細胞增殖,研究其干擾與過表達對肝細胞的增殖效果,以及對代謝相關基因表達的調控,以期合理指導肝臟疾病患者飲食,避免肥胖、糖尿病等代謝疾病。
1 材料與方法
1.1 實驗材料
1.1.1 試劑:1640培養基、甘油檢測試劑盒、BCA蛋白濃度檢測試劑盒、甘油三酯檢測試劑盒與CCK-8試劑盒購自南京凱基公司。胎牛血清購自杭州四季青公司。FTO-OE過表達載體購自廣州基旦生物公司。FTO-sh干擾載體購自廣州艾基生物公司。qPCR反轉錄試劑盒與蛋白marker購自日本TAKARA公司。qPCR引物購自上海生工公司。GAPDH抗體購自美國CST公司。293T細胞與人肝正常細胞HL-7702購自中國科學院上海細胞庫。SDS-PAGE凝膠試劑盒與蛋白裂解劑RIPA購自碧云天公司。Lipo2000轉染試劑與TRIzol購自美國Invitrogen公司。
1.1.2 儀器:qPCR儀器(Bio-Rad,M400)。酶標儀(博璐騰,型號DC220)。超凈臺(蘇州超凈,型號WT-2ND)。二氧化碳培養箱(Thermo,型號BB150)。
1.2 實驗方法
1.2.1 細胞培養與轉染:使用RPMI1640培養基添加終濃度10%的胎牛血清培養肝細胞,并置于37℃,含5%CO2培養箱培養細胞。293T細胞培養在6孔板, DNA(μg)(帶有綠色熒光蛋白GFP標簽)與Lipo2000(μl)的比例為1∶2。250μl Opti-MEM(不含血清和抗生素)稀釋10μl Lipo2000,室溫靜置5min形成DNA-Lipo2000復合物。從6孔板中吸出500μl培養基,然后滴加入500μl質粒和脂質體混合物。4~6h后,移除含有DNA-脂質體復合物的培養基,代之以正常培養基,繼續將細胞放置溫箱孵育。
1.2.2 CCK-8法檢測細胞存活:細胞轉染過表達及干擾慢病毒載體后,96孔板加入細胞 100μl/孔(約 1×104),將96孔板在37℃,含5% CO2細胞培養箱中孵育1d、2d、3d、4d。向各孔中加入10μl的 CCK-8 檢測溶液。37℃下孵育1h。讀數前在搖床上輕微震蕩混勻,使用酶標儀在 450nm 波長處檢測每孔的吸光度。細胞增值率計算公式=(轉染組/NC對照組)×100%
1.2.3 Western blot法檢測蛋白表達:常規流程胰酶消化細胞,1 000r/min離心5min,轉移至1.5ml離心管,PBS清洗細胞3次,按50μl RIPA+ 5μl PMSF (100mmol)比例加裂解液,吹打細胞,搖勻置于冰上30min。裂解完后,于4℃下16 000r/min離心15min。配制8%的SDS-PAGE,每孔上樣20μg蛋白樣品,恒壓分離蛋白。切下目標條帶以及內參條帶。凝膠置于轉膜液平20min,待處理。PVDF膜甲醇預處理3~5min,純水洗膜2min,轉至轉膜緩沖液浸潤5min。操作必須將氣泡完全去除。按正負極方向放置轉印夾。冰浴條件下,250mA恒流轉移1h。取出雜交膜,5%脫脂奶粉溶液室溫封閉1h。一抗稀釋濃度4℃過夜。TBST洗膜10min,3次。相應二抗稀釋液37℃孵育1h。TBST(吐溫-20,0.1%)洗膜10min,3次。將雜交膜置于干凈的保鮮膜上。暗房顯影,使用化學發光液均勻地加到膜的表面,并使反應持續5min。
1.2.4 qPCR法檢測ATGL、c/EBPβ、FAS相對表達:胰酶消化并收獲細胞,轉入1.5ml離心管中,加入1ml Trizol,混勻,室溫靜置5min。加入0.2ml氯仿,振蕩15s,靜置2min。4℃離心,12 000g,15min,取上清。加入0.5ml異丙醇,將管中液體輕輕混勻,室溫靜置10min。4℃離心,12 000g,10min,棄上清。加入1ml 75%乙醇,輕輕洗滌沉淀。4℃離心,7 500g,5min,棄上清。室溫晾干,加入DEPC 水溶解,超低溫冰箱保存。反轉錄條件:37℃,15min;85℃,5s。qPCR體系:模板,1μl;前引物 (10μmol/L),0.4μl,后引物(10μmol/L),0.4μl;2×PerfecStar qPCR SuperMix,10μl;Nuclease free-Water,8.2μl。使用兩步法分析基因表達,程序如下,95℃ 5s, 60℃ 5s, 然后42個循環擴增分析基因表達(95℃,15s;60℃,1min)。使用2-ΔΔCt方法計算基因相對表達,以GAPDH表達為對照。
1.2.5 試劑盒方法檢測甘油水平:甘油水平檢測按照試劑盒說明書進行。細胞(包括分化的脂肪細胞)裂解,消化、離心收集細胞。或直接在培養皿內裂解。按比例每(1~2)×106細胞加100μl裂解液,混勻裂解。裂解物處理,取100~500μl裂解物轉移到1.5ml離心管,進行下一步操作。70℃加熱10min滅活脂肪酶,可能出現絮狀沉淀。室溫5 000r/min離心5min,上層清液既可用于酶學測定。工作溶液的配制,按R1∶R2=4∶1比例。標準品稀釋,用蒸餾水、生理鹽水或與樣品緩沖液一致的液體,將4mmol甘油標準品倍比稀釋為62.5、31.25、15.625、7.812 5μmol,注意設置0濃度對照反應管。甘油三酯水平檢測方法同甘油檢測。
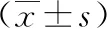
2 結果
2.1 慢病毒干擾FTO-sh載體及過表達FTO-OE載體構建 FTO-OE慢病毒干擾載體(見圖1a、b)及FTO-sh慢病毒過表達載體經轉染293T細胞后(見圖1c、d),進一步培養細胞并分析FTO過表達及干擾效果。從圖2可以看出,western blot分析看出,FTO-OE過表達載體有效提高FTO蛋白的表達水平(見圖2a),qPCR方法得到一致的結果(P<0.05),見圖2b。FTO-sh干擾載體顯著性降低FTO蛋白的表達水平(見圖2c),qPCR結果亦顯示出同樣的結果(P<0.05),見圖2d。

a b

a b
2.2 FTO對正常肝細胞的增殖效果 FTO-OE轉染正常肝細胞HL-7702,培養5d。從圖3a看出,肝細胞增殖率逐漸增強,與FTO-NC對照組存在顯著差異,FTO基因對肝細胞生長有促進的功能(P<0.05);當干擾FTO的表達時,肝細胞存活率存在明顯的抑制水平,肝細胞的生長率逐漸降低(P<0.05),見圖3b。從以上結果可以看出,FTO具有促進肝細胞增殖功能。

a b
2.3 FTO調控肝細胞甘油代謝 當FTO過表達時,與FTO-NC對照組相比,肝細胞產生的甘油水平顯著提高(P<0.05),見圖4a;當干擾FTO的表達時,與FTO-NC對照組相比,甘油的水平存在降低的現象(P<0.05),見圖4b。從實驗結果能夠看出,FTO對肝細胞里的甘油具有明顯的正調控性。

a b
2.4 FTO調控肝細胞甘油三酯代謝 以上結果顯示FTO對肝細胞甘油代謝調控具有正調控功能,那么其對甘油三酯應該也具有同樣調控效果。與預期中的結果一致,實驗結果顯示,與FTO-NC對照組相比,當FTO過表達時,甘油三酯的水平顯著提高(P<0.05),見圖5a;當沉默FTO的表達,甘油三酯的水平顯著降低(P<0.05),見圖5b。與FTO對甘油代謝調控一致,FTO對甘油三酯代謝具有同樣效果。

a b
2.5 FTO調控肝細胞與代謝相關的基因 以上結果顯示,FTO對肝細胞脂肪代謝具有正調控功能。下面從基因的角度分析FTO對脂肪代謝相關基因表達調控。與FTO-NC對照組相比,當FTO過表達,ATGL表達水平降低, c/EBPβ與FAS表達水平提高(P<0.05),見圖6a;當干擾FTO的表達,出現相反的結果,ATGL表達水平提高, c/EBPβ與FAS表達水平降低(P<0.05),見圖6b。結果顯示,FTO對脂肪代謝相關基因表達具有調控的功能。

a b
3 討論
FTO是脂肪與肥胖相關基因,在脂肪代謝、肥胖、糖尿病、腫瘤進展等方面具有重要的調控功能[12-13]。本研究綜合利用MTT方法、western blot、qPCR等方法發現,FTO對肝細胞增殖、甘油水平、甘油三酯水平、甘油代謝相關基因表達具有調控的功能。當FTO過表達,肝細胞增殖活性提高,甘油與甘油三酯水平提高,ATGL表達水平降低, c/EBPβ與FAS表達水平提高;當干擾FTO表達,出現相反的結果。FTO具體如何調控肝細胞脂肪代謝基因還需進一步研究。
代謝性疾病作為一種特殊的疾病,參與多種并發癥發生發展。FTO與代謝性疾病關系密切,如脂肪肝、糖尿病、肥胖、腫瘤等[6,14-15],其編碼m6A去甲基化酶,介導多種疾病的發生發展,但是其對宿主細胞的代謝調控機制仍未闡明[6]。目前,多數研究表明FTO通過m6A修飾對葡萄糖和脂肪代謝發揮作用,在肝臟 FTO通過調節肝臟糖生成基因的表達參與調節全身糖穩態,如有小鼠研究表明,肝臟細胞特異性 FTO 過表達導致小鼠空腹血糖和胰島素水平升高,糖耐量降低[16]。在肝臟組織細胞,FTO 通過改變肝臟中 m6A 的修飾狀態和脂質代謝相關基因的表達進而調節脂質代謝,抑制機體能量轉換為熱量,最終形成肥胖[7,17]。有研究表明,FTO 通過下調靶基因的m6A 水平,降低線粒體含量,提高甘油三酯積累水平,促進脂肪在肝臟的積累,加劇脂肪肝進程。如脂肪肝大鼠模型中發現,FTO mRNA和蛋白水平顯著上升,且發現FTO表達水平與丙二醛、超氧化物歧化酶濃度呈正相關,肝臟中FTO 水平升高與氧化應激和脂質沉積有關[18]。
然而,蹊蹺的是FTO在不同的細胞疾病模型中出現的效果可能相反,因此闡明FTO在具體細胞中的作用很關鍵,如FTO與肪肝代謝性疾病形成的關系是怎樣的,這對指導脂肪肝、糖尿病等患者尤為重要。

