18F-FDG PET/CT在原發性中樞性神經系統淋巴瘤中的影像分析
曹登敏 沈建箴 林美福 陳文新 陳彩龍
1 福建醫科大學省立臨床醫學院 福建省立醫院核醫學科,福建省福州市 350001; 2 福建醫科大學附屬協和醫院血液科
原發性中樞神經系統淋巴瘤(Primary central nervous system lymphoma,PCNSL)是一種少見的結外非霍奇金惡性淋巴瘤(Non hodgkin lymphoma,NHL),過去一般認為該腫瘤發病率較低,但近年來關于PCNSL的報道呈逐漸上升趨勢,占所有非霍奇金淋巴瘤的1%~2%,占所有顱內腫瘤的2%~6%[1-5]。18F-FDG PET/CT已廣泛應用于NHL的早期診斷、療效評估及預后判定等,本文回顧性分析11例PCNSL的18F-FDG PET/CT影像學表現及與腫瘤代謝參數的相關性,探討其影像學特征。
1 對象與方法
1.1 觀察對象 收集2012年4月—2020年8月福建省立醫院收治的經病理證實初診為PCNSL患者共11例,均為彌漫大B細胞淋巴瘤,其中男7例,女4例,年齡34~72(54.7±12.5)歲,治療前均行18F-FDG PET/CT顯像。首發臨床癥狀主要為頭痛、肢體無力、口唇歪斜、言語含糊、視物模糊等,其中單純頭痛4例,其他癥狀7例。11例患者人類免疫缺陷病毒(Human immunodeficiency virus,HIV)均陰性,無器官移植后免疫功能低下,中樞神經系統外無淋巴瘤。
1.2 PET/CT顯像 圖像采集使用PET/CT掃描儀(Discovery LS,美國GE公司)。18F-FDG由本中心回旋加速器(Mini Tracer,美國GE公司)生產并通過自動合成模塊合成,放化純度均>95%。所有患者禁食6~8h,確認血糖在正常水平后通過預置的三通管靜脈注射18F-FDG,注射劑量3.70~4.81MBq/kg。在安靜的房間內靜臥50~60min后開始圖像采集。先行CT掃描,電壓為140kV,電流為130~160mA,層厚為5.0mm;然后行PET發射掃描,采用3D采集模式。圖像重建采用有序子集最大期望法迭代(OSEM)。將CT和PET圖像傳送到Aw4.7工作站進行圖像融合分析。
1.3 圖像分析 PET/CT圖像由2名核醫學科醫師獨立閱片,采用視覺分析法和半定量分析法,視覺分析法主要觀察病變的部位、形態、大小、密度、占位效應及病變內FDG分布情況。半定量分析主要是利用畫感興趣區(ROI)的方法,以42%SUVmax為閾值勾畫出所有病灶最大標準攝取值(SUVmax)、腫瘤代謝體積(MTV)和糖酵解總量(TLG)。在同機CT圖像上測量病變的最大直徑(單位為cm,位于腦膜、脊髓病灶者無法測量病變直徑,不納入部分統計分析)。腦膜病灶經MRI增強證實,影像表現為腦膜異常強化灶,在PET上多呈條片狀或小結節狀高代謝灶。CT伴隨征象的界定:水腫即病灶周邊伴帶狀低密度區;壞死病灶CT值在0~10HU,出血病灶CT值為60~90HU,MRI增強掃描提示相應部位壞死、出血。
1.4 統計學方法 采用SPSS19.0統計軟件進行數據分析,計量資料用平均值±標準差表示,采用Pearson相關分析比較病灶的最大直徑與SUVmax、MTV、TLG有無相關性;采用獨立樣本t檢驗比較不同位置病變、是否合并CT伴隨征象、單發與多發病變及不同癥狀患者之間SUVmax的差異,P<0.05為差異具有統計學意義。
2 結果
2.1 病灶大小、數目及分布情況 11例PCNSL共有病灶30處:病灶最大徑為1.2~4.5(2.9±0.8)cm。單發病灶2例(18.2%);多發病灶9例(81.8%)。僅1處位于脊髓(3.3%);4處位于腦膜(13.3%),其中1處為彌漫性病變(3.3%),3處為局灶性病變(10.0%);余25處位于腦實質(83.3%),幕上23處(76.7%),幕下2處(6.7%)。典型病例見圖1。
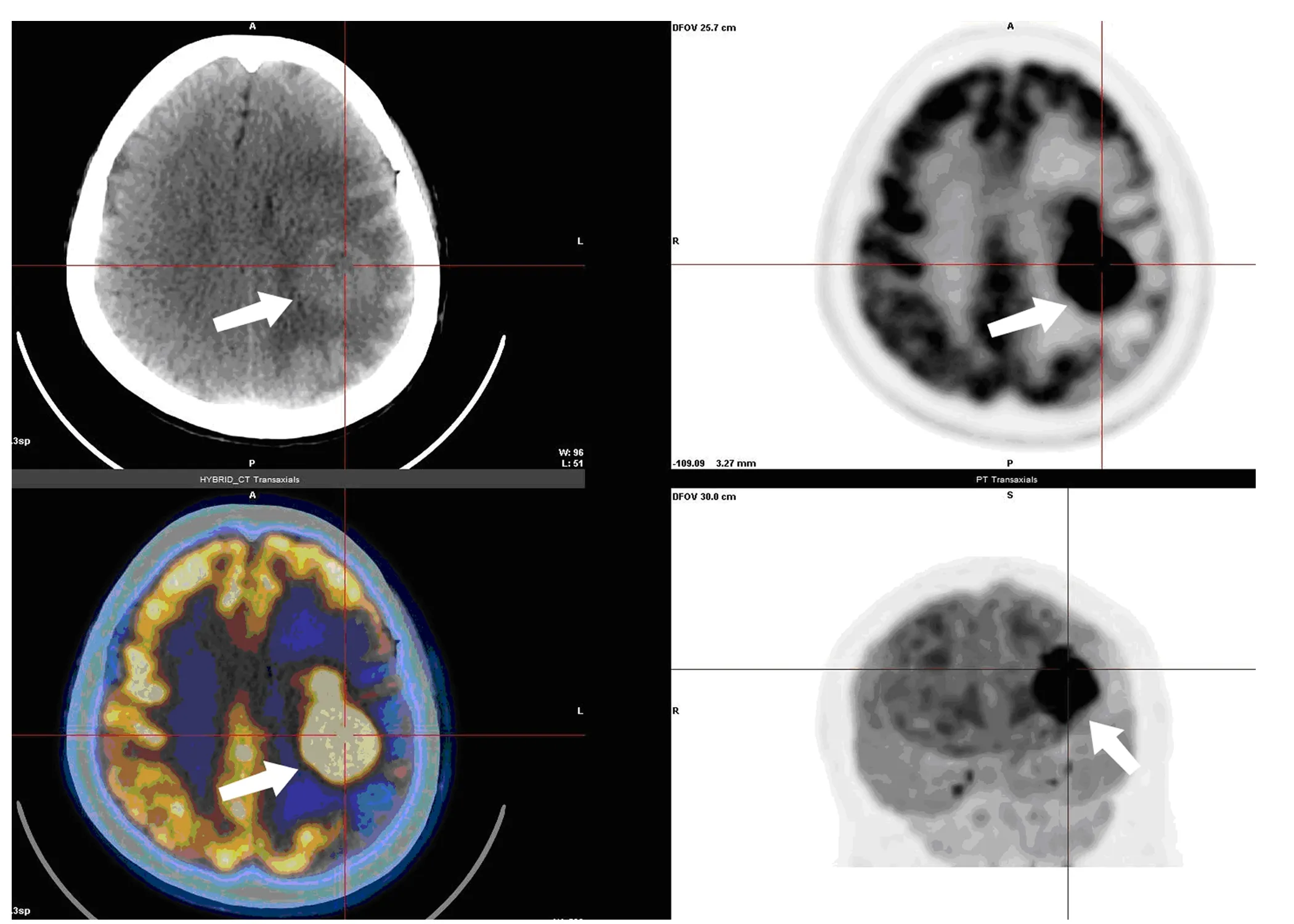
圖1 原發性中樞神經系統淋巴瘤(PCNSL)
2.2 臨床癥狀及CT伴隨征象情況 11例PCNSL表現為單純頭痛者4例(36.4%),頭痛合并肢體無力3例(27.3%),單純肢體無力2例(18.2%),視物模糊1例(9.1%),口唇歪斜1例(9.1%),根據上述癥狀的有無將患者分為單純頭痛組和其他癥狀組。25處腦實質病變中,同時伴水腫及壞死2處(8.0%),伴水腫16處(64.0%),伴壞死1處(4.0%),伴出血1處(4.0%),無伴水腫、壞死、出血病灶5處(20.0%),根據上述伴隨征象的有無將患者分為有伴隨征象組和無伴隨征象組。
2.3 腫瘤代謝參數與病灶大小、位置、數目、臨床癥狀及CT伴隨征象等相關性分析 所有病灶均呈18F-FDG高攝取,SUVmax為(26.0±11.3)g/ml、MTV為(22.3±11.7)cm3、TLG為(346.3±247.0)g/ml×cm3,三組數據均符合正態分布。腫瘤最大直徑與TLG相關(r=0.920,P<0.001);而腫瘤最大直徑與SUVmax、MTV不相關(r=0.378、0.593,P=0.060、0.054>0.05)。腦膜病灶SUVmax為(27.6±10.8)g/ml,腦實質病灶SUVmax為(20.5±10.5)g/ml,兩者差異無統計學意義(t=1.224,P>0.05);脊髓病灶(僅1例)SUVmax為6.5g/ml,在所有病灶中為最低值。單發病灶SUVmax為(42.5±17.3)g/ml,多發病灶SUVmax為(32.6±11.8)g/ml,兩者差異無統計學意義(t=1.010,P>0.05)。單純頭痛組腫瘤最大直徑為(3.8±0.7)cm,其他癥狀組腫瘤最大直徑為(2.9±0.5)cm,兩組差異有統計學意義(t=2.438,P=0.037);單純頭痛組SUVmax為(44.7±13.5)g/ml,其他癥狀組SUVmax為(28.6±7.7)g/ml,兩組差異有統計學意義(t=2.569,P=0.030)。有伴隨征象組SUVmax為(29.3±10.9)g/ml,無伴隨征象組SUVmax為(20.8±8.1)g/ml,兩組差異無統計學意義(t=1.613,P>0.05)。
3 討論
PCNSL是比較罕見的淋巴瘤類型。PCNSL病理上大多數為彌漫性大B細胞淋巴瘤(Diffuse large B-cell lymphoma,DLBCL),占95%以上,2%為T細胞淋巴瘤,其余少見的類型包括伯基特淋巴瘤、淋巴母細胞淋巴瘤和邊緣區淋巴瘤[6]。PCNSL常見發病部位為大腦半球(尤其額葉、顳葉)深部腦白質、丘腦/基底節區、胼胝體和腦室周圍,少數累及后顱窩、軟腦膜和脊髓[7]。本文中病例均為彌漫大B細胞淋巴瘤,且多數病灶位于腦實質,以幕上為多見,與文獻報道相符。PCNSL發病高峰在50~70歲,本文病例發病年齡34~72歲,與文獻相符[8]。該病臨床表現無明顯特異性,常與腫瘤的占位效應和病灶位置密切相關,常見位置包括大腦半球、基底節和胼胝體。表現為認知功能障礙、反應遲緩,也可以頭痛等顱內壓增高、輕度偏癱、癲癇發作及腦神經麻痹為首發癥狀[9]。本文提示單純頭痛組病灶直徑大、SUVmax較高,考慮頭痛的原因可能與病灶占位效應及代謝活躍等因素相關,但由于樣本量小,有待于進一步研究證實。
一項36例PCNSL患者中CT表現的回顧性分析提示病灶密度多較均勻,病灶周圍常伴輕—中度水腫,病灶內很少伴有出血及鈣化,少部分可見囊變[10]。本文中,病灶水腫多見,壞死、出血少見,與之基本相符。另本文中提示,TLG與腫瘤最大直徑呈顯著正相關,考慮與病灶密度均勻、相應的18F-FDG攝取分布亦均勻有關,故病灶大小基本與代謝成正比,TLG為MTV與SUVmean的乘積,故與SUVmax、MTV比較,TLG更能反映病灶總體代謝情況;而SUVmax僅反映病灶的最大SUV,不排除小病灶高代謝或大病灶相對低代謝的情況;MTV反映的是腫瘤代謝體積,其大小可能受到代謝程度高低的影響,但由于本研究樣本量較小,目前亦無相關文獻支持,有待進一步研究證實。
18F-FDG攝取在PCNSL中呈明顯增高。研究顯示,PCNSL組、腦膠質瘤組及腦轉移瘤組中SUVmax逐漸降低,PCNSL組SUVmax顯著高于腦轉移瘤組,而腦膠質瘤SUVmax高低與腫瘤病理類型、分級密切相關[11]。PCNSL和高級別膠質瘤PET均表現放射性攝取增高灶,CT均表現高密度或等密度,且級別越高放射性攝取程度越高、密度越高。但二者病灶內部改變有助于兩者鑒別診斷:PCNSL瘤內密度均勻,囊變、出血和鈣化少見,故18F-FDG放射性攝取均勻;而高級別膠質瘤灶周水腫較淋巴瘤明顯,病灶內囊變、出血、鈣化多見,18F-FDG放射性攝取欠均勻,呈現放射性攝取稀疏及缺損區。但部分PCNSL與高級別膠質瘤仍難以鑒別。PET/CT在病灶結構、解剖定位方面較MRI存在不足,但與CT、MRI相比,在判定淋巴瘤分期、評估療效及預后的應用更為廣泛,能更好地將功能和解剖定位相融合;本文中僅4處病灶位于腦膜、1處位于脊髓,考慮為較罕見的PCNSL發病部位,這些病灶在CT上無明顯異常征象,PET提示18F-FDG攝取增高,且腦膜病灶的攝取與腦實質病灶無明顯差別,病灶攝取形態各異,可呈彌漫性改變,亦可表現為局灶性改變,且其掃描范圍更大,故在發現腦膜及脊髓病灶方面更具優勢。
總之,PCNSL的PET/CT影像表現存在一定特征,以多發于腦實質(幕上)、合并水腫多見,伴出血、壞死少見;與SUVmax、MTV比較,病灶TLG與腫瘤最大直徑的正相關性最強;腫瘤越大,FDG攝取越高,以單純頭痛為首發癥狀多見。由于PCNSL整體發病率仍較低,部分患者在PET/CT顯像前已行手術治療,故本研究樣本量較少,有待于擴大樣本量進一步研究。

