優質米曲霉篩選及復合菌劑構建提升郫縣豆瓣蠶豆曲品質
亢樂,張麗杰*,徐巖*
1(釀造微生物學與應用酶學研究室(江南大學),江蘇 無錫,214122) 2(工業生物技術教育部重點實驗室(江南大學),江蘇 無錫,214122)
郫縣豆瓣是我國傳統優勢發酵食品,因其鮮辣醇厚、瓣粒香脆、香氣濃郁,被譽為“川菜之魂”[1]。作為調味品,郫縣豆瓣不僅給予人們感官上的享受,也提供了維生素、礦物質和其他營養物質,從而表現出對人體健康的有益影響[2]。2018年,郫縣豆瓣及衍生產品覆蓋全國超過65%的餐飲業,產值近200億,品牌價值提升至656.36億元[3]。在郫縣豆瓣生產過程中,蠶豆曲的制備是首要且關鍵工序[4]。而在蠶豆曲制備過程中,原料大分子是否充分降解為小分子物質,從而為后續高鹽發酵提供充足營養,決定了郫縣豆瓣的整體發酵質量及生產品質。
米曲霉是一種通常含有高效且豐富水解酶系的菌種,包括淀粉酶、蛋白酶、果膠酶等,是蠶豆曲生產的關鍵微生物[5]。目前,郫縣豆瓣蠶豆曲發酵多采用純種米曲霉滬釀3.042,該菌株于1976年由上海釀造研究所經紫外誘變及長期馴化得到(原始菌株:米曲霉AS 3.863),生長速度快、繁殖力強、水解酶活力高卻不平衡,距今已有近半個世紀的工業應用歷史[6-7]。為進一步提高制曲過程曲霉活力,幾十年來,科研人員從未停止過優質米曲霉菌種或菌劑的研發及獲取[8-9]。TANG等[10]從傳統釀造郫縣豆瓣、醬油醬醅中分離篩選高產蛋白酶菌株,并使用黑曲霉QH-3和米曲霉QM-6共培養制曲有效提高蠶豆曲水解酶活力,且成曲曲香更為濃郁。劉丹等[11]采用米曲霉與紅曲霉混合制作黃豆醬大曲,還原糖含量顯著提高,風味物質的種類和感官評分均較純種黃豆醬有所提升,更多有工業應用潛力的優質菌種或復合菌劑亟待開發。
本研究從傳統釀造食品微生物菌種資源庫中分離篩選鑒定2株具有優良發酵特性的曲霉菌株,經鑒定為米曲霉LBM 30007和米曲霉LBM 30008。經基礎發酵特征檢驗,本研究發現不同米曲霉菌株具有發酵互補性能。設計包括米曲霉滬釀3.042在內的復合菌劑制曲,發現復合菌劑能明顯提升制曲過程中的水解酶活力、氨基酸態氮濃度及鮮味氨基酸濃度。本研究設計了一種制曲用復合菌劑的構建策略,篩選獲得并鑒定優質米曲霉菌株及復合菌劑,具有郫縣豆瓣工業化生產的應用潛力,同時為其他高鹽高氮發酵食品工業化應用提供理論借鑒。
1 材料與方法
1.1 材料
1.1.1 菌種
米曲霉滬釀3.042購自中國工業微生物菌種保藏管理中心(編號CICC 2399);菌株LBM 30007、LBM 30008等生物學分類被初步鑒定為曲霉的50株菌均保藏于江南大學釀造微生物學與應用酶學研究室菌種庫,其中,28株曲霉于2019—2021年分離純化自發酵醬樣品,22株曲霉于1980—2021年分離篩選自發酵醬油醬醪樣品。
1.1.2 材料與試劑
面粉、麩皮、蠶豆,市售;脫脂奶粉、L-亮氨酸-對硝基苯胺、果膠、半乳糖醛酸,生工生物工程(上海)股份有限公司;瓊脂粉、酪氨酸、干酪素、福林酚試劑、葡萄糖、可溶性淀粉、無水乙醇、硫酸、鹽酸、氫氧化鈉、碳酸鈉、三氯乙酸、乳酸、乳酸鈉、磷酸二氫鈉、磷酸氫二鈉、硼砂、4-硝基苯胺、三(羥甲基)氨基甲烷、甲醛、酚酞、鄰苯二甲酸氫鉀、磺基水楊酸、3,5-二硝基水楊酸、酒石酸鉀鈉、苯酚、硫酸鈉、醋酸、醋酸鈉、碘、碘化鉀、羧甲基纖維素鈉,國藥集團化學試劑有限公司;Miracloth,Merck公司。
1.1.3 培養基
PDA培養基購自國藥集團化學試劑有限公司,按試劑瓶說明配制。
酸性脫脂奶粉培養基:A液為25 g/L脫脂奶粉水溶液,B液為20 g/L瓊脂水溶液。A液與B液分別115 ℃滅菌30 min,使用時在無菌環境下按體積比2∶3 混合,并用鹽酸調節pH至3.0。
種曲培養基∶按照麩皮與面粉質量比7∶3在250 mL 三角瓶中加入20 g過10目篩的干料,并加入干料量70%(質量分數)的水,拌勻。121 ℃滅菌20 min。
1.2 儀器與設備
電子分析天平、pH計,Mettler Toledo公司;高壓濕熱自動蒸汽滅菌鍋,Tomy公司;超凈工作臺,蘇州凈化設備有限公司;培養箱,上海森信實驗儀器有限公司;高速離心機,Eppendorf公司;CytationTM3多功能酶標儀,BioTek公司;BX51光學顯微鏡,Olympus公司;Quanta 200掃描電子顯微鏡,Fei公司;L-8900氨基酸分析儀,Hitachi公司;KjeltecTM8000凱氏定氮儀,FOSS公司;SBA-40X生物傳感分析儀,濟南研科實驗儀器有限公司。
1.3 實驗方法
1.3.1 優質米曲霉的獲得
(1)菌種培養與孢子懸浮液的制備
將曲霉菌種在PDA平板上點種,30 ℃恒溫培養3~5 d。待產孢充分后,每個平板加入適量無菌水,用無菌涂布棒在菌絲表面輕輕刮拭,將孢子刮下。將收集到的孢子洗脫液搖勻,用Miracloth對洗脫液進行過濾,收集濾液,即獲得孢子懸浮液,置于4 ℃保存。
(2)高產酸性蛋白酶曲霉菌株的篩選
將孢子懸浮液搖勻后取適量用于血球計數,獲得孢子懸液母液的濃度。將母液梯度稀釋至孢子濃度為106個/mL,接種100 μL于直徑為150 mm的篩選培養基,每平板8株,30 ℃恒溫培養3 d,挑選在pH 3.0的脫脂奶粉培養基中透明圈/菌落直徑比均大的菌株。篩選時以米曲霉滬釀3.042為對照,設置3個平行。
(3)菌落的形態學觀察
取培養成熟的培養基平板,肉眼觀察菌落形態特征,掃描電子顯微鏡觀察生物精細結構,特別是菌絲分支情況及分生孢子梗結構,參照《真菌鑒定手冊》對菌株進行形態學鑒定[12]。
(4)系統發育樹構建
對菌株LBM 30007、LBM 30008及米曲霉滬釀3.042 進行全基因組測序及拼接,信息公布于NCBI GenBank數據庫(https://www.ncbi.nlm.nih.gov/genbank/),項目登錄號為PRJNA800656;另外,從NCBI基因組數據庫(https://www.ncbi.nlm.nih.gov/genome/)獲取8株曲霉屬黃綠組菌株、4株非黃綠組曲霉菌株、1株青霉及1株粗糙脈孢霉的全基因組序列[13]。構建前述17株霉菌的系統發育樹,建樹時,OrthoFinder v2.4.1[14]查找同源基因→MAFFT[15]多序列比對→ Gblocks(http://molevol.cmima.csic.es/castresana/Gblocks_ server.html)去除分歧和模糊對齊的位點,調取保守區域→SeqKit(https://bioinf.shenwei.me/seqkit/)連接→ IQ-TREE v1.6.12(ht- tp://www.iqtree.org/)確定最佳氨基酸替代模型后構建最大似然系統發育樹→iTOL(https://itol.embl.de/)進化樹可視化及美化。
1.3.2 制曲工藝
種曲制作:將平板培養菌種的孢子用接種針接入種曲培養基,搖勻后30 ℃培養4 d,每日攪拌使曲料松散。
蠶豆曲制作:將蠶豆瓣用自來水沖洗3次除雜,95 ℃燙瓣20 s,再將蠶豆在45 ℃清水中浸泡20 min,瀝干水分。按干蠶豆瓣與小麥粉的質量比100∶30進行拌粉。按6.75×106個孢子/g干蠶豆瓣的比例加入種曲,混合均勻后置于恒溫恒濕培養箱中培養(0~20 h時,控制溫度30 ℃、濕度90%;20 h至結束,控制溫度28 ℃、濕度80%)。當曲料逐漸出現嫩黃綠色孢子后(約72 h),即可出曲,檢測成曲的酶活力及氨基酸含量。
多菌種混合制曲時,米曲霉LBM 30008分生孢子占比30%,米曲霉LBM 30007占比30%,米曲霉滬釀3.042占比40%,種曲接種量同上(6.75×106個孢子/g干蠶豆瓣)。
1.3.3 檢測方法
(1)孢子數測定
三角瓶種曲克孢子數測定按照SB/T 10315—1999 《孢子數測定法》規定的方法進行測定。
(2)酶活力測定
粗酶液制備:準確稱取2.00 g種曲或大曲,充分研磨,去離子水或緩沖液定容至20 mL后40 ℃水浴1 h,每隔10 min攪拌l次,用濾紙過濾,濾液即為待測酶液,用于后續酶活力測定。
淀粉酶活力測定參照褚清龍等[16]的方法,在40 ℃,1 g曲樣1 min水解1 mg淀粉的酶量定義為1個酶活力單位。糖化酶、果膠酶、纖維素酶活力測定采用DNS法[17],在40 ℃、pH 4.8條件下,1 min催化水解淀粉產生1 mg葡萄糖的酶量定義為1個糖化酶活力單位;pH 4.4、40 ℃水浴條件下,1 min催化果膠質水解產生1 μg半乳糖醛酸的酶量定義為1個果膠酶活力單位;在40 ℃、pH 4.8條件下,1 h水解CMC產生相當于1 mg葡萄糖的酶量定義為1個纖維素酶活力單位。蛋白酶活力按照GB/T 23527—2009《蛋白酶制劑》規定的方法進行測定,在40 ℃下1 min水解酪蛋白產生1 μg酪氨酸,定義為1個蛋白酶活力單位。氨肽酶活力測定時以L-亮氨酸-對硝基苯胺為底物,在40 ℃、pH 8.0條件下,1 min水解亮氨酸對硝基苯胺生成1 μg對硝基苯胺所需的酶量定義為1個酶活力單位[18]。
(3)理化指標檢測
氨基酸態氮檢測參照GB 5009.235—2016 《食品安全國家標準 食品中氨基酸態氮的測定》方法。游離氨基酸測定具體操作參考已有研究[19],即樣品預處理方法為取4 g樣品加入16 mL超純水中,振蕩混勻后,冰浴超聲30 min;將超聲后的液體于10 000 r/min,4 ℃ 離心5 min,取1 mL上清液加入等體積的10%磺基水楊酸,4 ℃靜置4 h以沉淀蛋白質,10 000 r/min,4 ℃ 離心10 min,0.02 mol/L HCl稀釋至上機濃度,過膜后進氨基酸分析儀。
1.4 數據處理
采用Excel處理數據,表示為平均值±標準差;采用Origin 2021b繪制圖表;采用TBtools繪制熱圖,并對每一列數據進行標準化處理。
2 結果與分析
2.1 高產酸性蛋白酶曲霉菌株的篩選
為獲得在酸性條件下具有較高蛋白降解活力的菌種,本研究在江南大學釀造微生物與應用酶學研究室菌種庫中獲得曲霉50株,并通過檢測pH 3.0條件下脫脂奶粉培養基中透明圈大小初篩具有較高酸性蛋白酶活力的曲霉菌株。如圖1所示,曲霉LBM 30007、LBM 30008在酸性環境水解酪蛋白能力較強,透明圈/菌落直徑比大于米曲霉滬釀3.042(圖1),用于后續研究。

30007-曲霉LBM 30007;30008-曲霉LBM 30008;3042-米曲霉滬釀3.042圖1 高產酸性蛋白酶曲霉菌株篩選Fig.1 Screening of aspergillar strains with high-producing acid protease
2.2 菌株種屬鑒定
2.2.1 形態學鑒定
將如上2株曲霉LBM 30007、LBM 30008與米曲霉滬釀3.042在PDA培養基中培養5 d,如圖2所示,3種曲霉菌種在形態學上有明顯差異。菌株LBM 30007在PDA培養基上培養成熟時,菌落質地為絲絨狀,顏色為黃綠色,邊緣不規則(圖2-a)。菌株LBM 30008菌落為橄欖黃色,絲絨狀,具有不明顯輻射狀溝紋,邊緣整齊(圖2-b)。滬釀3.042菌落為茶綠色,絮狀,黃綠色邊緣相對整齊(圖2-c)。利用顯微鏡同時放大1 200倍,觀察發現,3種曲霉分生孢子梗均發生于基質或氣生菌絲,分生孢子梗莖粗糙,分生孢子頭呈輻射狀,頂囊為球型,表面可育,產孢結構單層并產生球型、粗糙分生孢子(圖2-d~圖2-f)。然而,在分生孢子直徑方面,菌株LBM 30007和LBM 30008大于米曲霉滬釀3.042。
依據《真菌鑒定手冊》、與米曲霉滬釀3.042的菌落形態和顯微形態進行比對,基本可以確認LBM 30007和LBM 30008生物學分類為曲霉屬(Aspergillus)黃綠組(Flavi)。
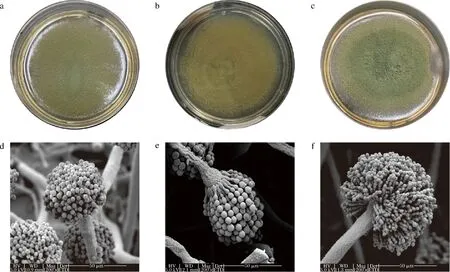
a-菌株LBM 30007的菌落形態;b-菌株LBM 30008的菌落形態;c-米曲霉滬釀3.042的菌落形態;d-菌株LBM 30007的顯微形態;e-菌株LBM 30008的顯微形態;f-米曲霉滬釀3.042的顯微形態圖2 菌株LBM 30007、LBM 30008及米曲霉滬釀3.042的菌落形態和顯微形態Fig.2 Colony and microscopic morphology of strain LBM 30007,LBM 30008, and A.oryzae HN 3.042
2.2.2 系統發育分析
為明確菌株LBM 30007和LBM 30008的生物學分類地位和系統發育關系,選取9株曲霉屬環繞亞屬黃綠組菌株(A.leporisCBS 151.66、A.coremiiformisCBS 553.77、A.alliaceusCBS 536.65、A.pseudonomiaeCBS 119388、A.tamariiCBS 117 626、A.transmontanensisCBS 130015、A.flavusNRRL 3357、A.oryzaeRIB40及A.oryzaeHN 3.042)、3株曲霉屬環繞亞屬非黃綠組菌株(A.nigerATCC 1015、A.terreusNIH2624和A.steyniiIBT 23096)、1株曲霉屬巢狀亞屬菌株(A.nidulansFGSC A4)、1株青霉屬菌株(Penicilliumrubens43M1)及1株粗糙脈孢霉(NeurosporacrassaOR74A),比較17株霉菌的全基因組,基于單拷貝直系同源基因構建系統發育樹(圖3)。
系統發育關系如圖3所示,進化樹拓撲結構及分類學分類與前人研究一致[13]。菌株LBM 30007和LBM 30008為曲霉屬黃綠組,驗證了形態學鑒定結論。另外,菌株LBM 30007和LBM 30008與日本米曲霉RIB 40、中國米曲霉滬釀3.042親緣關系最為接近,可進一步判斷其屬于米曲霉。
綜合形態學鑒定及系統發育分析結果,可以判斷菌株LBM 30007和LBM 30008均為米曲霉。
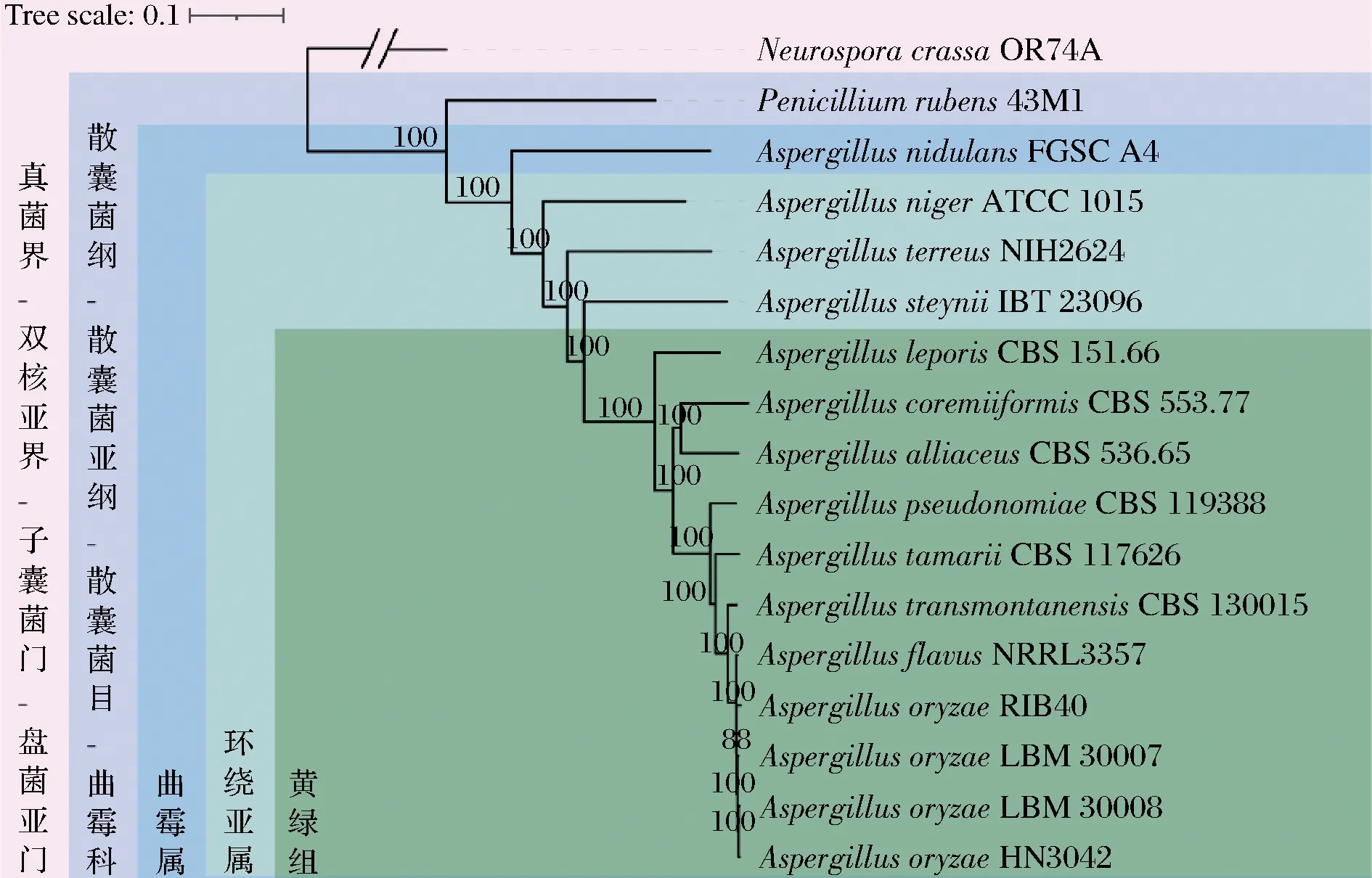
圖3 菌株LBM 30007、LBM 30008與其他15株真菌的系統發育樹Fig.3 Phylogenetic tree of strain LBM 30007,LBM 30008,and 15 other fungi
2.3 米曲霉的基礎發酵表型特性
米曲霉的基礎發酵特征是判斷其是否適合作為制曲菌種的基礎。在本研究中,作者利用蒸煮麩皮面粉為培養基,分別使用米曲霉LBM 30007、LBM 30008及滬釀3.042制作種曲,觀察種曲感官特征,測定產孢情況、水解酶活力等制曲關鍵指標,挖掘不同米曲霉的生產應用潛能。
2.3.1 米曲霉產孢數量評價
米曲霉產孢數量是曲種質量評價中的關鍵指標之一[20],高產孢曲種有利于大幅提升種曲生產效率,因此,一般要求曲種產孢量不低于6×109個/g干基。如表1所示,經過4 d的培養,米曲霉滬釀3.042產生大量分生孢子(1.50×1010個/g干基);相較而言,米曲霉LBM 30007和LBM 30008產孢數量較少,分別為7.25×109個/g干基及4.38×109個/g干基。從產孢數量來看,米曲霉滬釀3.042仍擁有絕對優勢。米曲霉LBM 30007滿足曲種產孢量的要求,米曲霉LBM 30008接近曲種產孢量的基本要求。

表1 種曲質量評價Table 1 Quality evaluation of seed koji
2.3.2 米曲霉酶系特征分析
酶系特征,特別是水解酶系特征,是評價曲種質量的關鍵指標之二。經過4 d的培養,3株米曲霉分泌產生的淀粉酶、糖化酶、果膠酶、纖維素酶、亮氨酸氨肽酶、蛋白酶(酸性、中性、堿性)活力如圖4所示,米曲霉LBM 30007酶系最為均衡,其中,糖化酶活力較高,有助于淀粉質原料降解。另外,LBM 30007產生的酸性、堿性及中性蛋白酶活力也極具優勢,結合孢子產生性能,本研究認為米曲霉LBM 30007是一種有潛力的制曲用菌。相反地,米曲霉LBM 30008具有較高的淀粉酶和果膠酶活力,其他水解酶活力整體較低。然而,該菌種的孢子萌發時間極短(未發表數據),有希望在制曲過程中抑制雜菌污染。綜合判斷,2株米曲霉LBM 30007及LBM 30008在孢子形成、孢子萌發速率及水解酶活力方面各有特點,有希望在郫縣豆瓣蠶豆醅發酵方面發揮作用。

圖4 種曲酶活力Fig.4 Enzymatic activities of seed koji
2.4 單菌與混菌制曲比對
為進一步探究米曲霉LBM 30007和LBM 30008在郫縣豆瓣蠶豆曲制作過程中的制曲性能,改善米曲霉滬釀3.042單菌制曲酶系不均衡可能導致的原料降解不充分問題,本研究分別使用米曲霉滬釀3.042、LBM 30007、LBM 30008純菌種制曲、組合上述3株米曲霉進行復合菌劑制曲,檢測成曲酶活力及與蛋白質利用相關的理化指標。
2.4.1 制曲過程曲料感官變化
本研究模擬郫縣豆瓣蠶豆曲原料預處理過程及制曲過程,分別利用米曲霉滬釀3.042、LBM 30007、LBM 30008三株米曲霉進行純種制曲及復合制曲,并跟蹤監測單菌株及復合菌劑制作郫縣豆瓣蠶豆曲過程中曲料的感官變化。如圖5所示,制曲第1天時,曲料白色菌絲叢生,無孢子,微有蠶豆香,質地柔軟,富有彈性,稍有結塊,需將曲料打散;第2天時,菌絲豐滿,幾乎布滿嫩綠色孢子,有曲香味,質地較硬且蓬松;第3天時,孢子豐滿,呈黃綠色,曲香濃郁,無酸味、氨味等不良異味,質地較硬且蓬松。然而,與復合菌種制曲相比,單一菌株制曲顯示菌種生長較慢、曲香稍欠缺。因此,本研究推測復合制曲有提高原料利用率,縮短制曲周期,改善成曲風味的潛力。

圖5 制曲過程中曲料的外觀變化Fig.5 Appearance changes during the process of koji-making
2.4.2 成曲酶活力與氨基態氮含量
蛋白酶將原料中的蛋白質分解為胨、多肽、低分子肽和氨基酸,是非揮發性滋味物質及揮發性風味物質的前體。另外,亮氨酸氨肽酶從多肽N端水解氨基酸,有助于苦味的去除、鮮味物質的積累。在郫縣豆瓣蠶豆曲制備過程中,單菌株及復合菌株制曲產蛋白水解酶情況如圖6-a、圖6-b所示,顯示不同菌株制曲酶活力存在較大差異。米曲霉LBM 30007在中性、酸性蛋白酶及亮氨酸氨肽酶活力分別為滬釀3.042的1.9倍、1.2倍和1.8倍,有利于蛋白質原料的充分降解。另外,復合菌種制備的曲料中,酸性、中性蛋白酶及亮氨酸氨肽酶活力均較單菌株制曲有所提升,分別達到153.54、703.22、392.51 U/g。其中,酸性蛋白酶活力較滬釀3.042制曲提高了23.25%。如上結果表明,復合制曲中,菌株之間的競爭協同作用正向影響了蛋白水解酶的產生,能夠有效提高蠶豆曲中蛋白酶活力及蛋白酶系均衡度。
此外,復合菌種制曲的優勢也反映在蠶豆成曲的氨基酸態氮含量上(圖6-c)。氨基酸態氮是判定發酵產品發酵程度的特性指標。如圖6-c所示,采用復合米曲霉菌株制曲時,成熟的蠶豆曲中氨基酸態氮含量高于單菌制曲,較滬釀3.042制曲提高了0.14 g/100g。

a-蛋白水解酶;b-亮氨酸氨肽酶;c-氨基酸態氮圖6 成曲酶活力及氨基酸態氮含量Fig.6 Enzymatic activities and amino acid nitrogen content of koji
2.4.3 成曲游離氨基酸測定及分析
菌株及復合菌株制備的郫縣豆瓣蠶豆曲的游離氨基酸結果如表2所示。不同菌株制曲的游離氨基酸總量差異不大,分布在18.36~21.16 g/L,但游離氨基酸組成差異較大。從氨基酸風味及其占全部氨基酸比重來看,米曲霉LBM 30008制曲鮮味氨基酸(谷氨酸、天冬氨酸)比重最大,為21.12%,滬釀3.042 鮮味氨基酸占比最小(18.36%);米曲霉LBM 30007制曲甜味氨基酸(蘇氨酸、絲氨酸、甘氨酸、丙氨酸、脯氨酸、賴氨酸)比重最大,為36.57%,混菌制曲最小(35.39%);米曲霉滬釀3.042制曲苦味氨基酸(甲硫氨酸、組氨酸、精氨酸、異亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、纈氨酸)比重最大,為45.11%,LBM 30008最小(42.88%)。綜上,米曲霉LBM 30008制曲后,游離氨基酸,特別是鮮味及甜味氨基酸比例更優。從氨基酸比例及絕對含量來看,復合菌劑制曲產生了最高濃度的游離氨基酸,且鮮味、甜味、苦味氨基酸含量均高于單菌種制曲。另外,復合菌劑制曲較滬釀3.042制曲產生了更高比例的鮮味氨基酸(11.33%),甜味及苦味氨基酸含量輕微下降,分別下降了3.11%和2.31%。由此推測,復合菌株制備的郫縣豆瓣鮮味可能更加濃郁。
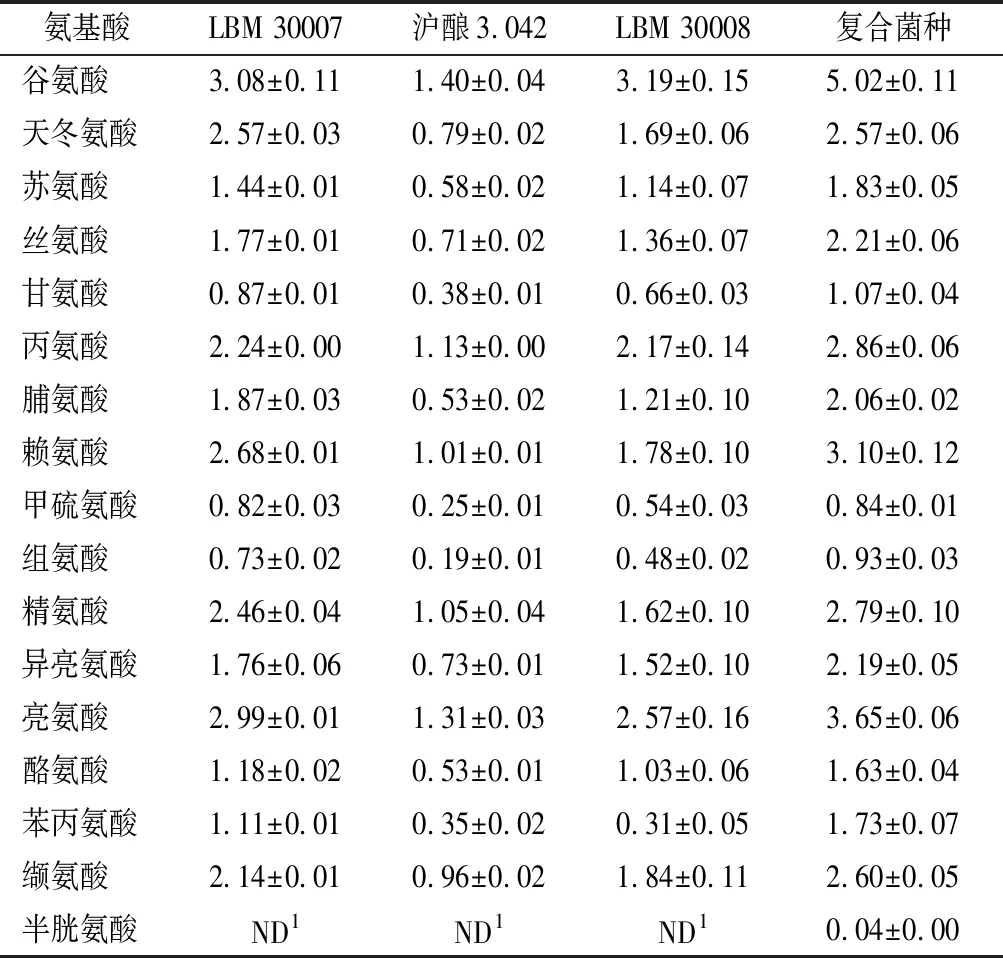
表2 成曲游離氨基酸含量 單位:g/L
3 討論與結論
本研究從江南大學釀造微生物學與應用酶學研究室初篩獲得2株在酸性條件下具有較高蛋白水解酶活性的菌株,分別為曲霉LBM 30007及LBM 30008。經表型(包括顯微表型)及系統發育分析,鑒定如上2株菌為米曲霉。對米曲霉滬釀3.042、LBM 30007及LBM 30008進行基礎發酵表型特性分析,發現與滬釀3.042相比,米曲霉LBM 30007在蛋白及淀粉水解酶活力方面具有優勢,LBM 30008在孢子萌發速率方面有優勢,因此,將3種米曲霉進行組合制曲,可能會提高郫縣豆瓣蠶豆醅蛋白降解效率。將3株米曲霉進行復合制曲,用于制備郫縣豆瓣蠶豆醅,結果顯示,復合制曲的酸性和中性蛋白酶活力、亮氨酸氨肽酶活力、氨基酸態氮含量及鮮味氨基酸含量均有所提升,彌補了LBM 30007、LBM 30008繁殖能力較差以及滬釀3.042酶系不均衡的缺陷,有助于制備品質更為優良、風味更加濃郁的郫縣豆瓣成曲。本研究鑒定獲得的優質米曲霉菌株及復合菌劑,對郫縣豆瓣在內的高鹽高氮發酵食品具有潛在應用價值。

