異源表達黑芥子酶及其用于制備蘿卜硫素的研究
黃河鷗,鄭璞,吳丹,陳鵬程
(江南大學 生物工程學院,工業生物技術教育部重點實驗室,江蘇 無錫,214122)
黑芥子酶(myrosinase, MYR, EC 3.2.1.14 7)是一種糖苷水解酶,可以催化硫代葡萄糖苷生成一分子葡萄糖和一分子中間體糖苷配基,不穩定的糖苷配基自發重排生成異硫氰酸酯等物質[1]。黑芥子酶存在于植物、昆蟲和微生物中[2-3],但在昆蟲及微生物中均活性較低,目前主要來源為植物中提取[4],但該酶提取過程中容易受重金屬離子危害,對壓力等較為敏感[5],易被氧化還原,提取純化困難。
蘿卜硫素作為一種自然界存在的活性最強[6]的異硫氰酸酯類化合物,具有很強的抗氧化、防癌、抗癌活性,可以降低多種癌癥的發病率[7-8]。自西蘭花副產物[9]、西蘭花[10]、西蘭花種子[11]中提取得到蘿卜硫素產量分別為151.39 μg/g、(408.74±0.83)μg/g DW、14.80 mg/g;以鄰苯二甲酰亞胺鉀鹽[12]、三甲基硫丙醇[13]為原料合成蘿卜硫素,收率分別為16.0%、4.4%。由于植物中存在上皮硫特異蛋白(epithiospecifier protein,ESP)會使中間體轉化為蘿卜硫腈等不具有生物活性的物質[14-15],提取轉化率及產品純度較低,提純復雜。化學合成需要大量使用有機試劑,副產物多,且蘿卜硫素存在手性原子[16],合成的蘿卜硫素比天然蘿卜硫素安全性低,功能減弱。
因此,高效表達異源黑芥子酶并對其應用開發具有重要意義。在大腸桿菌中誘導表達油菜來源黑芥子酶[17],濃縮后得到酶液,酶活力為3.1×10-3U/mg,擬南芥黑芥子酶在解脂耶氏酵母中表達后可使每1 g蘿卜種子生成6.1 mg萊菔素[18]。本研究選用西蘭花來源黑芥子酶BoTGG1[19]和甘藍蚜蟲來源黑芥子酶BMYR[20]進行異源表達,糖基化預測表明該酶具有糖基化位點,畢赤酵母(Pichiapastoris)表達外源基因具有一定的翻譯后修飾能力,得到的蛋白質具有一定程度上的糖基化修飾作用,本文選擇P.pastoris作為異源表達的宿主,誘導表達后得到具有活性的黑芥子酶粗酶液,并利用該粗酶液催化西蘭花種子提取液合成蘿卜硫素,為蘿卜硫素的制備提供參考。
1 材料與方法
1.1 材料
1.1.1 菌株、質粒及引物
大腸桿菌(Escherichiacoli)JM109、P.pastorisGS115、P.pastorisX33以及質粒pPIC9K、pPICZα均保藏于本實驗室。西蘭花來源黑芥子酶BoT-GG1、甘藍蚜蟲來源黑芥子酶BMYR、基因及所用引物皆于金唯智生物科技公司合成,如表1所示。

表1 本研究中所用引物序列Table 1 Primers used in this study
1.1.2 酶、試劑及培養基
PrimeSTAR HS DNA Polymerase、QuickCutSacI,TaKaRa公司;質粒DNA抽提試劑盒、DNA膠回收試劑盒、博萊霉素,北京索萊寶科技有限公司;基因、引物的合成以及測序由金唯智生物科技有限公司完成;SDS-PAGE凝膠快速配制試劑盒,碧云天生物技術有限公司;標準品蘿卜硫苷(純度≥ 98%)、蘿卜硫素(純度≥ 95%),上海源葉生物科技有限公司。所用培養基為LB、MD、YPD、BMGY、BMMY及BSM培養基。
1.1.3 儀器與設備
臺式高速冷凍離心機,上海盧湘儀儀器有限公司;PCR儀,德國Eppendorf公司;高效液相色譜,美國Waters公司;Amethst C18-H反向柱(4.6 mm×250 mm,5 μm),美國賽分科技有限公司;生物傳感分析儀,西爾曼科技有限公司。
1.2 實驗方法
1.2.1 表達載體的構建
以BoTGG1-F/R為引物擴增出目的基因botgg1基因片段,以BOTGG1-9K-F/R為引物擴增出載體pPIC9K片段,通過瓊脂糖凝膠電泳驗證PCR產物,并使用膠回收試劑盒分別回收botgg1基因片段和pPIC9K載體片段。通過一步克隆試劑盒將回收的片段和載體按照2∶1的摩爾比,在37 ℃下反應30 min連接。以同樣的方法分別連接bmyr基因片段和pPIC9K載體片段,bmyr基因片段和pPICZα載體片段。以上連接產物均熱激法轉化至大腸桿菌E.coliJM109感受態細胞中,37 ℃孵育30 min后涂布在對應抗性平板上,獲得的轉化子進行菌落PCR驗證,對篩選得到的陽性轉化子擴增,并提取質粒測序。
1.2.2 重組畢赤酵母的構建
將測序驗證正確質粒pPIC9K-BoTGG1、pPIC9K-BMYR和pPICZα-BMYR均用SacI線性化,PCR產物純化試劑盒純化回收后,分別電轉法轉入畢赤酵母P.pastorisGS115感受態中,同時質粒pPICZα-BMYR還轉入畢赤酵母P.pastorisX33感受態中。于30 ℃孵育2 h后涂布于MD平板,30 ℃培養2~3 d后,逐步挑取單菌落于含有0.5、1、2、4 mg/mL相應抗性的平板上進行抗性篩選,得到重組菌株P.pastorisGS115/pPIC9K-BoTGG1、P.pastorisGS115/pPIC9K-BMYR、P.pastorisGS115/pPICZα-BMYR和P.pastorisX33/pPICZα-BMYR。
1.2.3 培養方法
搖瓶培養:將重組畢赤酵母工程菌株接種到30 mL BMGY培養基中,30 ℃、220 r/min培養24 h,然后4 ℃、5 000 r/min離心5 min,除去上清液后收集菌體,菌體用30 mL BMMY誘導培養基重懸后于28 ℃、220 r/min培養96 h,每24 h添加1次終體積分數為1%的甲醇進行誘導。培養結束后離心并保留上清液,為黑芥子酶粗酶液。
發酵罐培養:挑取單菌落接種于100 mL YPD培養基中,30 ℃、220 r/min培養24 h左右直至OD600值為13,接種至900 mL BSM發酵培養基中。設置溫度為30 ℃、pH為5,通氣量2 L/min,初始轉速400 r/min并設置溶氧關聯攪拌,控制溶氧為20%,最高轉速為800 r/min。當發酵約20 h時,培養基中甘油耗盡,溶氧值(dissolved oxygen,DO)下降為0左右又回升時,進入甘油補料階段開始補加50%甘油(4.92 mL/L PTM1)。甘油補料培養至OD600值為120左右時停止,并饑餓培養1 h,DO上升后,根據菌株生長情況及DO補加含12 mL/L PTM1的甲醇,溫度設置為25 ℃ 進行誘導培養,每隔12 h取樣,誘導至OD600值不再顯著增加后停止發酵。
1.2.4 蘿卜硫素的合成及酶活力測定
稱取1 g西蘭花種子清洗后于110 ℃烘箱中30 min使內源酶失活,研磨粉碎后加入10 mL去離子水,在80 ℃、150 r/min水浴搖床中反應2 h,8 000 r/min離心2 min,并用0.22 μm濾頭過濾得到西蘭花種子提取液,即5 g/L蘿卜硫苷溶液。取40 μL黑芥子酶粗酶液與一定量的西蘭花種子提取液混合,37 ℃反應30 min后利用HCl調節pH至2~3終止反應,高效液相色譜測定產物蘿卜硫素濃度。
以蘿卜硫苷(10 mg/mL)為底物,在pH 5.5,37 ℃ 的條件下反應30 min,煮沸5 min終止反應,通過生物傳感分析儀測定生成葡萄糖量,計算酶活力。每分鐘催化生成1 μmol葡萄糖所需要的酶量,定義為1個活力單位(U)。
1.2.5 催化條件優化
進行單因素試驗優化制備蘿卜硫素條件。取40 μL黑芥子酶粗酶液分別與40、80、120、160 μL的西蘭花種子提取液混合,并添加去離子水至200 μL,于 37 ℃ 反應30 min,選取產物濃度最高時的底物濃度作為催化反應底物濃度。確定催化反應底物濃度后,利用相應催化體系在37 ℃分別反應10、20、30、40、50、60、70、80 min,測定產物濃度,確定產物濃度最高時時間作為催化反應時間。在確定的催化底物濃度及催化時間下,分別在pH值為3.5、4.5、5.5、6.5、7.5、8.5條件下反應,選取產物濃度最高時作為催化反應pH。在確定的催化底物濃度、時間及pH條件下,分別于20、30、37、45、50、60、70、80 ℃下進行催化反應,選取產物濃度最高時溫度作為催化反應溫度。
1.2.6 蘿卜硫素的定量檢測
采用高效液相色譜法進行蘿卜硫素的定量檢測。
檢測條件:色譜柱為Amethyst C18-H(4.6 mm×250 mm,5 μm)反相色譜柱,檢測波長205 nm,柱溫30 ℃,流動相為V(乙腈)∶V(超純水)=20∶80,進樣量為10 μL,流速1 mL/min。
2 結果與分析
2.1 黑芥子酶重組菌株的構建
以bmyr、botgg1基因為模板,進行目的片段的擴增得到相應的PCR產物,并經過瓊脂糖凝膠電泳驗證其大小。目的基因bmyr、botgg1大小分別為1 404、1 647 bp(圖1-a)。將各片段使用無縫克隆試劑盒連接后,將獲得的重組質粒導入到E.coliJM109的感受態中,涂布于含相應抗性的平板,將轉化子菌落PCR驗證(圖1-b),得到陽性轉化子。挑取陽性轉化子培養,并提取重組質粒進行測序驗證,測序正確,質粒pPIC9K-BoTGG1、pPIC9K-BMYR和pPICZα-BMYR構建成功。將構建好的質粒轉入畢赤酵母感受態中,獲得重組菌株P.pastorisGS115/pPIC9K-BoTGG1、P.pas-torisGS115/pPIC9K-BMYR、P.pastorisGS115/pPICZα- BMYR和P.pastorisX33/pPICZα-BMYR。
2.2 黑芥子酶重組菌發酵特性評價
對重組菌株進行搖瓶發酵,各個菌株OD600值隨著誘導時間的延長而增大,菌株生長情況良好。誘導96 h后生長狀況最好菌株為X33/pPICZα-BMYR,OD600值為70.9(圖2-a),蛋白質量濃度為0.15 g/L(圖2-b),明顯高于其余菌株,黑芥子酶在畢赤酵母中良好表達。酶活力測定(圖2-c)表明,GS115/pPIC9K-BoTGG1粗酶液酶活力最低,菌株GS115/pPICZα-BMYR酶活力高于GS115/pPIC9K-BMYR,相比質粒pPIC9K,質粒pPICZα似乎更有利于黑芥子酶的表達;菌株X33/pPICZα-BMYR粗酶液酶活力可達0.083 U/mL,畢赤酵母X33比GS115更有利于黑芥子酶的生產。利用各粗酶液進行催化反應后測定得到蘿卜硫素濃度(圖2-d),所得結果與酶活力結果相符,菌株X33/pPICZα-BMYR所產酶催化后得到蘿卜硫素濃度最高。鑒于以上結果,重組表達菌株X33/pPICZα-BMYR各項性能均優于其余菌株,故后續研究該菌株發酵產重組黑芥子酶的情況。

a-PCR擴增電泳圖(M-DNA marker;1、2-目的基因bmyr 的PCR產物;3、4-目的基因botgg1的PCR產物);b-轉化子的PCR鑒定結果(M-DNA marker;1~4-陽性轉化子中BMYR的PCR產物;5~8-陽性轉化子中BoTGG1的PCR產物)圖1 PCR擴增和轉化子的PCR鑒定結果電泳圖Fig.1 Agarose gel electrophoresis of PCR amplification and identification of transformant
2.3 3 L發酵罐高密度培養
菌株X33/pPICZα-BMYR的高密度發酵培養過程在3 L發酵罐中進行,培養19.4 h至培養基中甘油完全消耗,發酵罐中DO值下降至將近為0后迅速回升,達到78%,此時OD600值為80,開始進行甘油補料培養,以增加生物細胞量。培養至OD600值達到120時,停止補加甘油并饑餓培養1 h,開始甲醇補料培養誘導產酶。在誘導過程中菌體生長良好,甲醇誘導120 h時,OD600值達到545且不再增加(圖3-a)。黑芥子酶BMYR理論分子質量為53.7 kDa,將發酵過程所取樣品進行SDS-PAGE分析,由于在畢赤酵母中表達時發生糖基化反應,所以結果顯示在約63 kDa處有明顯條帶(圖3-b),即為黑芥子酶表達蛋白。隨著誘導時間的延長,此條帶愈發明顯,酶活力也逐漸增大,誘導120 h時,酶活力為0.64 U/mL,是搖瓶水平的8倍。通過發酵罐補料分批發酵,使得菌株生長旺盛,酶活力得到提升。
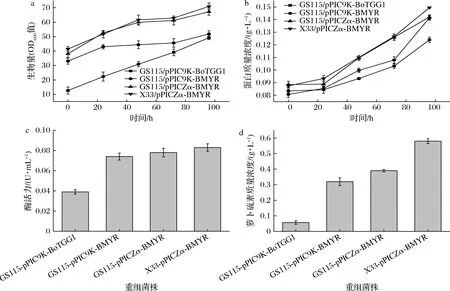
a-生物量;b-蛋白質量濃度;c-酶活力;d-蘿卜硫素質量濃度圖2 重組菌搖瓶發酵性能Fig.2 Fermentation performance of recombinant strains in shaking flasks

a-發酵過程中酶活力和細胞OD600值曲線圖;b-不同時間發酵上清液SDS-PAGE圖圖3 重組菌在3 L發酵罐中高密度發酵過程Fig.3 Time course of recombinant P.pastoris high-cell density fermented in a 3 L fermenter
2.4 重組酶BMYR制備蘿卜硫素
底物濃度對催化反應進行有重要影響,底物濃度過低反應易達到飽和造成酶的浪費,底物濃度過高可能產生抑制作用且造成底物浪費。于底物質量濃度1~4 g/L進行催化反應(圖4-a),產物濃度先是隨著底物濃度的增大而增大,當底物質量濃度為1 g/L時產物質量濃度為0.41 g/L,此時底物全部轉化為產物,反應達到飽和,當底物質量濃度為3 g/L時產物濃度最高,此時產物質量濃度為0.55 g/L,底物質量濃度繼續增加至4 g/L后產物濃度反而下降,此時黑芥子酶可能受到底物抑制作用,MAHN等[21]也曾在西蘭花來源黑芥子酶中發現這種抑制作用。故選擇3 g/L作為催化反應中底物質量濃度。
催化時間對生成產物的濃度有直接的影響,時間過短反應未完全,時間過長時,由于產物蘿卜硫素不穩定,反而降低產物濃度。分別在10~80 min進行催化反應(圖4-b),產物濃度隨著反應時間的延長而增加,當催化時間為60 min時,產物質量濃度為1.15 g/L,此時底物蘿卜硫苷的摩爾轉化率為94.7%,之后產物濃度增加趨勢變緩幾乎不再增加,故選取催化反應時間為60 min。
不同的酶在不同的pH條件下催化效率不同,分別考察黑芥子酶在不同緩沖液,pH在3.5~8.5時的催化效率(圖4-c)。在pH為4.5時反應,催化得到的產物濃度最高,蘿卜硫素含量為1.13 g/L,之后隨著pH的上升,生成蘿卜硫素濃度逐漸下降,蘿卜硫素在酸性條件下更穩定。同時在相同pH的不同緩沖液中,催化后得到產物濃度也不同,這種不同是緩沖液中的不同成分與金屬離子等的結合造成。
反應溫度可以直接影響酶的反應,在一定溫度范圍內,升高溫度可以提高酶的反應速率,但同時高溫可能會使產物蘿卜硫素降解。分別測定反應溫度在20~80 ℃時產物濃度(圖4-d)。隨著反應溫度的升高,產物蘿卜硫素的濃度先上升,在反應溫度為45 ℃ 時,產物質量濃度最高,達到1.21 g/L,此時底物蘿卜硫苷的摩爾轉化率為99.6%,之后隨著溫度的上升,產物濃度開始下降,高溫容易使蘿卜硫素降解且加快了酶活力的衰減速度。當催化溫度為60 ℃時,產物質量濃度為1.11 g/L,是45 ℃時的91.7%,催化溫度繼續上升后產物濃度開始急劇下降,溫度為80 ℃時,蘿卜硫素質量濃度為0.16 g/L,僅為最高濃度的13.2%。在45 ℃時得到最高產物濃度,因此選取45 ℃作為催化反應溫度。
綜上結果,重組酶產蘿卜硫素的反應條件為底物質量濃度3 g/L、反應時間60 min、反應pH 4.5、反應溫度45 ℃。在此條件下,可生成蘿卜硫素1.21 g/L,即每1 g西蘭花種子可生成蘿卜硫素20.2 mg。添加外源黑芥子酶可以顯著提高西蘭花種子中蘿卜硫素的產量[7],但目前此類研究相對較少,而對西蘭花內源酶生成蘿卜硫素的反應參數進行優化,得到蘿卜硫素的最大產量為每1 g西蘭花種子可生成蘿卜硫素14.8 mg[11]。相比而言,由重組菌株X33/pPICZα- BMYR所得到的黑芥子酶能夠有效水解西蘭花種子中的蘿卜硫苷生成蘿卜硫素,在蘿卜硫素的大規模制備中顯示出應用潛力。

a-底物質量濃度;b-催化時間;c-催化pH;d-催化溫度圖4 反應條件對蘿卜硫素制備的影響Fig.4 Effects of reaction conditions on the preparation of sulforaphane
3 結論
本研究首次將來源于西蘭花的黑芥子酶基因bot-gg1及甘藍蚜蟲的黑芥子酶基因bmyr在畢赤酵母中異源整合表達,成功獲得可生產具有活性黑芥子酶粗酶液的菌株。結果表明,載體pPICZα、宿主畢赤酵母X33表達BMYR更適用于黑芥子酶的生產。重組菌X33/pPICZα-BMYR在3 L發酵罐上進行高密度發酵,誘導表達120 h后酶活力為0.64 U/mL,是搖瓶酶活力的8倍。以西蘭花種子提取液為底物,進行催化條件優化后,生成蘿卜硫素達到1.21 g/L,蘿卜硫苷的摩爾轉化率達到99.6%,即每1 g西蘭花種子可生成蘿卜硫素20.2 mg,是目前蘿卜硫素制備的最高水平。本研究一方面探索不同來源黑芥子酶異源表達的可能性,一方面利用所得到黑芥子酶進行催化反應,成功提高蘿卜硫素的產量,因此可為黑芥子酶的生產及蘿卜硫素的制備提供參考。

