常壓室溫等離子誘變篩選高產酯酶的菠蘿蜜果酒釀酒酵母
張雪,吳葉,陳雪雪,陳星光,楊華,陸健*,吳殿輝*
1(工業生物技術教育部重點實驗室,江南大學 生物工程學院,江蘇 無錫,214122)2(糧食發酵與食品生物制造國家工程研究中心(江南大學),江蘇 無錫,214122)3(江蘇省生物活性制品加工工程技術研究中心(江南大學),江蘇 無錫,214122)
菠蘿蜜(ArtocarpusheterophyllusLam.)是一種深受大眾歡迎的熱帶水果,其果味甜、香氣獨特,具有多種生物比活力[1-2],有“熱帶水果皇后”、“齒留香”等美稱。但菠蘿蜜果實采摘期短、不耐貯藏,嚴重制約了菠蘿蜜種植業的發展。因此,菠蘿蜜精深加工的相關研究備受關注[3]。菠蘿蜜果實含糖量高、香氣濃郁、風味獨特,是釀造果酒的上等原料[4];同時有研究認為,菠蘿蜜果酒富含有機酸、多糖、沒食子酸和原兒茶酸,具有抗氧化性和抑制DNA損傷的特性[5]。因此,釀造果酒成為了菠蘿蜜精深加工的一個重要方向。
果酒釀造過程中,果汁在發酵微生物的作用下發生了一系列復雜的生物轉化反應,形成種類豐富、特征各異的揮發性香氣化合物,賦予了酒體不同風格[6]。酵母對菠蘿蜜果酒香氣成分的形成和含量具有重要影響[7]。在釀酒工藝相同的前提下,同品種菠蘿蜜釀造果酒的香氣成分差異主要是釀酒酵母風味酶活力不同引起的[8-9]。風味酶又稱增香酶,是能夠催化風味前體形成風味物質的酶的總稱,如脂肪酶、糖苷酶、酯酶、蛋白酶等[10]。其中,釀酒酵母的酯酶活力與果酒中酯類物質的合成、積累過程密切相關[9]。BARDI等[11]研究發現葡萄汁酒精發酵期間有較高的酯酶活力;PéNICAUD等[12]的研究證實了釀酒酵母細胞中酯酶的存在。酯類化合物具有較低的閾值和濃郁的水果香味,是決定果酒香氣的重要香氣化合物[13],因此,酯酶可以通過調節酒體中酯類物質的濃度來影響果酒的質量[14]。近年來關于酵母與菠蘿蜜果酒香氣之間關系研究多側重于篩選自然菌株提高菠蘿蜜果酒香氣[15]、比較不同商業酵母對果酒香氣成分影響[7]、果酒香氣成分檢測[16]及優化發酵工藝提高果酒香氣[17]等,而關于通過提高釀酒酵母酯酶活力來增強菠蘿蜜果酒香氣品質的研究鮮有報道。
常壓室溫等離子體(atmospheric and room temperature plasma,ARTP)誘變育種指在室溫常壓的條件下,使用高純氦氣產生大量的等離子體流損傷微生物的遺傳物質DNA,從而產生大量突變株的菌種選育方法。與傳統誘變方法相比,該項技術具有突變效率高、安全性高等特點。目前誘變育種研究日趨成熟,可以有效地突變酵母[18]。
因此,本研究首先通過ARTP技術誘變釀酒酵母CS31(從菠蘿蜜果汁自然發酵液中篩選),提高出發菌株的酯酶活力;再評估誘變菌株的各類發酵性能以及產酯酶能力,選擇能順利完成發酵的同時又具有最高酯酶活力的菌株;最后驗證在菠蘿蜜果酒發酵中,該突變菌株的產香能力,以期為菠蘿蜜果酒專屬釀酒酵母的選育提供參考。
1 材料與方法
1.1 材料與儀器
1.1.1 實驗材料
釀酒酵母CS31,由江南大學糧食發酵與食品生物制造國家工程研究中心從菠蘿蜜自然發酵液中分離并在-20 ℃甘油管中保藏;菠蘿蜜汁由海南豪蜜食品有限公司提供;白砂糖購自江蘇省無錫市濱湖區歐尚超市。
YPD固體培養基(質量分數):酵母粉1.0%,蛋白胨2.0%,葡萄糖2.0%,瓊脂粉2.0%;YPD液體培養基(質量分數):酵母粉1.0%,蛋白胨2.0%,葡萄糖2.0%;初篩培養基(質量分數):酵母粉1.0%,蛋白胨2.0%,葡萄糖2.0%,滅菌后加入12%乙醇;發酵培養基(質量分數):蛋白胨2.0%,酵母粉1.0%,硫酸銨0.3%,磷酸二氫鉀0.4%,葡萄糖2.0%,吐溫80 2 mL/L,蒸餾水配制,自然pH;以上培養基的滅菌條件均為115 ℃、0.1 MPa高壓滅菌30 min。菠蘿蜜汁培養基:解凍后的菠蘿蜜汁,按料液比3∶2(g∶mL)加入蒸餾水,混勻后離心留上清液,用白砂糖調整糖度至230 g/L,加入偏重亞硫酸鉀120 mg/L;pH值為5.0的檸檬酸-磷酸緩沖液:0.1 mol/L檸檬酸、0.2 mol/L磷酸氫二鈉。
偏重亞硫酸鉀、蛋白胨、葡萄糖、瓊脂、酵母浸粉、乙醇、硫酸銨、磷酸二氫鉀、氫氧化鈉、氯化鈉、檸檬酸、磷酸氫二鈉、異戊醇和石英砂,國藥集團化學試劑有限公司;對硝基苯基乙酸酯(p-nitrophenyl acetate,p-NPA)、對硝基苯基丁酸酯(p-nitrophenyl butyrate,p-NPB)、對硝基苯基己酸酯(p-nitrophenyl hexanoate,p-NPH)、2-辛醇,上海阿拉丁生化科技股份有限公司;偏重亞硫酸鉀為食品級,2-辛醇為色譜純,其余試劑均為分析純。Premix ExTaqTM,6×DNA LoadingBuffer、2 000 bp DNA Marker、引物ITS1、ITS4,蘇州Genewiz公司。
1.1.2 儀器與設備
Artp-iis ARTP 誘變系統,無錫源清天木生物科技有限公司;SW-CJ-1D 無菌操作臺,蘇州凈化設備有限公司;EPOCH2T酶標儀,美國BioTek公司;LEGEND MICRO17離心機,賽默飛世爾科技公司;SHP-2500低溫生化培養箱,上海精密實驗設備有限公司;Trace1310-ISQ LT ISQ單四級桿氣質聯用儀,美國Thermo Scientific公司;LS-B50L自動高壓蒸汽滅菌器,致微(廈門)儀器有限公司;HYL-C組合式搖床,太倉市強文實驗設備有限公司;GHP-9050隔水式恒溫培養箱,上海一恒科學儀器有限公司;5415D高速離心機,德國Eppendorf股份公司;Eppendorf AG 22331 Hamburg PCR擴增儀,德國艾本德股份公司。
1.2 實驗方法
1.2.1 初始菌株ARTP誘變
取出-20 ℃甘油管保藏的初始菌種CS31,涂布于YPD固體培養基上,30 ℃條件下培養48 h,使其活化。活化結束后,在YPD固體培養基中挑取單菌落,接種至YPD液體培養基,30 ℃條件下振蕩(220 r/min)培養11 h。收集處于對數期的初始菌種CS31,用生理鹽水(0.9%氯化鈉溶液)洗滌2次并稀釋至1.62×107CFU/mL。在金屬載片上均勻涂抹10 μL的菌懸液后,將金屬載片置于誘變系統中,在100 W誘變功率、10 L/min氣流量和2 mm照射距離下,分別誘變0、30、60、90、120、150、180、210 s。待誘變結束,對每個處理樣品進行梯度稀釋,并將稀釋液涂布于YPD固體培養基上,30 ℃恒溫恒濕培養3 d,觀察菌落數并計算致死率。誘變致死率見公式(1):

(1)
1.2.2 誘變菌株的初篩
優良的菌株首先要順利啟動并完成發酵過程。因此,在篩選出具有高酯酶比活力的突變株之前,需要對這些菌株進行一定的初篩。
1.2.2.1 一級篩選
通過高通量篩選耐酒精菌株。將YPD液體培養基(含有12%乙醇)加入96孔板后接入誘變菌株。隨后將孔板在30 ℃條件下振蕩培養(200 r/min)2 d。取出孔板,并用酶標儀測定每個小孔在600 nm波長處的吸光值(OD600)。選取OD600比出發菌株CS31顯著提高的突變株進行二級篩選。
1.2.2.2 二級篩選
采用杜氏小管發酵法篩選出起酵速度快、發酵能力強的菌株。將上步篩選的正向突變菌株,以8%的接種量分別接種到裝有杜氏小管和菠蘿蜜汁培養基(10 mL)的試管中,30 ℃條件下靜置培養8 h后,每隔2 h觀察各菌株的產氣量,記錄菌株的起酵時間和產氣速度。
1.2.2.3 三級篩選
通過菠蘿蜜果酒發酵實驗,篩選出發酵性能優良的菌株。將活化2次后的菌株使用無菌水低溫離心洗滌3次,再使用菠蘿蜜果汁進行重懸。將重懸后的菌株進行菠蘿蜜果酒發酵實驗,主酵結束觀察酒體的色澤和氣味,去除明顯出現異味、酒體渾濁的酒樣。參照GB/T 15038—2006《葡萄酒、果酒通用分析方法》測定剩余酒樣的乙醇、總糖和總酸含量,再次去理化指標不達標的菌株。菠蘿蜜果酒初步發酵條件為料液比3∶2(g∶mL),初始總糖含量230 g/L,酵母接種密度1×107CFU/mL,果膠酶15 U/mL,偏重亞硫酸鉀120 mg/L,發酵溫度20 ℃,發酵時間132 h。
1.2.3 誘變菌株的復篩
將初篩菌株接入YPD液體培養基中30 ℃活化24 h后,再按1%接種量轉接至YPD液體培養基中30 ℃振蕩培養(200 r/min)11 h,隨后按2%接種量再次接入發酵培養基中30 ℃振蕩培養(200 r/min)24 h。將培養好的菌液高速離心去上清液,用緩沖液低溫離心洗滌3次后重懸細胞,以此作為粗酶液測定菌株的酯酶活力。酯酶比活力最高的菌株即為目標菌株。重懸細胞的干重通過將培養好的菌液用蒸餾水低溫離心洗滌3次后,在100 ℃恒溫烘干至恒重獲得。
酯酶活力測定方法參照文獻的報道[14,19],并進行略微修改。具體方法如下:分別在40 μL的p-NPA(C2)、p-NPB(C4)和p-NPH(C6)異戊醇溶液(25 mmol/L)中加入400 μL的菌懸液和860 μL的檸檬酸-磷酸緩沖液(pH=5.0)。在40 ℃下反應10 min后,在混合溶液中加入400 μL的NaOH溶液(0.5 mol/L)終止反應,10 000 r/min離心5 min,測定上清液在400 nm波長下的吸光值。對照組使用檸檬酸-磷酸緩沖液代替細胞重懸液。每個樣品進行3次平行實驗。根據標準曲線(y=0.752 6x-0.018 2,R2=0.999 3)計算反應體系中對硝基苯酚的質量濃度(g/L)。1個酯酶活力單位(U)定義為:40 ℃條件下,每分鐘釋放1 μmol對硝基苯酚所需的酶量。用酯酶比活力來表征不同菌株的酯酶活力高低,比活力定義為:單位質量(g)的菌體中所具有的酯酶活力單位數(U)。分別計算出不同菌株中C2、C4、C6酯酶比活力,計算見公式(2):

(2)
式中:C為酶活力測定反應體系中對硝基苯酚的濃度,μmol/L;V為體積,L;m為400 μL粗酶液中菌體的干重,g;t為酶活力測定反應時間,min。
酯酶累計比活力為各菌株C2~C6酯酶比活力之和。
1.2.4 優選菌種的鑒定
采用石英砂破壁法[20]提取目的菌株基因組DNA,并通過PCR擴增目的酵母的基因組DNA。PCR擴增體系(50 μL):Premix ExTaqTM,25 μL;引物ITS1和ITS4,各2 μL;DNA模板,1 μL;雙蒸水,20 μL。PCR擴增程序:95 ℃預變性5 min;94 ℃變性1 min,53 ℃退火1 min,72 ℃延伸1 min,循環36次;72 ℃保持10 min。PCR產物進行核酸電泳檢測,寄送至蘇州Genewiz公司進行sanger測序。采用MEGA 7.4軟件將測定的18S rDNA序列與GenBank中酵母菌的序列進行比對,下載匹配度前10位的序列與待鑒定菌株構建菌株系統發育樹。
1.2.5 產香能力驗證
菠蘿蜜果酒發酵條件同1.2.2.3。對選育出的菌株和出發菌株CS31進行菠蘿蜜果酒發酵實驗。主發酵結束后,采用頂空固相微萃取氣相色譜質譜聯用方法(headspace-solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)分析菠蘿蜜果酒發酵香氣成分。
樣品配制:在20 mL容量的頂空瓶中,加入3 mL的菠蘿蜜果酒樣品、3 mL的去離子水、52 μg/L的2-辛醇內標、3.0 g的NaCl固體。
HS-SPME條件:50 μm/30 μm CAR/DVB/PDMS的SPME纖維萃取頭用于風味物質的萃取。預熱時間為2.5 min,預熱溫度為45 ℃,萃取吸附時間為30 min,質譜解吸溫度為250 ℃,質譜解吸時間為1 min。
GC條件:色譜柱為TG-Wax(60 m×0.25 mm×0.25 μm)色譜柱;載氣為氦氣,流速是1 mL/min;升溫程序為45 ℃維持1 min后,以6 ℃/min速度升溫至230 ℃并保持6 min;進樣口溫度為250 ℃,不分流。
MS參數如下:離子源,電子電離源(EI);離子源溫度,260 ℃;四極桿溫度,150 ℃;碰撞電壓,70 eV;掃描質量范圍,29~350 u。
物質定性:香氣比活力成分的定性通過與NIST 05質譜庫(Agilent Technologies Inc.)中標準譜圖進行檢索比對,并根據改進的Kovats法計算得到各物質保留指數(retention index,RI)進行確認。
物質定量:在待測酒樣中加入2-辛醇內標,根據半定量方法計算各物質的含量[21]。
1.2.6 關鍵風味物質分析方法
對突變菌株和出發菌株CS31發酵果酒的風味成分進行歸納,并利用相對氣味活度值(relative odor activity value,ROAV)法確定揮發性物質對菠蘿蜜果酒風味的貢獻[22]。一般認為ROAV>1的揮發性物質是樣品中的關鍵風味物質。使對樣品總體風味貢獻最大的組分ROAVstan為100,其余各組分的ROAVA計算見公式(3):
(3)
式中:Cstan、Tstan分別為對樣品總體風味貢獻最大的香氣成分的含量及其感官閾值,μg/L;CA、TA分別為其余各香氣成分的含量及其感官閾值,μg/L。
1.2.7 遺傳穩定性驗證
將復篩得到的具有較高酯化酶酶活力的突變株傳代5次,測定每一代菌株的C2~C6酯酶活力及酯酶累計活力,以確定突變菌株的遺傳穩定性。
2 結果與分析
2.1 ARTP誘變結果
原始菌株CS31經ARTP誘變后致死率曲線如圖1所示。隨著時間的增長,致死率也隨之增大。當誘變時間180 s時,致死率達到98.75%,誘變時間210 s時,致死率達到100%(即未發現有活菌存活)。現代育種理論表明,誘變致死率≥95%時,正向突變率最高,可獲得最佳正向突變體[18]。因此,選擇ARTP誘變時間180 s為本試驗的最佳誘變時間。

圖1 CS31在ARTP不同處理時間下的致死率Fig.1 Lethality rate of CS31under different mutagenic time of ARTP
2.2 誘變菌株初篩結果
2.2.1 酒精耐受性實驗
酒精耐受性是衡量突變菌株在果酒發酵中應用的重要指標之一,可初步篩選出性狀優良的菌株[23]。以處理組菌體OD600值高于對照組菌體OD600值的20%為篩選準則進行選擇[18]。由表1可知,從165株突變株中獲得了21株對乙醇具有較好耐受性的菌株。

表1 不同菌株對酒精的耐受性Table 1 Alcohol tolerance of different strains
2.2.2 杜氏小管產氣實驗
將上步篩選得到的21株誘變菌株接種在裝有杜氏小管的試管中,產氣情況如表2所示。對照菌株CS31在8 h開始產氣,12 h內氣泡充滿杜氏小管。對于突變菌株,產氣最快的菌株8 h時也開始產氣,至10 h 后產氣充滿杜氏小管,而有的菌株14 h后仍未能產滿氣體,可見不同酵母的產氣能力差異較大。其中,編號分別為YB10、YB13、YB19、YB31、YB38、YB55、YB57、YB61、YB63、YB65、YB69、YB71、YB87、YB93、YB111和YB144的菌株相較于出發菌株起酵短、產氣速度快,說明這16株酵母菌具有較高的發酵度和發酵效率[24]。故將上述16株酵母菌做下一級篩選。

表2 不同菌株的產氣情況Table 2 Results of gas production of different strains
2.2.3 菠蘿蜜果酒發酵實驗
為減小復篩選時的工作量,需進一步剔除發酵液氣味、外觀和常規理化指標有明顯缺陷的菌株。對17株菌(16株較為優良的菌株以及對照菌株)進行果酒發酵實驗,20 ℃靜置發酵132 h后發現YB10、YB63、YB69、YB87發酵果酒有明顯臭味,YB31、YB55、YB71發酵果酒酒體渾濁失光,因此后續不再研究。其余菌株發酵的酒體均有不同程度的花香、果香和酒香,并伴隨有菠蘿蜜的典型香味,其中YB93發酵的果酒香味尤其突出,對這些酒體進行指標測定。如表3所示,這些菌株的總糖(以葡萄糖計)、總酸(以酒石酸計)和酒精度(以體積計)雖有一定差異,但均處于正常范圍內,故本輪篩選中保留除有明顯缺陷外的全部菌株進行復篩。

表3 菠蘿蜜酒的指標分析結果Table 3 Indexes analysis of jackfruit wines
2.3 誘變菌株的復篩結果
果酒發酵過程中酯類化合物的種類和含量,由發酵汁中酯酶作用底物的種類和數量以及酯酶的潛在底物特異性決定。SUMBY等[25]對酒酒球菌(Oenococcusoeni)C2~C10酯酶活力研究發現,其對不同碳鏈長度的底物反應具有特異性。酯酶的潛在底物特異性決定了酒中酯類化合物的構成,且其含量與碳鏈長度成反比[19];同時脂溶性酯類物質的跨膜轉運會隨著碳鏈長度的增加而大幅下降,其中己酸乙酯可以100%釋放到細胞外,癸酸乙酯只有8%~17%被轉移,而只有被高效釋放到細胞外的酯類才可被消費者感知[9],因此,微生物在發酵過程中主要通過作用于短碳鏈的酯酶影響酯類香氣物質的合成。不同菌株間代謝能力的差異會影響合成酯酶的活力及底物特異性,進而影響果酒的香氣特征。因此,本研究以C2~C6 酯酶比活力為指標選育適合菠蘿蜜果酒發酵的優良菌株。
以釀酒酵母CA31為對照,對初篩獲得的10株菌株的C2~C6酯酶比活力進行測定。由表4可知,共有6株菌株酯酶的累計比活力高于CS31,但僅有YB93的C2、C4和C6酯酶比活力均高于發菌株,并且YB93的C2酯酶比活力(952.67 U/g) 比CS31(764.32 U/g)高出24.64%。因此,篩選出酯酶活力較高的突變菌株YB93。
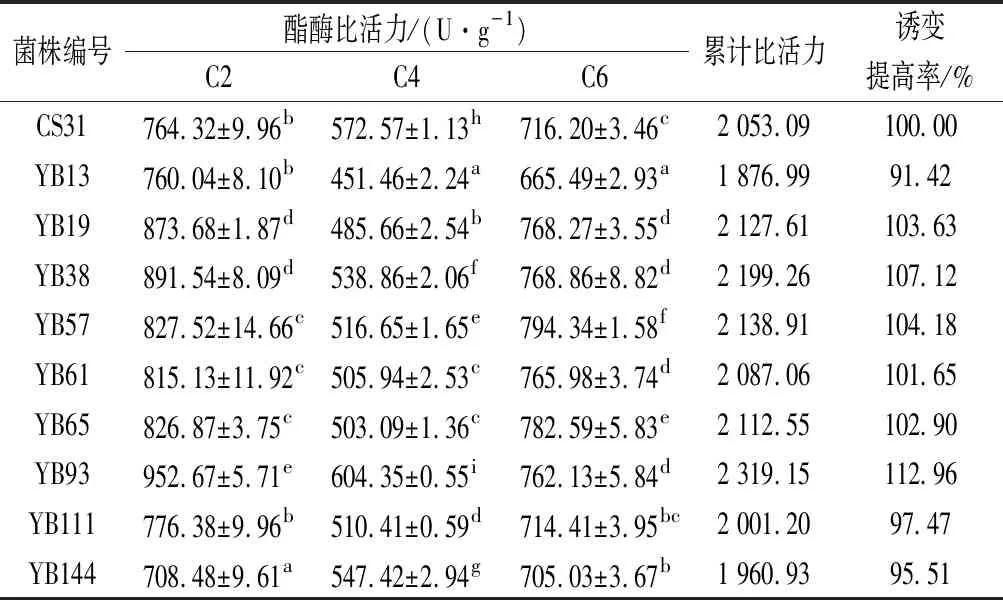
表4 不同菌株的酯酶比活力Table 4 Esterase specific activity of different strains
2.4 優選菌株的鑒定
突變菌株YB93外觀呈乳白色、菌落凸起,表面較濕潤、光滑,顯微鏡下邊緣圓整,細胞呈圓狀,一端出芽。突變菌株YB93的18S序列被命名為YB93,從GenBank中查找最高相似性序列,與獲得的序列進行比較,然后使用Mega11構建鄰接系統發育樹,將自展值設置為1 000次重復。18S序列構建的系統發育樹見圖2。由圖2可知,YB93菌株與MF276987.1具有100%的同源性。MF276987.1是一種托卡伊葡萄酒釀酒酵母(Saccharomycescerevisiae),說明YB93菌株屬于釀酒酵母屬。

圖2 酵母菌株YB93的系統發育分析Fig.2 Phylogenetic analysis of yeast strain YB93
2.5 產香能力驗證與關鍵風味化合物分析
突變菌株YB93和出發菌株CS31發酵得到的菠蘿蜜果酒風味物質鑒定結果見表5。菠蘿蜜果酒內共檢出60種風味物質,其中包含38種酯類化合物,11種醇類化合物,5種酸類化合物及6種其他類化合物。由表5可知,在所有化合物中,以醇酯類化合物含量最為豐富,可占到揮發性化合物總量90%以上。兩株菌株發酵的菠蘿蜜果酒在風味物質的種類上并沒有顯著差異,但是在含量上具有顯著差異。相較于CS31,YB93發酵的果酒中酯類、醇類以及酸類揮發性物質總含量均較高,尤其是酯類化合物。與CS31相比,經突變菌株YB93發酵的酒樣總揮發性物質提高了34.28%,酯類物質提高了60.67%。上述結果表明,雖然酯酶作用效果具有雙向性[9],但本實驗中的酯酶對于菠蘿蜜果酒中的酯類物質主導合成作用。FUJII等[26]報告了實驗酵母菌株比對照菌株表現出更高的酯酶活性和更高含量的乙酸酯,其中乙酸異戊酯含量增加了27倍,乙酸乙酯含量增加了9倍。祝霞等[13]發現供試菌株總酯酶活性最高的ZX-1,其發酵的酒樣中主要酯類物質(OAV>0.1)的總含量也最高,尤其是乙酸異戊酯、乙酸己酯、乙酸辛酯、乙酸苯乙酯等具有潛在花香和果香味的物質含量顯著增加(P<0.05)。豐富的酯類物質賦予YB93發酵酒體更濃郁的花香和果香味[13],提高了菠蘿蜜果酒的香氣品質。
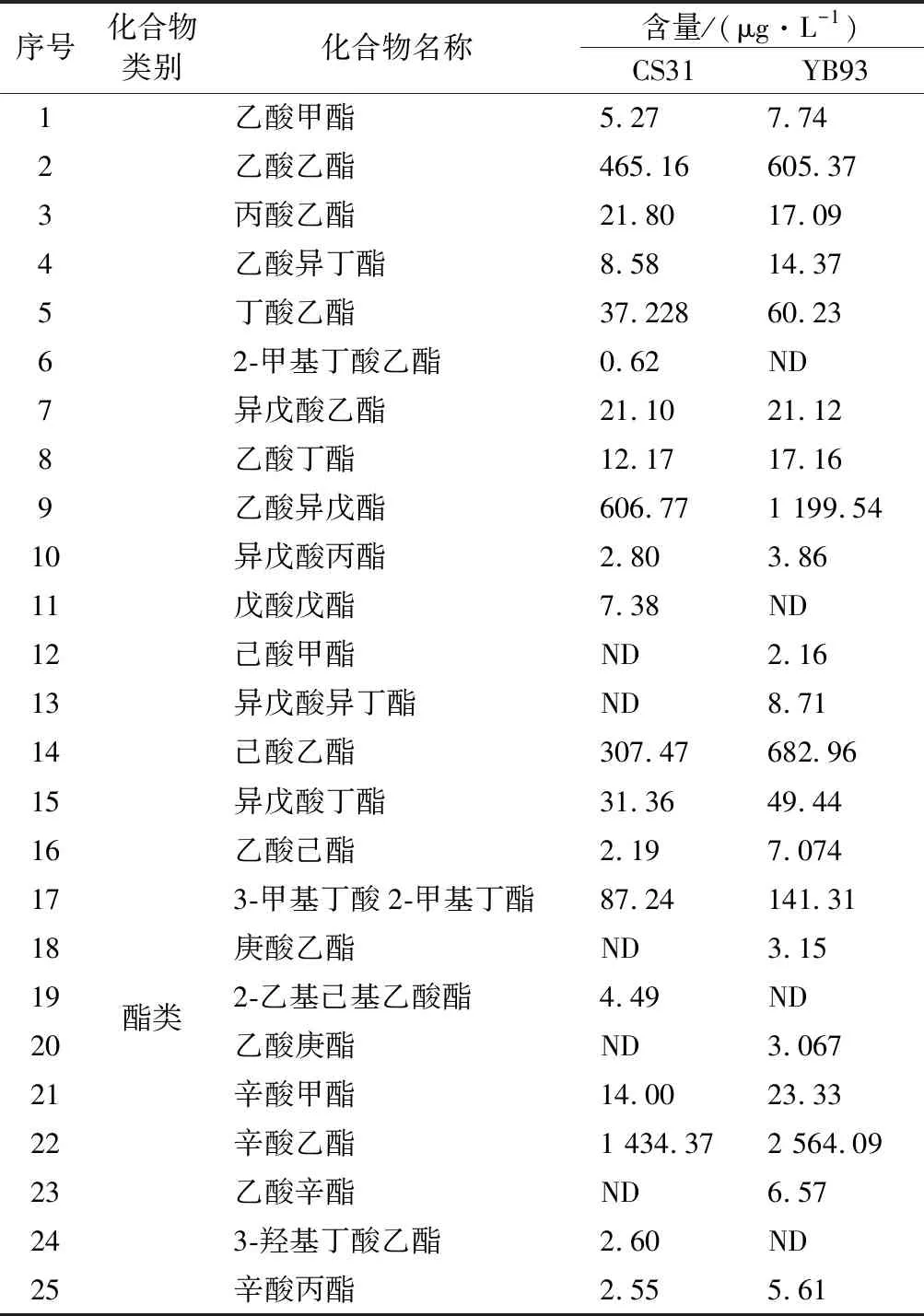
表5 菠蘿蜜果酒中揮發性成分的半定量分析Table 5 Semi-quantitative analysis of volatile components in jackfruit wines
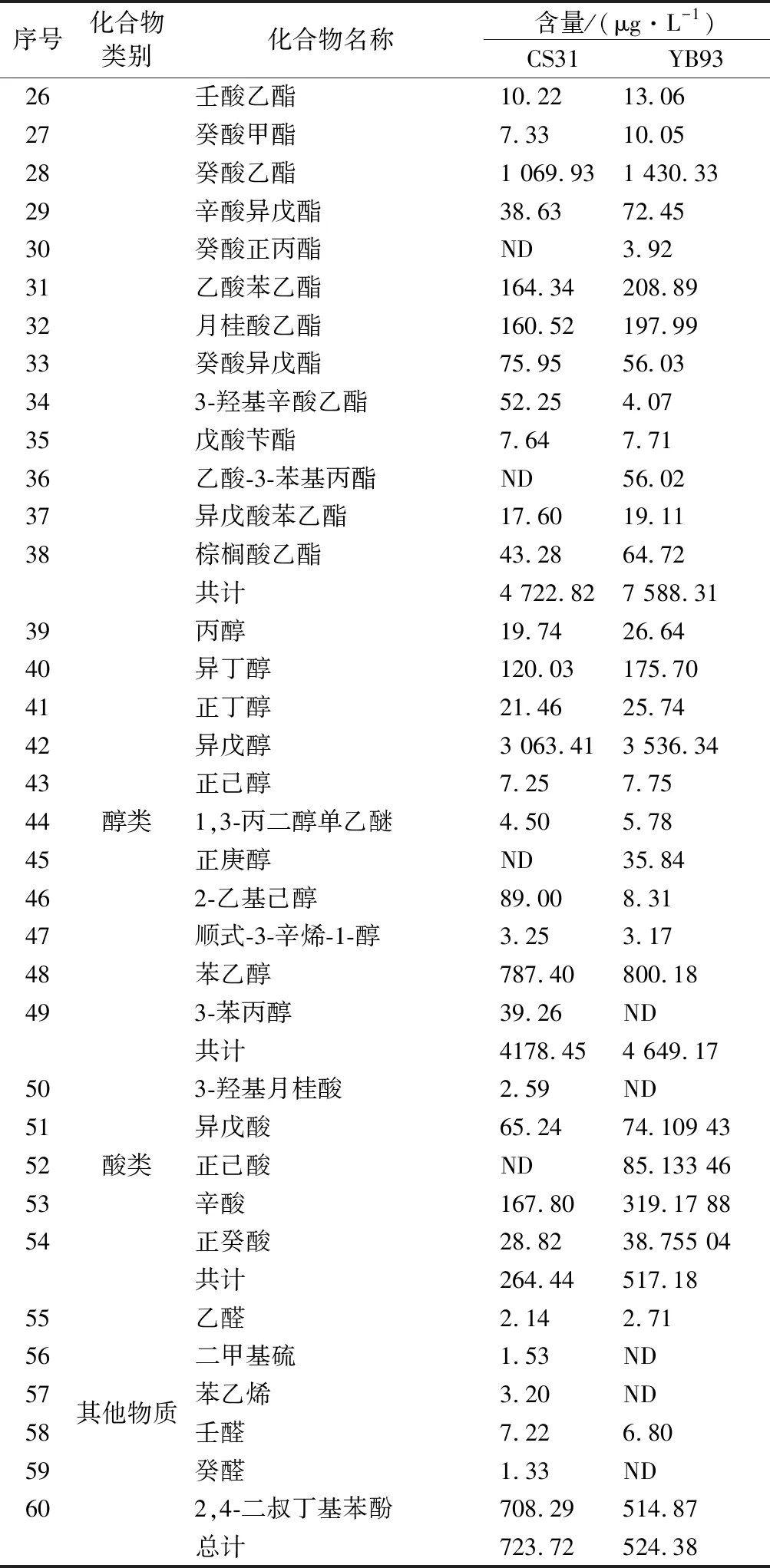
續表5
風味物質對總體風味的貢獻不僅取決于其含量,還取決于其氣味閾值。通過查詢揮發性風味化合物的氣味閾值進行ROAV分析,其中ROAV >1的香味物質對菠蘿蜜果酒貢獻較大,是菠蘿蜜果酒中的關鍵風味化合物。由表6可知,兩菌株發酵的果酒中關鍵風味化合物幾乎都是酯類,且酯類物質數量與種類相同,可見提高酯類物質的含量對于提高菠蘿蜜果酒香氣品質的重要性。其中,除壬醛外,YB93各主要香氣組分的含量均高于CS31,尤其是乙酸異戊酯、己酸乙酯、辛酸乙酯3種組分,分別提高了97.70%、122.13%、78.76%。在菌株YB93發酵果酒中,乙酸異戊酯、癸酸乙酯、異戊酸乙酯的ROAV值較高,這意味著這3種物質對酒體風味有著極大的貢獻[22],這有助于分析菠蘿蜜果酒中的典型呈香物質。綜合以上初篩、復篩以及產香能力驗證與關鍵風味化合物分析的結果,YB93菌株是可增強菠蘿蜜果酒的香氣品質的優良菌株。

表6 菠蘿蜜果酒中關鍵風味物質含量及貢獻值Table 6 Contents and ROAV values of key flavor compounds of jackfruit wines
2.6 遺傳穩定性測定
通過ARTP誘變選育的菌株仍然具有不穩定性,會有回復性突變和隱性突變的可能,因此對誘變菌株進行傳代試驗驗證菌株傳代穩定性[18]。將誘變菌株CS31連續傳代5次測定產酶能力,結果如表7所示。突變菌株YB93累計酯酶比活力穩定在2 308.51~2 318.91 U/g,且各代菌株的C2~C6酯酶活力差異不顯著,變化幅度小。因此,可以證明突變菌株YB93高產酯酶能力可以穩定遺傳,發生回復性突變概率較小,可以應用到菠蘿蜜果酒發酵中[18]。

表7 菌株YB93酶活穩定性檢測Table 7 Enzyme activity stability test of strain YB93
3 結論
優質酵母菌株的篩選和培育是菠蘿蜜果酒釀造的重要一環。本實驗以增強菠蘿蜜果酒香氣品質為目的,進行了菠蘿蜜果酒高產酯酶釀酒酵母的選育。經ARTP誘變及系列篩選得到1株高產酯酶釀酒酵母YB93。經18S rDNA測序與系統發育樹分析,鑒定YB93為Saccharomycescerevisiae。
在酯酶活力方面,YB93的C2、C4、C6酯酶比活力均高于發菌株,并且酯酶比活力累計量(2 319.15 U/g)比CS31(2 053.09 U/g)高出12.96%。高酯酶活力使YB93發酵果酒的醇類、酯類、酸類和總揮發性風味物質含量均高于出發菌株CS31發酵的果酒,其中酯類物質含量(7 588.31 μg/L)比出發菌株CS31(4 722.82 μg/L)提高了60.67%。通過ROAV法,分析出菠蘿蜜果酒關鍵風味物質除壬醛外,均為酯類,較豐富的酯類物質可以賦予YB93發酵的酒體更濃郁的花香和果香味。菠蘿蜜果酒中的關鍵風味物質一部分來自菠蘿蜜的特征香味,一部分是由酵母在發酵過程中產生的芳香物質。菠蘿蜜果酒和果汁中的關鍵風味物質(結果中未顯示)相比較,果酒中關鍵香味物質的含量是果汁中的12.11倍;果汁中共有8種關鍵風味物質,和果酒中一樣,除壬醛外均為酯類;兩者有5種風味物質是重疊的,其中4種為酯類,貢獻率最高的異戊酸乙酯和乙酸異戊酯也是果酒中貢獻率較大的;經過酵母的發酵,果汁中的關鍵風味物質丁酸異戊酯消失,果酒中的關鍵風味物質癸酸乙酯和乙酸苯乙酯新生成,這使得菠蘿蜜果酒在不破壞菠蘿蜜典型香味的基礎上擁有了更豐富的香氣,達到既保留品種香,又增加發酵香的目的。經過測定YB93菌株具有較好的遺傳穩定性,具有應用于果酒發酵的潛力。然而,本實驗僅將誘變菌株與出發菌株的各項性能進行了對比,后續試驗有待進一步考察突變菌株在菠蘿蜜果酒發酵過程中酯酶活力和酯類物質種類、含量的變化規律。
總體而言,本實驗為菠蘿蜜果酒優良酵母的選育提供了一定的參考。

