高效液相色譜-串聯質譜測定蝦肉中四種獸藥殘留及其熱穩定性分析
沈可伊,鄒曉霜,王軍
(中國農業大學 食品科學與營養工程學院,北京,100083)
近30年來,水產養殖業規模年均增長已達到6%[1]。中國的水產品產量占全球產量的60%以上,成為了世界水產養殖大國[2]。2000—2014年,中國水產養殖產量從2 460萬t增長到4 750萬t,增長率為93.1%[3],由此可見,中國水產養殖業產量呈現逐年遞增的趨勢。在水產養殖和運輸的過程中,一些獸藥會被用于治療或預防疾病,因此有時可能會出現獸藥濫用的現象。近些年,在水產品消費中蝦類占比較大,為了確保食品安全,需要對蝦中可能殘留的一些獸藥進行分析。
氟喹諾酮類藥物于1980年代首次引入并迅速成為最受歡迎的抗生素藥物之一[4]。氟喹諾酮類藥物可以治療人類呼吸道、泌尿道和消化道感染,這也有助于擴大這類藥物在預防動物感染方面的應用。與其他抗生素相比,氟喹諾酮類藥物不易分解,并且與土壤的相互作用有高度特異性[5]。食品中殘留的氟喹諾酮類藥物會引起過敏反應、中毒反應以及抗菌素的耐藥性等,從而對人體健康造成潛在危害[6]。在農業部2292號公告中明確禁止諾氟沙星和氧氟沙星作為獸藥使用。但是由于諾氟沙星和氧氟沙星價格便宜、效果好,存在養殖人員違規使用這2種獸藥的風險,從而引發食品安全問題。地西泮和安眠酮是重要的抗精神病藥。地西泮用于治療焦慮癥[7]和作為抗腫瘤抗生素[8]。安眠酮可以用于治療失眠癥狀[9]。在水產品的運輸過程中,地西泮和安眠酮有減輕壓力、抑制水產品活動、催眠、降低代謝的作用,以防止水產品身體損傷和體重減少[10]。但是殘留在蝦中的地西泮和安眠酮可能會對人體健康造成危害,我國已經規定在蝦中不能檢出安眠酮和地西泮。近些年,在國家食品安全抽檢中,多次被檢測出這4種獸藥,因此這幾種物質成為重點監測的獸藥殘留物。目前為止,高效液相色譜[11-13]、液相色譜串聯質譜[14-17]以及氣相色譜串聯質譜[18-20]已經應用于分別檢測安眠酮、地西泮、諾氟沙星以及氧氟沙星,但目前仍然缺乏能靈敏、準確地同時分析這4種需要重點監控獸藥的方法,使得在實際檢測當中需要用到2種及以上的分析方法才能對這4種獸藥進行全面的分析檢測。
因此,本文建立了一種同時檢測蝦肉中安眠酮、地西泮、諾氟沙星以及氧氟沙星的方法,為蝦肉中這些獸藥殘留風險監測提供有效的技術手段。本研究使用的高效液相色譜-串聯質譜(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)比液相色譜法更加靈敏,且具備可以同時檢測蝦肉中這4種獸藥化合物的優勢,從而縮短了分析時間并提高了分析效率。同時,分析了蝦肉中這些殘留物在加熱過程中是否存在分解或者轉化的現象,對了解這4種獸藥殘留的穩定性和轉化規律可提供參考。
1 材料與方法
1.1 材料與試劑
氧氟沙星(ofloxacin,純度98%)標準品、諾氟沙星(norfloxacin,純度98%)標準品(均為固體)、甲醇、甲酸(均為色譜純),百靈威科技有限公司;地西泮(diazepam,溶于甲醇,100 μg/mL)、安眠酮(methaqualone,溶于甲醇,100 μg/mL),天津阿爾塔科技有限公司;乙腈(色譜純),美國Thermo Fisher Scien- tific公司;鹽酸(分析純),國藥集團化學試劑有限公司;無水硫酸鈉(分析純),上海麥克林生化科技有限公司;C18固相萃取柱(500 mg/6mL),天津博納艾杰爾科技有限公司;超純水系統,美國Millipore公司;蝦肉,北京市各大超市。
1.2 儀器與設備
1260 infinity-6460高效液相色譜-串聯質譜儀,美國安捷倫科技公司;ME204/02電子天平(萬分之一天平220 g/0.1mg),梅特勒-托利多儀器(上海)有限公司;KQ-500DE型數控超聲波清洗器,昆山市超聲儀器有限公司;QL-861渦旋振蕩器,海門市其林貝爾儀器制造有限公司;OSB-2100/N-1100旋轉蒸發儀,上海愛朗儀器有限公司;H1750R醫用離心機,湘儀離心機儀器有限公司;HH-2數顯恒溫水浴鍋,榮華儀器制造有限公司。
1.3 實驗方法
1.3.1 標準溶液的配制
稱取適當氧氟沙星和諾氟沙星,用甲醇配制成質量濃度為1 mg/mL的單一標準品儲備溶液,溶解較慢可加入適量甲酸并超聲輔助溶解。取適量安眠酮和地西泮的液體標準品、氧氟沙星和諾氟沙星的單一標準品儲備液,用甲醇配制成為1 μg/mL的單一標準品工作溶液,儲存于-20 ℃冰箱中備用。
稱取空白蝦肉樣品5 g,分別加入適量單一標準品標準工作溶液,按照1.3.2與試樣同時進行提取和凈化,得到質量濃度為0.05~40 ng/mL的基質混標標準工作溶液。
1.3.2 樣品預處理
1.3.2.1 提取
將蝦肉用絞肉機絞碎成肉泥后,稱取5 g蝦肉泥于50 mL離心管中,加入2 g無水硫酸鈉和25 mL乙腈,將混合物渦旋提取30 s,充分分散混勻后,超聲提取15 min,3 500 r/min離心5 min,取出上清液轉移至圓底燒瓶中,重復上述步驟1次,合并上清液,上清液在50 ℃條件下減壓旋轉蒸發至干。
1.3.2.2 凈化
取C18固相萃取柱,先后用5 mL甲醇和5 mL水進行活化,用5 mL 0.01 mol/L的鹽酸水溶液溶解1.3.2.1 中圓底燒瓶中的上清液殘留物,將殘留物混合液通過C18固相萃取柱,流速控制在1 mL/min內,棄去濾液。再用5 mL 0.01 mol/L的鹽酸水溶液溶解圓底燒瓶中的剩余物,將溶解后的混合物溶液通過C18固相萃取柱,棄去濾液。用10 mL 0.01 mol/L的鹽酸甲醇溶液洗脫固相萃取柱,收集洗脫液,經50 ℃ 條件下減壓旋轉蒸發至干,加入1 mL甲醇復溶,用0.22 μm尼龍針頭過濾器進行過濾,濾液用于高效液相色譜-串聯質譜分析。
1.3.3 陽性樣品制備
稱取空白蝦肉5 g(精確至0.01 g),用研磨缽研磨至肉泥狀,注射標準品溶液,制備成為諾氟沙星加標量為60 μg/kg、氧氟沙星加標量為30 μg/kg以及安眠酮和地西泮加標量為10 μg/kg的樣品。將加標后的蝦肉樣品放置在4 ℃冰箱中平衡6 h,模擬樣品被獸藥污染,備用。
1.3.4 加熱處理
將1.3.3中平衡6 h后的蝦肉樣品,加入10 mL超純水,放入90 ℃水浴中分別加熱15、30、45、60 min,取出后冷卻、研磨,加熱后的蝦肉樣品按照 1.3.2 進行處理,蝦肉水煮液用濾紙過濾去除部分雜質。蝦肉提取液經過C18固相萃取柱除雜之后,將對應的蝦肉水煮液加入相同的固相萃取柱過濾,棄去濾液,隨后按照1.3.2.2中方法處理,得到濾液,備用。
將1.3.3中平衡6 h后的蝦肉樣品,加入10 mL超純水,放入90 ℃水浴中分別加熱15、60 min,取出后冷卻、研磨,加熱后的蝦肉按照1.3.2進行處理,得到濾液,備用。
1.3.5 HPLC-MS/MS條件
1.3.5.1 色譜條件
Eclipse XDB-C18柱(2.1 mm×150 mm,3.5 μm);流速為0.2 mL/min;柱溫40 ℃;進樣量10 μL;流動相:A相為0.1%(體積分數)甲酸水溶液,B相為0.1%(體積分數)甲酸甲醇溶液,洗脫梯度如表1所示。

表1 梯度洗脫程序Table 1 Gradient elution conditions
1.3.5.2 質譜條件
選擇電噴霧離子源,正離子模式(electrospray ionization,ESI+);所有分析物檢測均在多反應監測(multiple reaction monitoring,MRM)模式下進行;碰撞氣體和鞘氣均為高純氮氣;霧化器壓力為310.3 kPa;鞘氣溫度為400 ℃ ;鞘氣流量為12 L/min;毛細管電壓為3 800 V。4種化合物在該色譜以及質譜條件下的MRM色譜圖如圖1所示。

a-安眠酮;b-地西泮;c-諾氟沙星;d-氧氟沙星圖1 四種獸藥基質加標溶液的MRM色譜圖Fig.1 The MRM chromatograms of four veterinary drugs in spiked sample matrices
1.3.6 C18固相萃取柱凈化條件優化方法
稱取4份5 g空白樣品,以安眠酮0.1 μg/kg、地西泮0.1 μg/kg、諾氟沙星3.8 μg/kg、氧氟沙星2.4 μg/kg的濃度進行加標,經過1.3.2.1步驟提取后,4份加標樣品分別用不同的洗脫液進行復溶、洗脫,洗脫液包括:甲醇-水(1∶4,體積比)、甲醇-水(1∶9,體積比)、0.01 mol/L甲酸甲醇溶液和0.01 mol/L鹽酸水溶液,除洗脫液不同外,其他凈化步驟與1.3.2.2中一致,隨后將凈化后的4份樣品溶液用HPLC-MS/MS方法進行分析。
2 結果與分析
2.1 儀器參數的優化
2.1.1 色譜參數的優化
根據這4 種化合物的分子極性差異,當用甲醇-水作為流動相時,地西泮和安眠酮的保留時間較長[21],而諾氟沙星氧氟沙星的保留時間明顯較地西泮和安眠酮短,因此流動相比例選擇先用高比例水相對2種沙星進行分離,再用高比例甲醇洗脫出地西泮和安眠酮,通過優化的色譜條件能夠有效地將這4種獸藥進行色譜分離。同時在流動相中加入0.1%甲酸,有助于4種化合物分子在正離子模式下進行離子化。因此,通過優化后選擇0.1%甲酸水溶液-0.1%甲酸甲醇溶液作為流動相,當洗脫梯度如表1所示時,4 種獸藥物質的分離效果較好。
2.1.2 質譜參數的優化
對4種化合物分子通過質譜PRODUCT模式進行分析,首先確定母離子后再通過二級質譜掃描,對母離子碎裂后產生的子離子進行篩選,選擇響應最強、靈敏性好的子離子作為定量離子,與特征結構相關的子離子作為定性離子。4種化合物的母、子離子以及相應的碰撞能量和碎裂電壓詳見表2。

表2 四種分析物的MRM模式分析參數Table 2 MRM conditions for four analytes
2.2 C18固相萃取柱凈化條件優化
為了分析確定目標化合物在C18固相萃取柱上的保留率,對凈化步驟中的洗脫液進行了優化。經4種不同洗脫液凈化后的加標回收率如表3所示。結果表明,對諾氟沙星和氧氟沙星而言,使用0.01 mol/L 鹽酸水溶液進行洗脫后的回收率高于使用其他3種溶液洗脫后的回收率;對安眠酮和地西泮而言,使用0.01 mol/L鹽酸水溶液進行洗脫后的回收率也高于使用甲醇-水(1∶4,體積比)以及甲醇-水(1∶9,體積比)進行洗脫后的回收率,同時,采用0.01 mol/L鹽酸水溶液進行洗脫后,4種獸藥殘留加標回收率為90.75%~103.99%,相對標準偏差(relative standard deviation,RSD)值為1.23%~3.91%,因此,本研究選擇0.01 mol/L鹽酸水溶液作為凈化步驟中的洗脫液。在該洗脫液條件下,不僅能夠起到凈化作用而且目標化合物保持了良好的回收率。

表3 不同洗脫液中4種獸藥分析物的回收率 單位:%
2.3 線性范圍、檢出限和定量限
為了消除蝦肉中存在的基質效應,利用空白蝦肉加標制作為質量濃度在0.05~40 ng/mL的5個基質混標標準工作溶液,按照確定的HPLC-MS/MS參數進行分析,混標中各個化合物的標準曲線以工作溶液濃度為x,以定量離子的峰面積為y。結果表明,4種獸藥質量濃度在0.05~40 ng/mL線性關系良好,R2均>0.99。將基質標準溶液不斷稀釋,通過信噪比S/N=3和S/N=10分別計算該方法的檢出限(limit of detection,LOD)和定量限(limit of quantita- tion,LOQ),4種獸藥的線性方程、線性范圍、相關系數R2、LOD以及LOQ如表4所示。

表4 線性方程、線性范圍、R2、LOD以及LOQTable 4 Calibration curve, linear range, R2,limit of detection, and limit of quantitation
2.4 準確度和精密度
在空白蝦肉中,根據LOD的3、5、10倍(低、中、高濃度)為加標水平進行回收率驗證,回收率和RSD見表5。方法的平均回收率為78%~119%,RSD為1.14%~4.76%,該方法的準確度和精密度滿足蝦肉中安眠酮、地西泮、諾氟沙星以及氧氟沙星的檢測需求。

表5 基質加標回收率和RSD(n=3)Table 5 Average recoveries and relative standard deviation(n=3)
2.5 樣品分析
在北京市3家不同的超市購買到5種蝦,應用優化的樣品前處理方法和液質分析方法對這5種蝦肉進行檢測,在這些樣品中均未檢測出安眠酮、地西泮、諾氟沙星以及氧氟沙星。此外,本研究利用質量控制的方法來驗證這些樣品分析結果的準確性。在這5種蝦肉中以4種獸藥的5倍LOD加標水平進行驗證,結果如表6所示。4種化合物的加標樣品回收率為(106.22±0.89)%~(117.89±1.21)%,加標回收率良好,進一步驗證了樣品分析結果的準確性。

表6 樣品回收率Table 6 The average recoveries in samples
2.6 加熱過程中穩定性分析
蝦肉常用烹飪方法多為白灼,因而選擇在90 ℃下進行水浴加熱,研究不同加熱時間對于4種獸藥殘留物含量的影響。按照1.3.3中的方法制備蝦肉樣品,按照1.3.4中的方法處理后,經過提取、凈化以及HPLC-MS/MS方法分析,得到安眠酮、地西泮、諾氟沙星以及氧氟沙星的濃度隨時間變化的結果,結果如圖2所示。由圖2可以看出,隨著加熱時間的延長,4種化合物在蝦肉中的含量保持穩定。蝦肉中的安眠酮、地西泮、諾氟沙星以及氧氟沙星在90 ℃加熱15、30、45、60 min后的含量與未加熱處理蝦肉中的含量沒有顯著性差異(P>0.05)。同時,由表7中數據可推斷,蝦肉與蝦肉水煮液合并檢測相對于只測定蝦肉中的獸藥殘留數值沒有顯著性差異(P>0.05),表明在水煮過程中,蝦肉中的這4種獸藥不易遷移到蝦肉水煮液中,大部分仍保留在蝦肉中,說明通過水煮加熱的方式并不能除去蝦肉中的這些獸藥殘留。蝦肉基質中的安眠酮、地西泮、諾氟沙星以及氧氟沙星在食品常用的水煮烹飪方式下,表現出良好的穩定性,很難因為分解或者與蝦肉中的蛋白等基質相互作用而減少。
王綪[22]研究了在水浴60、80、100 ℃加熱條件下,牛肉中沙拉沙星和二氟沙星的降解率分別為30.75%~37.00%以及3.5%~9.50%。雞肉中的鹽霉素和莫能菌素在100 ℃水煮條件下,降解率可以達到72.5%和61.4%,但當溫度在20~80 ℃時,鹽霉素的降解速率會變低[23]。本研究中的4種獸藥在蝦肉中的熱穩定性較高,與這些化合物的穩定環狀結構密切相關。
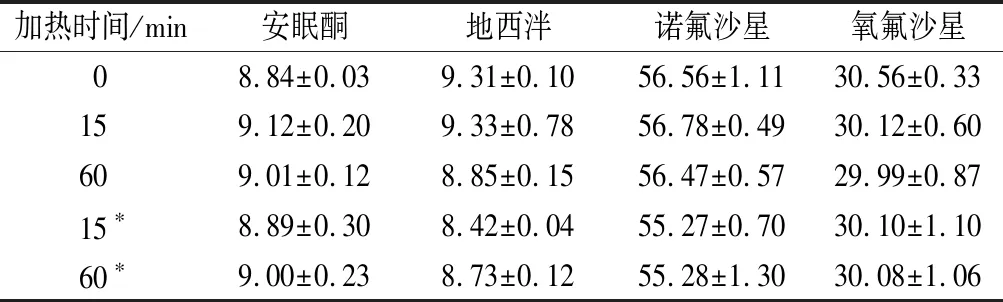
表7 加熱后4種獸藥在蝦肉中的含量 單位:μg/kg
3 結論
本研究建立了以乙腈為提取溶劑,C18固相萃取柱凈化,同時對蝦肉中安眠酮、地西泮、諾氟沙星和氧氟沙星進行檢測的高效液相色譜串聯三重四級桿質譜的分析方法,在0.05~40 ng/mL的線性范圍內,相關系數R2均>0.99,LOD為0.01~0.38 μg/kg,4種化合物的回收率為78%~119%,RSD為1.14%~4.76%,該方法適合蝦肉中這4種獸藥殘留的分析,為蝦肉中同時分析氟喹諾酮類藥物以及鎮靜類藥物提供了參考方法。此外,利用建立的分析方法,對模擬水煮烹飪條件下蝦肉中安眠酮、地西泮、諾氟沙星和氧氟沙星的熱穩定性進行了研究,結果表明蝦肉中這4種獸藥在90 ℃水煮條件下,加熱15、30、45、60 min后的含量相較于未經過加熱處理樣品的含量沒有顯著變化(P>0.05),證明這4種獸藥在蝦肉中的熱穩定性較高,不能通過水煮加熱的方式除去蝦肉中的這些殘留物。

