雞交叉喙研究進展
石雷,孫研研,李云雷,白皓,陳繼蘭*
(1.中國農業科學院北京畜牧獸醫研究所,農業部動物遺傳育種與繁殖(家禽)重點實驗室,北京 100193;2.河北農業大學動物科技學院,河北 保定 071001;3.揚州大學動物科學與技術學院,江蘇 揚州 225009;4.揚州大學農業科技發展研究院,教育部農業與農產品安全國際合作聯合實驗室,江蘇 揚州 225009)
交叉喙特征為上下喙錯位、咬合不全、呈交叉狀態,發生率在2%左右[1-3]。地方雞種如北京油雞、絲羽烏骨雞和惠陽胡須雞等均有不同程度的交叉喙現象。喙畸形雞無法正常采食飲水,導致生長發育受阻,死亡率通常高出正常雞數倍[4-6],即使存活下來,成年后的繁殖力也低于正常雞50%以上[7],該性狀制約著地方雞的產業化發展。喙同時是禽類重要的觸覺感受器[8-9]和溫度調節器[10-17],畸形喙也嚴重損害了動物福利。
雞交叉喙的形成包括遺傳和非遺傳兩種因素。Yamauchi等[18]報道,斷喙操作可使雞群交叉喙發生率達到16.3%。然而,未斷喙的雞也會發生交叉喙現象,研究人員結合交配試驗證實了交叉喙具有遺傳性[5-7]。近幾年,關于雞交叉喙發生原因和遺傳機制的研究不斷深入[4-6],本文對交叉喙性狀研究進展進行綜述,以期為后續相關工作的開展提供參考。
1 交叉喙發生率
1934年至今,全球已公開報道10余個雞種存在遺傳性交叉喙現象,發生率介于0.20%~7.40%(表1)。本課題組調研發現,北京油雞、貴妃雞、惠陽胡須雞、絲羽烏骨雞、象洞雞、河田雞和洪山雞等品種也存在交叉喙,發生率為0.03%~2.00%。
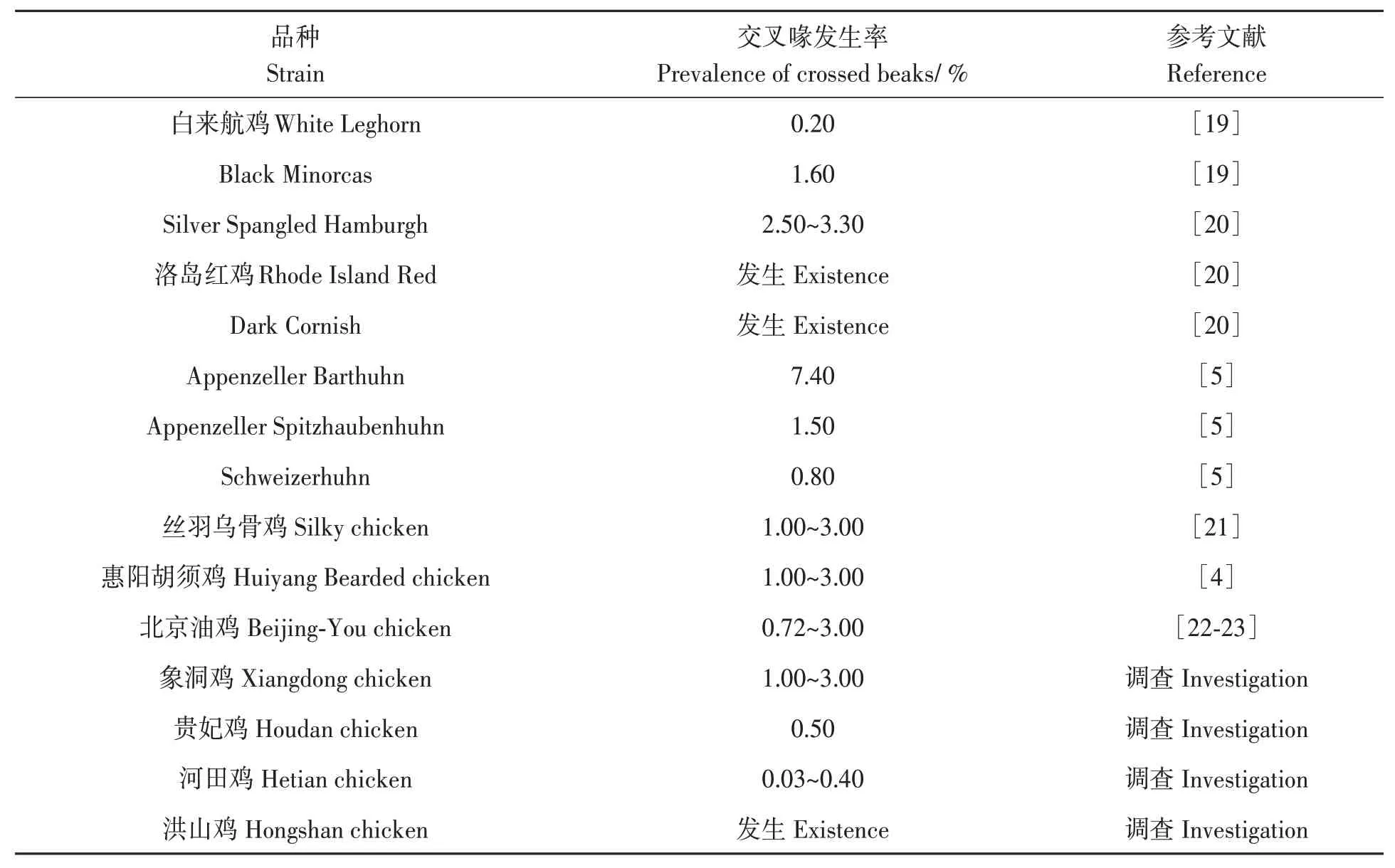
表1 不同雞品種交叉喙發生率Table 1 Incidence of crossed beak in different chicken strains
北京油雞在排除不良孵化條件和營養等非遺傳因素后,每個世代繁種時仍有少量個體發生交叉喙。北京畜牧獸醫研究所培育的第12世代北京油雞交叉喙個體向上追溯4代,發現存在共同祖先。另外,白皓[24]通過構建交叉喙資源群體,發現親本均為交叉喙時,子一代的交叉喙發生率高達7.8%,是同期正常繁育群體的11.8倍,由此推斷交叉喙具有遺傳性。Landauer[20]對交叉喙性狀的遺傳調控研究表明,交叉喙的Silver Spangled Hamburgh雞群近交可使后代交叉喙發生率提高至50%[20]。
綜上所述,交叉喙具有遺傳性,并廣泛分布于全球多個雞種中。我國地方雞種資源豐富,未來有必要對這些資源進行詳細的調研,以完善交叉喙在國內雞種的分布研究。
2 交叉喙表型分類與特征
表型是機體內許多分子生物學過程發生發展的結果,認識交叉喙的表型特征是深入研究遺傳機理的前提,對深入理解基因組對交叉喙表型的復雜作用具有重要作用。
2.1 交叉喙表型分類
1938年,Landauer[20]通過觀察Silver Spangled Hamburgh和白來航雞(White Leghorn)等品種的交叉喙表型特征,提出交叉喙存在4種類型,其中,Ⅰ型和Ⅱ型分別由不良孵化條件和致死基因引起,Ⅲ型和Ⅳ型由遺傳因素導致。Ⅰ型和Ⅱ型交叉喙特征為雞胚或雛雞缺少某一側眼球或同時缺少兩側眼球,引起上喙偏向無眼球或眼球缺失嚴重的一側。Ⅲ型交叉喙的雛雞出殼時面部完整,喙形正常,但在隨后1~2個月內逐漸表現交叉喙,并隨日齡增長喙畸形逐漸加重。Ⅲ型交叉喙表現為上喙偏離中軸線,且上喙右偏的頻率高于左偏,個體間畸形程度差別也較大。輕度交叉喙個體的上喙只在其遠端處扭曲,重度交叉喙個體的上喙則從顱面骨處開始扭曲,并伴有鼻骨和眼眶骨不對稱,最終導致顱面骨畸形。Ⅳ型交叉喙在白來航雞(White Leghorn)中發生率較高,特點為胚胎期表現交叉喙,但個體在出殼后的生長發育過程中會逐漸恢復正常。Landauer[20]系統歸納了各類交叉喙表型特征,推測各類型形成原因,為后續雞交叉喙的研究奠定了基礎。
21世紀以來,國內外學者發現地方雞種同樣存在交叉喙現象。Joller等[5]、Hong等[4]和白皓[24]分別在Appenzeller Barthuhn雞、惠陽胡須雞和北京油雞群體中發現交叉喙,主要特征為剛出殼的雛雞喙形正常,但在飼養過程中部分個體逐漸出現喙畸形,與Landauer[20]提出的Ⅲ型交叉喙發生規律相同。深入分析發現,Appenzeller Barthuhn雞、惠陽胡須雞和北京油雞均以下喙偏轉為主,發生率分別為98.70%,68.67%和95.77%[5],但下喙偏轉方向無顯著差異,與Landauer[20]報道的Silver Spangled Hamburgh交叉喙雞多以上喙偏轉、右偏為主的結果不同,其原因可能是不同品種間遺傳背景不同所造成的表型差異。另外,Hong等[4]測量雞面部對稱性發現,交叉喙雞存在面部扭曲和不對稱情況,這與Landauer[20]報道的交叉喙可導致雞顱面骨畸形的結論一致。
2.2 交叉喙表型特征
Shi等[22]研究北京油雞交叉喙發生規律發現,交叉喙發生率在0日齡時僅為0.09%,隨后以每周10%~20%的發生率增加,6周齡達到總發生率的93.33%,直至8周齡不再新增交叉喙個體。與此同時,交叉角度隨日齡的增長也逐漸增大,直至8周齡時,交叉角度達到最大。上述結果與Landauer[20]報道的Ⅲ型交叉喙表型特征一致。因此,目前發現的地方雞種交叉喙多與Landauer[20]報道的Ⅲ型特征相同。
朱靜等[23]和Shi等[22]詳細分析了交叉喙雞的顱骨特點,首次報道北京油雞交叉喙由左右側下頜骨長度不等導致,即某一側下頜骨支短于對側正常骨支,下喙偏向于下頜骨短支側(圖1)。同時,下喙彎曲偏離中軸線,阻礙了上下喙的正常閉合,導致畸形個體在采食和飲水過程中短側骨支與其同側顴弓骨的頻繁碰撞,進而引起顴弓骨變形,最終畸形的顴弓骨造成上喙偏轉和顱面骨扭曲。北京油雞群體也存在上下喙同時向一側偏轉的情況,發生率為0.28%,解剖發現同樣為雙側下頜骨支長度不對稱,并伴有顴弓骨畸形[22]。因此,確定下頜骨支生發中心逐漸成為解析交叉喙的關鍵。Shi等[22]進一步分析下頜骨HE染色切片,發現下頜骨髁部存在不同發育階段的成骨細胞,進而確定了骨支的生發中心是下頜骨髁部。人類相關研究也表明,單側下頜骨髁部功能損傷可導致下頜骨不對稱[25-26],提示下頜骨髁部功能異常引起雞交叉喙。
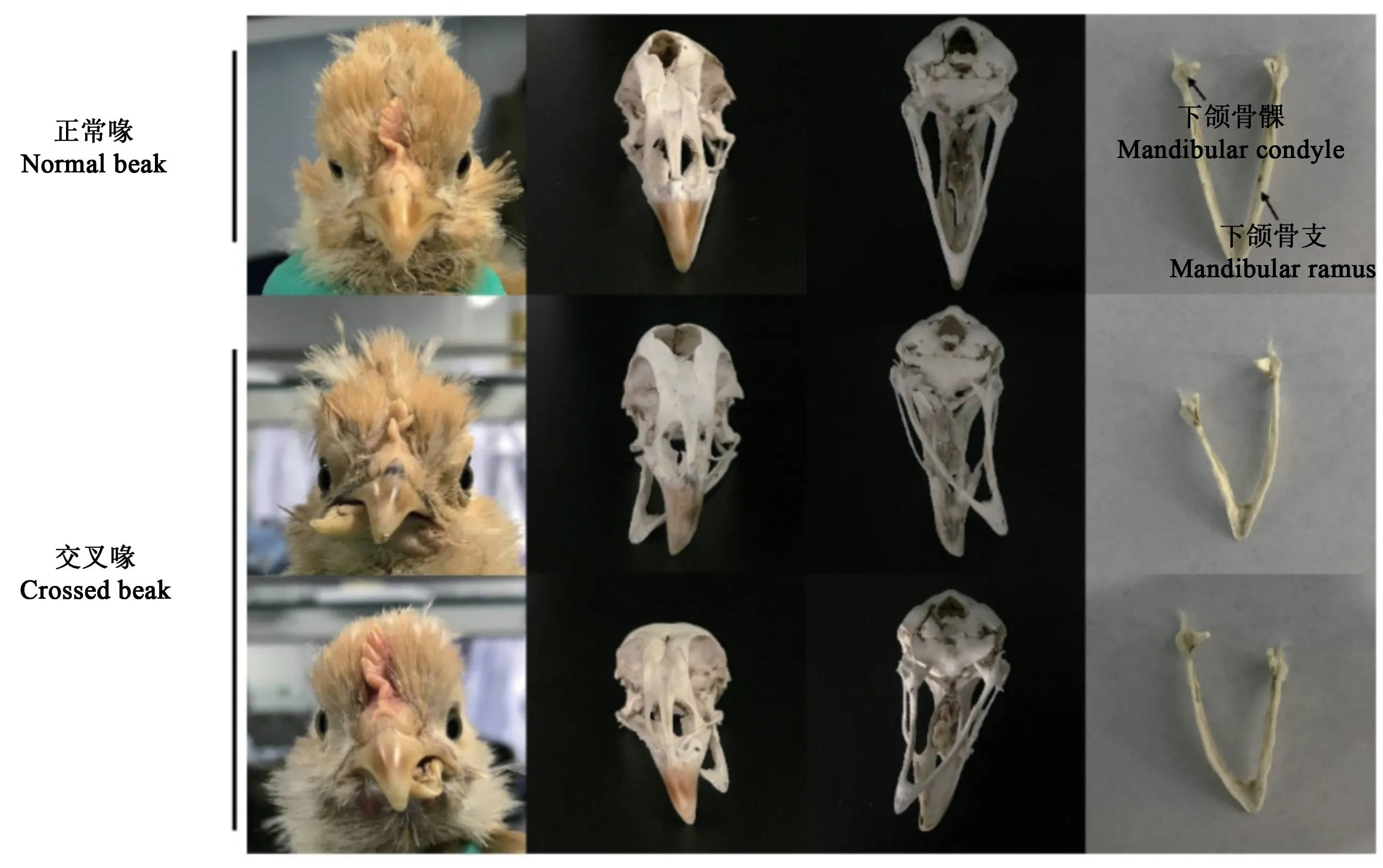
圖1 正常喙與交叉喙北京油雞顱骨解剖觀察[22]Fig.1 Morphological observation of crossed beak and normal beak in Beijing-You chickens[22]
綜上所述,交叉喙表型的復雜性為遺傳方式和分子機制的研究帶來了難度。目前,北京油雞的致畸原因分析較為全面,包括致畸部位定位和發病時間規律,為后續深入探究交叉喙性狀的遺傳機制奠定了基礎。然而,目前仍無法解釋上喙彎曲而下喙正常類型的發病原因。在人類醫學中,同樣存在因下頜骨疾病導致咬合不全,顱面骨不對稱等疾病,包括安氏Ⅲ錯頜和第一、二鰓弓綜合征等[27-29]。人類下頜骨形態異常的研究已處于發展相對較快、趨于成熟和完善的階段,而雞喙形態的研究相對較少,尤其是遺傳方面的研究。因此,未來可以借鑒人類口腔疾病的研究思路和方法,尋找影響交叉喙的遺傳因素。
3 交叉喙遺傳方式
遺傳方式是指遺傳信息傳遞的特點,可通過親代與子代遺傳性狀的相似性及其變異情況進行分析,研究交叉喙的遺傳方式是解析性狀形成機制的重要手段。Hutt[30]和Schrapel[31]根據系譜信息首次提出雞交叉喙性狀是隱性遺傳,后續多位學者通過交配實驗證實,交叉喙是非孟德爾遺傳的復雜性狀[6,20,24,32]。
Landauer[20]將Silver Spangled Hamburgh交 叉喙雞進行隨機交配,發現后代交叉喙發生率在0.02%~0.13%。通過構建交叉喙近交群體,后代交叉喙發生率也僅達到50%,據此提出交叉喙并非孟德爾遺傳性狀,畸形親本的后代正常個體可能攜帶某種修飾基因而抑制了喙畸形基因的表達;進一步研究雜交后代的交叉喙發生率發現,子一代均未出現交叉喙,推測可能是不同種群間的交叉喙基因相互獨立,或者至少在1個主效基因上存在差異。通過比較交叉喙與正常個體的孵化性能,發現交叉喙性狀并不攜帶致死基因[20,24]。
Joller等[5]對Appenzeller Barthuhn雞的交叉喙規律進行研究,發現正常繁種的子一代交叉喙發生率為2.9%,但雙親均為交叉喙時,子一代交叉喙發生率提高至15.7%,推測交叉喙遺傳方式相對復雜。白皓[24]利用12只交叉喙公雞先后與24只交叉喙母雞隨機交配,構建了交叉喙資源群體。在獲得的921只子一代個體中,交叉喙發生率為7.82%,是同批正常繁育群體的11.84倍(畸形率為0.66%)。另外,子一代交叉喙性別比例約為1∶1。回交試驗發現,當子一代與親本同為交叉喙時,子二代交叉喙發生率可達10%。由于交叉喙資源群體并未表現出孟德爾遺傳規律,提示交叉喙是由非性染色體參與的復雜性狀。本課題組通過對交叉喙北京油雞與閉鎖繁育且無交叉喙史的白來航雞進行正反交試驗,發現正交組(北京油雞♂×白來航♀)子一代交叉喙發生率為4.48%,反交組(白來航♂×北京油雞♀)為18.75%。隨后子一代配種(正常×正常、畸形×正常、畸形×畸形),發現正交組子二代的畸形率分別為3.83%、6.21%、16.92%,反交組子二代的畸形率分別為8.71%、5.14%、7.34%,上述結果并未出現明顯規律,推測交叉喙是多基因控制的復雜性狀。
綜上所述,交叉喙遺傳規律復雜已引起諸多學者關注,通過一系列交配試驗確定交叉喙是多基因控制的復雜性狀。另外,交叉喙性狀是否與冠型、胡須、羽色等質量性狀存在連鎖關系還需進一步研究。
4 交叉喙的分子調控機制
隨著高通量測序技術快速發展,國內外學者專家分別從基因組、轉錄組和蛋白組等方面研究交叉喙的分子調控機制。
4.1 基因組學分析
本課題組利用雞600K的SNP芯片,對48只交叉喙和48只正常北京油雞進行單個SNP和基于通路的全基因組關聯研究(genome wide association studies,GWAS),檢測到位于3號染色體的1個SNP位點與交叉喙性狀顯著關聯,以及7個潛在SNP位點,位于1、3、5、6、10和23號染色體[6,21,33]。針對上述位點附近的基因進行功能注釋,發現類轉錄延伸因子B多肽(transcription elongation factor B polypeptide 3-like,LOC421892)基因、Tudor結構蛋白3(tudor domain containing protein 3,TDRD3)基 因、原癌基因(ret protooncogene,RET)和癌基因1(stathmin 1,STMN1)可能是雞交叉喙性狀的重要候選基因,6條顯著性關聯信號通路包括鈣離子信號調控通路、卵母細胞減數分裂通路、泛酸和輔酶A的生物合成通路、丙酮酸鹽代謝通路、甘氨酸、絲氨酸和蘇氨酸代謝通路以及核糖體通路。在全基因組拷貝數變異(copy number variations,CNV)分析中,6個CNV區域的檢出率在交叉喙和正常組之間差異極顯著,在喙畸形雞CNV區域中鑒定出免疫球蛋白樣多肽(leucine rich repeats and immunoglobulin like domains 2,LRIG2)基因。LRIG2在人、獼猴、犬、牛、鼠等動物中高度保守[34],該基因突變可引起人類常染色體隱性、先天性的面部怪異表情疾病[35]。喙的起源和進化與神經嵴細胞密切相關[36],而RET基因在神經嵴生長中具有至關重要的作用[37]。同時,RET與細胞增殖相關,當基因編碼產物增多或活性增強時,細胞快速增殖,形成腫瘤[38]。因此,LRIG2可能與RET互作調控雞喙的發育,并造成交叉喙。然而,Joller等[5]同樣利用600K的SNP芯片對53只交叉喙和102只正常Appenzeller Barthuhn雞進行GWAS分析,最終并未篩選出與交叉喙性狀顯著關聯的位點。研究結果的差異可能是由于不同品種間導致交叉喙的基因相互獨立或主效基因存在差異。綜上,雞交叉喙形成可能與LOC421892、TDRD3、LRIG2、RET、STMN1等位點突變相關。
4.2 轉錄組與蛋白組學分析
朱靜[23]利用數字基因表達譜技術研究交叉喙的形成原因,通過對比56日齡交叉喙個體及其全同胞正常個體下喙的差異表達基因,發現骨形態發生蛋白4(bone morphogenetic protein 4,BMP4)、類似爪角蛋白(claw keratin-like,LOC426217)、O-巖藻糖肽3-β-N-乙酰氨基葡萄糖轉移酶(lunatic fringe,LFNG)、黏液蛋白(mucin protein,MUC)、乙酰輔酶A酰基轉移酶1(acetyl-coA acyltransferase 1,ACAA1)和醛脫氫酶7家族成員A1(aldehyde dehydrogenase 7 family,member A1,ALDH7A1)等候選基因與交叉喙形成相關。BMP4位于雞5號染色體,含有3個外顯子和2個內含子,其表達產物為骨形成蛋白,參與生物過程“喙形態”的條目。同時,BMP4是胚胎期影響雞喙形成的關鍵基因[39-41]。胚胎發育過程中,隨著BMP4增加,喙長度、寬度、深度也相應增長[24]。另外,Hong等[4]通過對105日齡交叉喙雞的下頜骨、頜前骨、額骨和頂骨等進行實時熒光定量PCR(quantitative real time-PCR,qRT-PCR)分析發現,喙畸形雞的下頜骨、頜前骨、淚骨、額骨和頂骨的BMP4表達量隨交叉喙嚴重程度增加而上升。由于顱面骨來源于顱神經嵴細胞[42-43],且顱神經嵴細胞參與調節破骨細胞活性和骨吸收功能[44],因此推測BMP4過表達促使顱神經嵴細胞及其衍生物凋亡[45-47],從而形成交叉喙。LOC426217在畸形喙中顯著上調,并與角蛋白調控密切相關[24,48]。通過對比交叉喙與正常個體的LOC426217序列,發現G36C和A192T在交叉喙雞的基因型頻率顯著高于正常個體。Joller等[5]對交叉喙Appenzeller Barthuhn雞的LOC426217測序,發現G62T、T24C、G36C、T222C和T363C位點與白皓[49]的SNP結果一致,進一步證實LOC426217參與雞交叉喙形成。
白皓[49]基于朱靜[23]數字基因表達譜結果,對細胞角蛋白19(cytokeratin 19,CK19)、半乳糖苷酶6(galactosidase alpha,GLA)、ALDH7A1等候選基因進行轉錄表達和SNP分析,發現CK19、GLA在正常喙中高表達,BMP4在交叉喙中高表達。細胞角蛋白作為細胞骨架的重要組成蛋白,對維持正常細胞形態至關重要。CK19是細胞角蛋白家族成員之一,該基因的表達與人類鼻咽癌的分化和轉移有關。通過直接測序方法檢測候選基因的SNP,發現交叉喙雞CK19啟動子區G272A位點和GLA第7個外顯子的C4815T位點處未突變,但正常雞的基因型頻率差異顯著。另外,交叉喙雞與正常雞的GLA基因以及內含子6區域的A4552C位點均發生突變,兩者的基因型頻率差異極顯著。在ALDH7A1基因A7816T位點,正常雞未發生突變,其與喙畸形雞的基因型頻率差異極顯著,因此,CK19、GLA、ALDH7A1可能是交叉喙形成的候選基因。雖然未見上述基因與喙形成相關,但基因調控本就是復雜的過程,具有一因多效或多因一效作用。Sun等[32]利用iTRAQ技術篩選12日齡的交叉喙和正常雞喙的差異蛋白,發現清蛋白和脂蛋白脂肪酶是導致雞交叉喙的候選蛋白,并可能在調節軟骨、骨細胞和骨量的細胞內游離鈣離子緩沖方面具有重要作用。綜上,通過轉錄和翻譯水平發現多個候選基因差異表達,但其與雞交叉喙的因果關系仍需進一步驗證。
4.3 表觀遺傳學分析
交叉喙由單側下頜骨支發育緩慢引起,下頜骨髁部是骨支的生發中心[23]。Shi等[50]對交叉喙雞雙側下頜骨髁部進行全基因組甲基化測序(whole genome BS-Seq,WGBS)和RNA-seq聯合分析,發現FIGNL1啟動子區存在差異甲基化區域(圖2),且FIGNL1在交叉喙的短骨支側髁部表達下調。FIGNL1是與細胞活性蛋白相關的ATP酶亞組成員,能夠抑制成骨細胞增殖,促進成骨細胞分化。干擾FIGNL1基因會降低顱骨細胞增殖,骨鈣素和堿性磷酸酶表達下調,進而導致成骨細胞礦化能力下降[51]。進一步分析發現,2個差異表達lncRNA(MSTRG.22262.17和MSTRG.22262.19)對FIGNL1具有順式表達調控作用,推測非編碼RNA通過調控靶基因FIGNL1影響下頜骨髁部礦化過程,進而導致交叉喙。
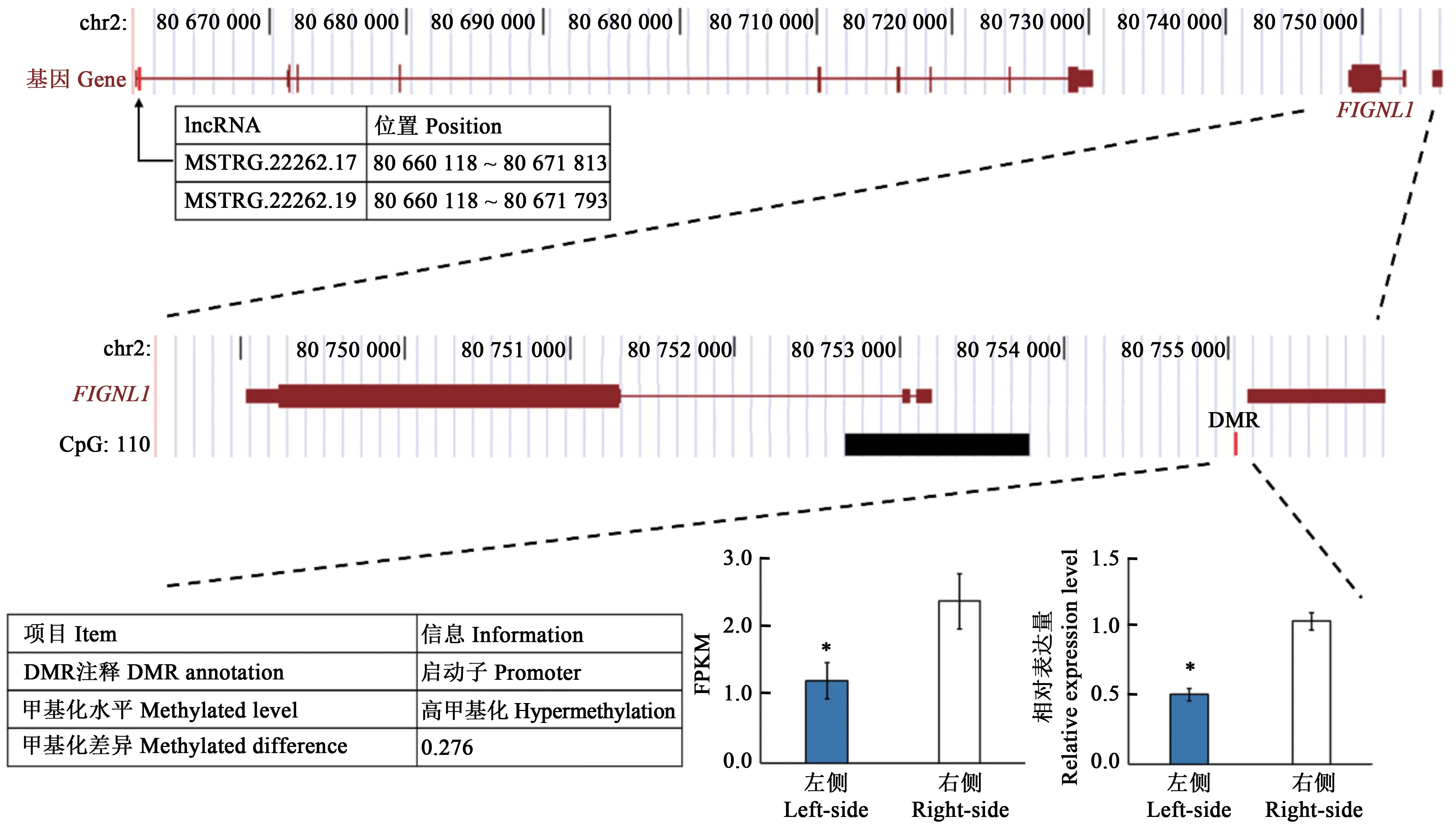
圖2 FIGNL1的基因組位置信息[50]Fig.2 Genome browser track plot around the FIGNL1 locus[50]
綜上,高通量測序已篩選出大量與交叉喙性狀相關的候選基因、SNP位點和蛋白,但這些遺傳因子的功能還需要在細胞和個體水平進行驗證,以進一步揭示交叉喙性狀的分子調控機制。另外,隨著單細胞測序和ATAC測序等新技術的應用,將有助于加快解析交叉喙的遺傳機制。
5 結語
雞交叉喙對家禽業造成了一定程度的經濟損失,并阻礙了地方雞種的資源開發和利用,如何檢測和預防交叉喙性狀是目前需要解決的難題。交叉喙性狀的遺傳機制復雜,已發現的多個候選基因尚未完全得到驗證,相關病理通路也有待進一步解析。在前期研究的基礎上,建立專門的雞交叉喙近交系,應用最新測序技術,進行跨學科的聯合性研究,將有助于精準挖掘雞交叉喙性狀的致病基因和突變位點,減少遺傳缺陷的發病率,最終提升種用價值,實現動物福利和家禽的健康繁育。

