提升上清液Wnt3a蛋白含量的L-Wnt3a細胞培養體系及其促進多能干細胞誘導黑素細胞分化的效應研究
曲勃維, 劉莉萍, 魯浩, 李遇梅
(1. 江蘇大學附屬醫院皮膚科,江蘇 鎮江 212001; 2. 內蒙古醫科大學附屬醫院皮膚科,內蒙古 呼和浩特 010107)
功能性黑素細胞的缺乏與破壞會導致色素脫失性疾病,其中最常見的疾病是白癜風[1]。以白癜風為代表的色素脫失性疾病尚無治愈方法,其治療結果通常不能令人滿意。黑素細胞移植是治療穩定期白癜風的方法之一,治療面積大、復色效果好、不良反應的發生率較低,但自體黑素細胞難以在體外進行大量培養和擴增,因此難以滿足具有廣泛病變患者的治療需要[2]。通過再生醫學手段得到大量再生的黑素細胞并將其應用于臨床研究將會極大地造福色素脫失性疾病的患者[3-4]。多能干細胞能夠無限增殖并可以向三個胚層分化,是細胞療法治療各種疾病與損傷的潛在來源[5]。多能干細胞也可經誘導得到黑素細胞,Fang等[6]于2006年將人胚胎干細胞成功分化為黑素細胞,后續有研究報道使用人誘導多能干細胞生成擬胚體也能夠成功誘導黑素細胞[7-8]。
Wnt3a蛋白在多能干細胞向黑素細胞誘導分化的過程中起重要作用,它可以直接誘導黑素細胞重要轉錄因子(MITF)的表達[9],調節黑素細胞特異性酶酪氨酸相關蛋白1 (TRP1)和酪氨酸酶(TYR) 的表達量[10]。此外,Wnt信號能夠調節黑色素生成[11],通過抑制或刺激個體遷移前神經嵴細胞中的Wnt信號通路,可觀察到缺乏 Wnt1和Wnt3a的小鼠幾乎完全沒有色素細胞[12]。基于Wnt3a在黑素細胞發育中的重要作用,且純化的Wnt3a蛋白獲取成本非常高[13],L-Wnt3a條件培養基作為Wnt3a蛋白的來源被應用于黑素細胞分化實驗[13-16]。L-Wnt3a條件培養基的傳統收集方案中對L-Wnt3a細胞的接種密度、收集的條件與時機以及其中含有的Wnt3a蛋白水平并不明確[13]。不同批次間細胞接種的密度如不相同,將會導致收集的L-Wnt3a條件培養基所含Wnt3a蛋白含量存在差異,會造成黑素細胞分化體系的不穩定。
為了建立穩定的分化體系,本研究利用ELISA法對不同細胞接種密度和不同采集時點的L-Wnt3a細胞培養上清液中Wnt3a蛋白濃度進行定量,優化L-Wnt3a條件培養基的收集方案。使用含有明確Wnt3a濃度的L-Wnt3a條件培養基和Wnt3a重組蛋白作為多能干細胞向黑素細胞誘導體系中Wnt3a來源進行相關驗證。
1 材料與方法
1.1 細胞系、主要試劑和儀器
L-Wnt3a細胞購于美國ATCC公司(CRL-2647TM),胚胎干細胞株WA09細胞購于美國WiCell公司(WAe009-A),多能干細胞株WTC-11細胞購于美國Coriell公司(GM25256),依照江蘇大學附屬醫院倫理許可(AWYXLL20191119-2)分離人表皮黑素細胞。
低糖DMEM、胰酶、TrypLETM消化酶、胎牛血清、2-巰基乙醇、G-418及GlutaMAXTM(美國Gibco公司),高糖DMEM、PBS、青霉素及鏈霉素(美國Hyclone公司),黑素細胞培養基(美國Science Cell公司),佛波醇 12-十四酸酯 13-乙酸酯(PMA)、霍亂毒素、地塞米松、二甲基亞砜、明膠、胰島素-轉鐵蛋白-硒、維生素C、亞油酸-牛血清白蛋白及MCDB培養基(德國Sigma公司),基質膠(美國Corning公司),纖維連接蛋白(美國BD Biosciences公司),AccutaseTM消化酶(美國Innovative Cell Technologies公司),擬胚體形成培養基、mTeSRTM培養基及ReLeSRTM消化酶(加拿大Stemcell Technologies公司),干細胞因子、Wnt3a重組蛋白(美國RD公司),堿性成纖維生長因子及Y-27632(日本Wako公司),內皮素-3(美國ENZO公司),PCR引物由生工生物工程(上海)股份有限公司合成。
移液器吸頭、PCR管(美國Axygen公司),離心管、培養皿及培養板(美國Corning公司),ElplasiaTM細胞培養板(日本Kuraray公司),0.22 μm濾器(美國Millipore公司),加樣槽(中國Biosharp公司)。CCK-8檢測試劑(中國Vazyme公司),ELISA檢測試劑盒(美國RD公司),Hoechst染色試劑(中國Biosharp公司),Masson-Fontana染色試劑盒(中國Solarbio公司),TrizolTM(美國Invitrogen公司),逆轉錄試劑盒及SYBR試劑盒(日本Takara公司)。37 ℃恒溫細胞培養箱、高速低溫離心機、多功能酶標儀、生物安全柜及熒光定量 PCR 儀(美國Thermo Fisher Scientific公司),PCR擴增儀(美國Bio-Rad公司),光學顯微鏡及熒光顯微鏡(日本Nikon公司)。
1.2 培養基的配制
1.2.1 L-Wnt3a條件培養基的傳統收集方案 使用含0.4 mg/mL G-418 的10% 胎牛血清的高糖 DMEM 維持培養L-Wnt3a細胞,當細胞達到70%~80%融合時,使用 0.05%胰酶-EDTA消化細胞傳代,在顯微鏡下觀察到大多數細胞變圓時,加入含 10% 胎牛血清的高糖 DMEM中和胰酶終止消化;按照 1 ∶10 的比例接種細胞,培養4 d 在細胞接近100%融合時,收集第1批次上清液后使用0.22 μm 過濾器過濾,然后在各培養皿中加入高糖 DMEM,繼續培養4 d,收集第2批次上清液后使用0.22 μm 過濾器過濾;將上述2批上清液等體積混合后保存待用。
1.2.2 明確Wnt3a濃度的條件培養基收集方案 當L-Wnt3a細胞密度達到70%~80%融合時,使用0.05%胰酶-EDTA消化細胞進行傳代,將細胞消化后得到的細胞懸液進行細胞計數,按照預先設置好的接種密度接種細胞,當細胞生長到達平臺期后,棄去培養上清液并加入新鮮的10 mL含1%胎牛血清的高糖DMEM;繼續培養48 h后收集上清液,使用0.22 μm過濾器過濾,間隔48 h繼續重復收集上清液3次;用ELISA法測定上清液中Wnt3a蛋白的濃度;以上收集到的3份上清液即為明確Wnt3a濃度的L-Wnt3a條件培養基,保存待用。
1.2.3 黑素細胞分化培養基(明確Wnt3a濃度) 明確Wnt3a濃度的分化培養基,將第1混合溶液中的各試劑充分混合后使用0.22 μm 過濾器過濾,注意避光操作;后添加第2混合溶液中的各個組分。第1混合溶液:10 mL MCDB 201培養基;1 μL 2.5 mmol/L 地塞米松;2.8 μL 3 mg/mL 霍亂霉素;2.5 μL 1 mmol/L PMA;100 μL 10 mg/mL 維生素C。第2混合溶液:一定量的明確Wnt3a濃度的條件培養基 (根據所需分化培養基濃度進行計算);一定量的低糖DMEM(根據添加明確Wnt3a濃度的條件培養基的量計算,兩者總體積確定為40 mL);250 μL 10 μg/mL干細胞因子;50 μL 100 μmol/L內皮素-3;50 μL 4 μg/mL堿性成纖維生長因子;500 μL 亞油酸-牛血清白蛋白;500 μL胰島素-轉鐵蛋白-硒;500 μL GlutaMAXTM。分化3周后,在不含PMA并補充有0.5%胎牛血清的黑素細胞特異性分化培養基中培養。
1.3 L-Wnt3a細胞分泌Wnt3a蛋白相關檢測
1.3.1 CCK-8法測定細胞活力 使用CCK-8檢測試劑測定細胞活力:① 以96孔板為例,將待測細胞樣本進行預培養;② 加入相應不同處理方式的試劑到培養板的各孔中;③ 置于細胞培養箱中培養;④ 吸棄原有培養液,使用PBS或相應培養基漂洗樣本;⑤ 于避光條件下在每孔中加入含CCK-8溶液體積分數為10%的新培養基,注意設置空白對照;⑥ 在培養箱中避光孵育2 h;⑦ 使用酶標儀檢測各樣本450 nm處光密度值。
1.3.2 Hoechst活細胞熒光染色 使用Hoechst 33342試劑進行染色:① 準備待測活細胞樣本,吸棄原有培養基;② 以35 mm培養皿為例,加入1 mL Hoechst 33342 染色液,充分覆蓋待測細胞;③ 在細胞培養箱中避光培養20~30 min;④ 棄去染色液,使用常溫的PBS或培養液洗滌2~3次;⑤ 于熒光顯微鏡下觀察待測樣本。
1.3.3 ELISA法測定Wnt3a濃度 在室溫下按照Wnt3a ELISA試劑盒說明書操作:① 在微孔板中孵育捕獲抗體并封板過夜;② 吸棄各孔液體并用洗板液清洗,然后垂直拍干孔中水分,重復洗滌2次,循環3次;③ 加入封閉液封閉平板1 h;④ 重復步驟②;⑤ 以倍比稀釋的方法加入標準品及待測樣品封板孵育2 h;⑥ 重復步驟②。⑦ 加入檢測抗體封板孵育2 h;⑧ 重復步驟②;⑨ 加入Streptavidin-HRP B封板孵育20 min,避光;⑩ 重復步驟②,避光;配制底物溶液并加入孔內孵育20 min,避光;加入終止溶液,并立即上機檢測,避光。
1.3.4 定量化分析 使用Image J軟件進行細胞圖像數字化處理,通過ELISACalc軟件進行標準曲線擬合及數據計算。
1.4 多能干細胞向黑素細胞分化實驗
1.4.1 多能干細胞的培養 接種多能干細胞至基質膠包被的培養皿中,添加終濃度為 10 μmol/L的Y-27632并十字搖勻,在細胞培養箱中培養。當多能干細胞克隆足夠大時進行傳代;使用ReLeSRTM消化酶,顯微鏡下觀察待克隆中央出現明顯裂隙時中止消化;加入 mTeSRTM培養基,輕輕吹打克隆使其變為小團塊,避免形成單細胞,將細胞接種于mTeSRTM培養基中,十字混勻后放置細胞培養箱中培養,每天更換細胞培養基。
1.4.2 單細胞制作擬胚體 無飼養層上培養的多能干細胞生長到足夠大時,使用AccutaseTM消化酶消化細胞,在顯微鏡下觀察到大多數細胞變圓時,中和消化酶后加入1 mL AggreWellTM擬胚體形成培養基重懸細胞后進行活細胞計數;以24孔ElplasiaTM板為例,每孔接種(2.5~5.0)×105個細胞,加入培養基2 mL;添加終濃度為 10 μmol/L的Y-27632后十字搖勻,置于細胞培養箱中培養;24 h后可形成擬胚體,將其轉移至超低黏附培養板中繼續培養。
1.4.3 黑素細胞懸浮分化方案 當擬胚體的直徑達300~400 μm時,可以開始黑素細胞的誘導分化:收集擬胚體,轉移至離心管中,等待其自然沉降后小心吸棄上清液;加入明確Wnt3a濃度的黑素細胞分化培養基重懸,轉移至超低黏附培養板中進行懸浮誘導分化;每2~3 d進行半量換液;在分化第14天時將擬胚體轉移至纖維連接蛋白包被的培養皿中,繼續使用明確Wnt3a濃度的黑素細胞分化培養基;在分化第21天時進行單細胞傳代,使用 TrypLETMExpress消化酶,收集細胞懸液離心后棄去上清液,使用明確Wnt3a濃度的黑素細胞分化培養基重懸細胞,進行細胞計數后接種于纖維連接蛋白包被的培養皿中,每隔2~3 d更換培養基。
1.4.4 誘導黑素細胞的培養 在細胞達到80%~90%融合時,用纖維連接蛋白包被的培養皿進行傳代;使用TrypLETMExpress消化酶,收集細胞懸液后離心,使用黑素細胞分化培養基重懸細胞,進行細胞計數后接種于纖維連接蛋白包被的培養皿中,每隔2~3 d更換培養基。
1.5 RT-PCR基因檢測
使用TRIzolTM提取 RNA,逆轉錄試劑盒進行逆轉錄,SYBR試劑盒進行RT-PCR。熱循環反應:95 ℃持續30 s,95 ℃ 5 s,60 ℃ 34 s,40個循環;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。PCR反應結束后,檢查確認融解曲線及擴增曲線,檢查運行結果;以GAPDH作為對照,計算各目的基因的ΔCt值,計算相對基因表達量。
1.6 Masson-Fontana染色
使用Masson-Fontana染色試劑盒:① 4%多聚甲醛固定樣本15 min;② 加入氨銀溶液,在56 ℃孵育40 min,避光;③ 用純水清洗樣本,海波溶液處理5 min后用超純水清洗樣本;④ 使用95%乙醇-無水乙醇脫水,二甲苯處理后封片。
1.7 統計學分析
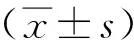
2 結果
2.1 不同接種密度獲取的培養上清液中Wnt3a蛋白濃度的比較
以6.25×103個/cm2(低)、1.25×104個/cm2(中)、2.50×104個/cm2(高)3個密度組分別接種L-Wnt3a細胞,接種48 h的細胞密度差異明顯,其中高接種密度組的細胞已完全融合(圖1)。以傳統方案收集細胞培養上清液,對收集到的上清液中Wnt3a蛋白總量定量分析結果表明,各組Wnt3a的分泌總量比較,差異有統計學意義(P均<0.05),提示以不同密度接種L-Wnt3a細胞獲取的培養上清液中Wnt3a蛋白的濃度差異很大(圖2)。
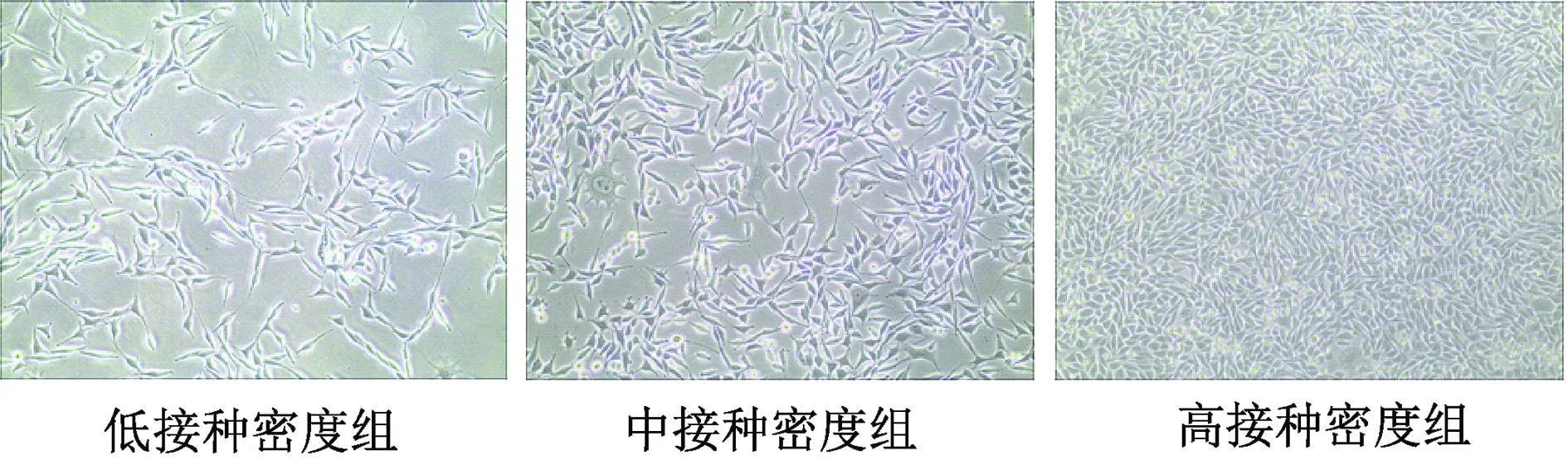
圖1 顯微鏡下觀察不同接種密度的L-Wnt3a細胞在接種48 h的細胞狀態(×100)
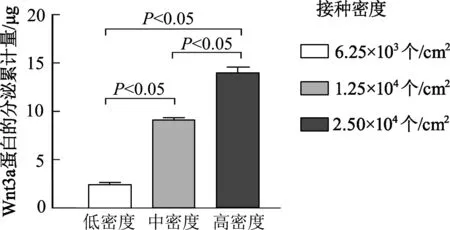
圖2 不同接種密度的傳統法收集培養上清液中所含Wnt3a蛋白總量
2.2 L-Wnt3a 條件培養基收集參數的定量比較及方案優化
中接種密度組的L-Wnt3a細胞生長曲線顯示,培養1~4 d的L-Wnt3a細胞處于增殖狀態,培養4 d后細胞生長進入平臺期,且細胞的維持培養時間至少可達22 d。測定每24 h收集的培養上清液中Wnt3a蛋白濃度并計算分泌累計量,結果顯示培養1~4 d的細胞處于增殖期,Wnt3a蛋白分泌水平也逐漸升高;培養5~10 d的細胞處于平臺期,Wnt3a蛋白分泌量可維持在高水平;培養10 d后分泌量逐漸下降,但仍高于1~4 d的水平。說明在細胞到達生長平臺期后的6 d內,Wnt3a蛋白在培養上清液中的分泌量較高且處于高效率分泌的水平,由此提示此時段可作為高效率收集L-Wnt3a細胞培養上清液的關鍵點位,按照“1.2.2”收集培養上清液的方案,于細胞到達平臺期后每隔2 d收集上清液,共收集3批。生長曲線顯示高、中、低接種密度組分別在培養2、4、6 d進入平臺期。Wnt3a蛋白的分泌情況顯示,3種接種密度收集得到的上清液在細胞到達平臺期后的6 d內收集到的蛋白總量較高,遠高于平臺期前收集到的蛋白總量,3種接種密度在其相對應收集批次的Wnt3a蛋白分泌累計量比較,差異無統計學意義,高接種密度組的收集方式用時最短。見圖3。
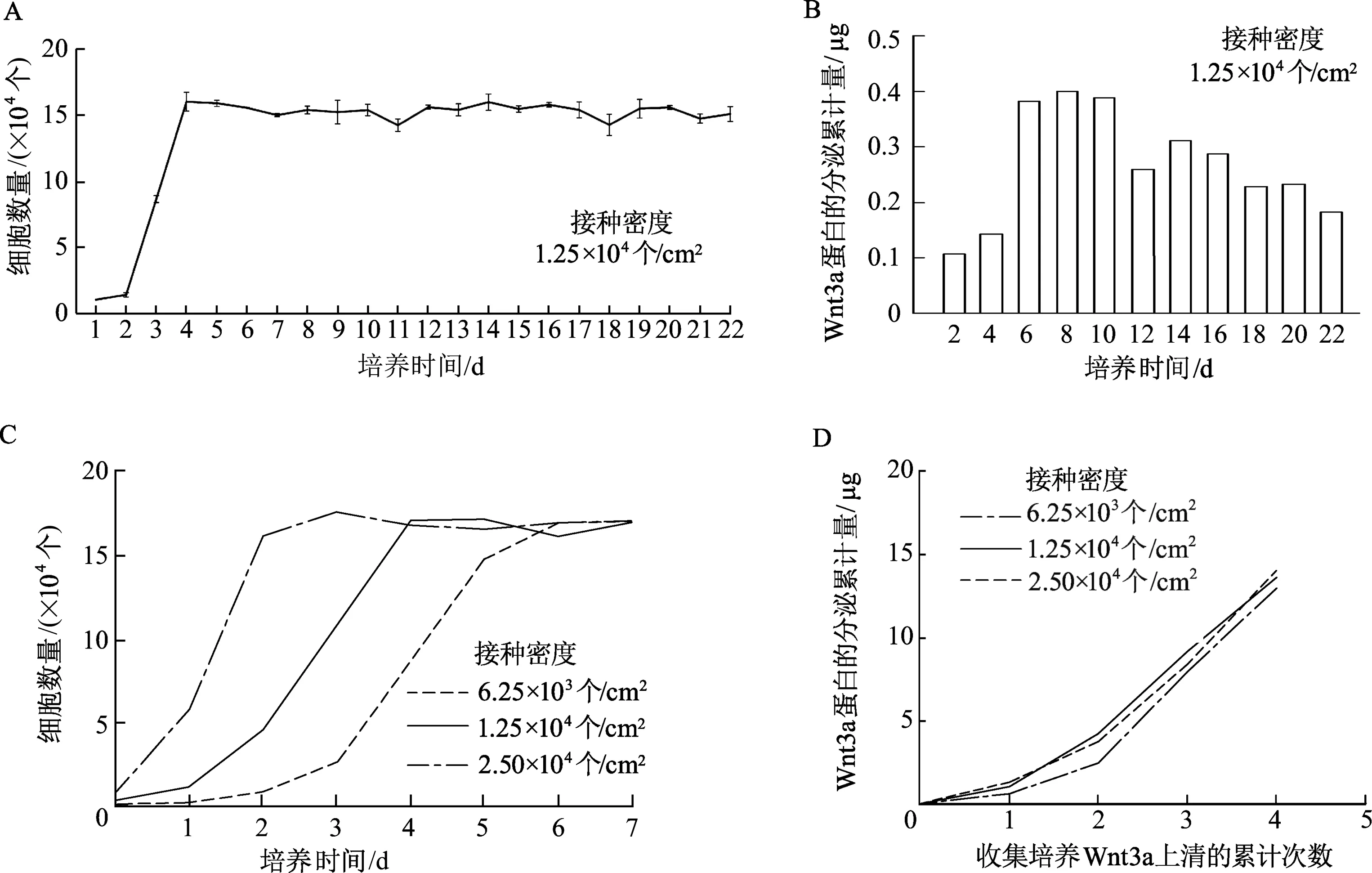
A:特定接種密度L-Wnt3a細胞的生長曲線;B:不同時段L-Wnt3a細胞分泌Wnt3a蛋白到上清液中的情況;C: 3種接種密度L-Wnt3a細胞的生長曲線;D:3種接種密度組以新型上清液收集方式獲得的Wnt3a總量比較
2.3 利用明確Wnt3a濃度的條件培養基誘導黑素細胞生成
使用10、50、100 ng/mL 3種濃度Wnt3a蛋白的黑素細胞分化培養基對胚胎干細胞株WA09及誘導多能干細胞株WTC-11細胞進行黑素細胞的懸浮誘導分化,分化28 d時的結果顯示,各組最終得到的細胞在形態上都呈現樹突狀,與黑素細胞接近,且都具有較好的增殖能力;各組的分化細胞均高表達黑素相關基因MITF、PAX3、SOX10、PMEL、TYR,TYRP1及DCT,低表達SOX2及NANOG基因,幾乎不表達OCT4、LIN28、DNMT3B等多能干性基因(圖4)。分化42 d的Masson-Fontana染色結果顯示,與人表皮黑素細胞相比較,在誘導得到的細胞中能夠觀察到被染為黑色的黑色素(圖5)。以上結果驗證了在新型的分化體系,即應用了新型上清液收集方案的明確Wnt3a濃度的培養分化系統中,隨著分化時間的延長,細胞失去干細胞的特性,趨向成熟黑素細胞分化。

圖4 分化28 d時WA09、WTC-11分化組黑素
2.4 明確濃度的條件培養基與重組蛋白在黑素細胞誘導中的效價比較
使用Wnt3a濃度為50 ng/mL的條件培養基與相應濃度的Wnt3a重組蛋白進行分化實驗的結果顯示,分化21 d時各組均有黑素發育相關基因如MITF、PAX3、SOX10、PMEL、TYR、TYRP1及DCT的表達(圖6)。在分化后期對兩株多能干細胞分化的黑素細胞進行Masson-Fontana染色,在條件培養基以及重組蛋白各組中均能觀察到被染為黑色的黑色素(圖7)。結果表明,明確Wnt3a濃度的條件培養基與相應濃度的重組Wnt3a蛋白均可作為黑素細胞分化中Wnt3a蛋白的來源,能夠達到相似的效果。
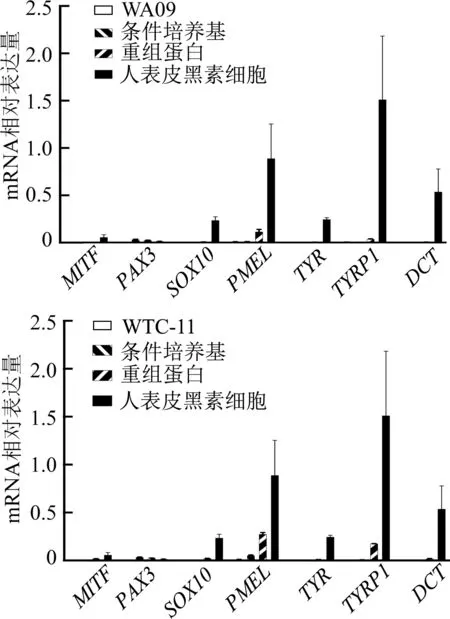
圖6 分化第21天WA09、WTC-11
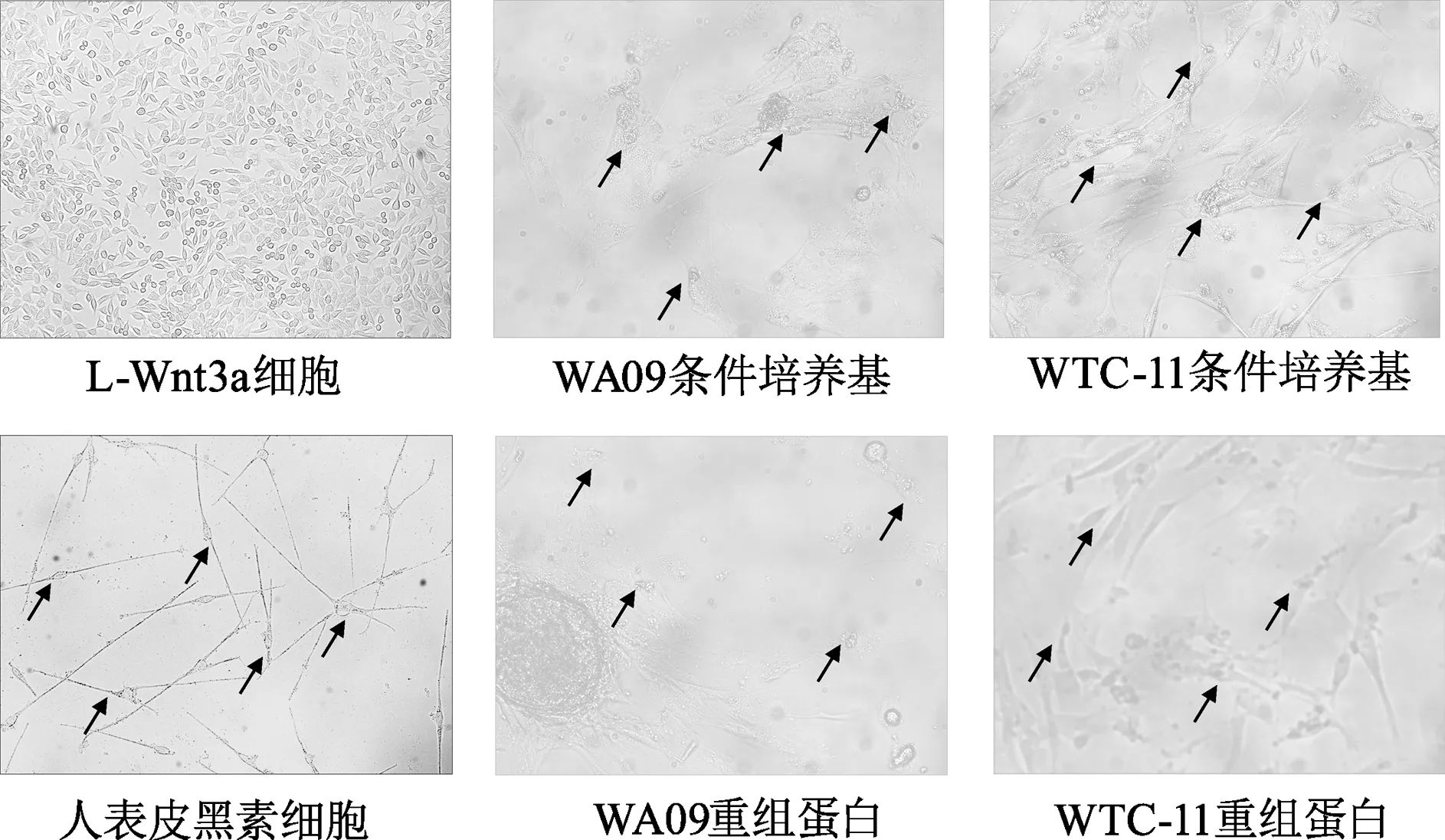
圖7 黑素細胞的功能鑒定(Masson-Fontana染色,×200)
3 討論
黑素細胞由神經嵴發育而來,在人體中黑素細胞通過與周圍的角質形成細胞、組成表皮黑素單元并以黑素小體的形式傳遞黑色素,黑色素是保護皮膚抵御紫外線輻射損傷及形成膚色的重要基礎。通過多能干細胞分化來大量擴增并替代治療白癜風等功能性黑素細胞缺乏與破壞導致的疾病,有符合倫理要求、細胞來源廣泛、能夠大量擴增的優勢。而多能干細胞的分化是一個復雜和長期的過程,不斷優化分化方案、使多能干細胞分化的條件更為穩定及可控是當前研究的重點方向。
Fang等[6]在人胚胎干細胞分化為黑素細胞的實驗中使用了L-Wnt3a條件培養基作為分化體系中Wnt3a蛋白的來源。研究發現[7-8],人誘導多能干細胞生成擬胚體也能夠成功誘導黑素細胞。進一步研究發現,使用較均一的擬胚體進行三維黑素細胞分化較傳統方法具有更高的分化效率[17],而形狀規則的、光滑的非囊性擬胚體與具有明亮或黑暗空腔的囊狀擬胚體相比,更易分化成黑素細胞[8]。
以上研究針對分化使用的生長因子以及分化條件進行探索,但并未對分化體系中提供Wnt3a蛋白來源的L-Wnt3a條件培養基制作條件進行精密的控制。本研究通過對L-Wnt3a細胞生長狀態進行監測并繪制細胞生長曲線,分時段收集培養上清液并利用ELISA法測定蛋白含量,對Wnt3a蛋白分泌水平進行監測。設計了不同于傳統方法[6,17-18]的明確了細胞接種密度、培養上清液按批次收取且不互相混合并標定其濃度的新型收集方案。發現在培養的全程,這種細胞均能夠分泌Wnt3a蛋白,在生長到達平臺期后的6 d內,分泌Wnt3a蛋白的效率高于其他時段,與初始接種密度無關。這種方案在細胞接種8 d后即可收集3個批次、可用于后續研究的條件培養基,極大地提升了效率。
應用于黑素細胞分化體系中的Wnt3a蛋白濃度如果不明確,會造成分化體系的不穩定,從而對后續的多能干細胞來源的黑素細胞生成效率造成影響。使用本研究設立的明確Wnt3a濃度的黑素細胞懸浮誘導分化系統,能夠較穩定地對胚胎干細胞株WA09及誘導多能干細胞株WTC-11細胞維持分化并得到誘導黑素細胞。在分化過程中多能干細胞相關基因表達下調并逐漸表達黑素相關基因,誘導得到的細胞具有與人表皮黑素細胞類似的樹突狀生長的形態學表現,Masson-Fontana染色陽性提示有成熟的黑色素顆粒生成,提示明確Wnt3a濃度的黑素細胞懸浮誘導分化體系能夠成功得到誘導黑素細胞。使用L-Wnt3a條件培養基與Wnt3a重組蛋白作為分化培養基中的Wnt3a來源,均能夠對兩株多能干細胞進行黑素細胞的誘導分化,從而得到誘導黑素細胞。
本研究建立的明確Wnt3a蛋白濃度的培養上清液收集方案操作簡便、收集周期短并能應用于多能干細胞誘導黑素細胞分化體系,進一步減少黑素細胞再生過程中的未知因素。而Wnt3a蛋白作為重要的生長因子,在其他類型細胞的再生中也是重要的研究方向,本研究可為其提供一定的參考與思路。
綜上所述,本研究優化的L-Wnt3a培養上清液收集方案能夠穩定高效地獲取Wnt3a蛋白,應用于明確Wnt3a蛋白濃度的多能干細胞黑素細胞分化體系,成功得到誘導黑素細胞,L-Wnt3a 條件培養基與重組Wnt3a蛋白在多能干細胞來源的黑素細胞誘導中具有相似效價。

