干擾脊椎蛋白2表達抑制肺腺癌細胞增殖和轉移能力的研究
李艷光,任明明,牛潔婷,唐國杰,孫震,孔繁義,宋翔
肺癌是全球癌癥相關死亡的主要原因之一,發病率也較高,肺癌主要有2個亞型:小細胞肺癌和非小細胞肺癌(NSCLC),肺腺癌是最普遍的NSCLC類型。盡管近幾十年來,包括免疫療法、放療和手術切除治療在內的多種治療手段已使療效大大提高,但肺腺癌的臨床治療效果仍然不滿意,其總體5年生存率<15%[1]。目前肺腺癌的發病機制尚未完全明確,因此了解肺腺癌的發病機制并確定NSCLC患者有效療法的潛在機制具有重要意義。脊椎蛋白2 (spondin2, SPON2 ),也稱為Mindin、Dil1或M-Spondin,是一種細胞外基質蛋白,已知與整聯蛋白受體結合,可調節免疫功能[2]。最近研究表明,在包括結直腸癌、肝細胞癌和胃癌等各種惡性腫瘤中,SPON2表達上調[3-5]。在結直腸癌中,SPON2可通過激活整聯蛋白β1/PYK2軸來促進單核細胞的細胞骨架重塑和細胞遷移,以促進結直腸癌的惡性進展。在胃癌中Notch信號通路激活通過增加SPON2表達促進腫瘤細胞的增殖、遷移和侵襲能力。SPON2具有抗腫瘤治療分子靶點的潛力。Yuan等[6]報道SPON2在肺腺癌組織中表達上調,其高表達與肺腺癌患者不良臨床病理參數相關,但是 SPON2在肺腺癌中發揮的具體作用和分子機制尚不清楚。因此,本研究旨在獲得SPON2作為肺腺癌治療的潛在分子靶點提供實驗室依據,報道如下。
1 材料與方法
1.1 材料 (1)研究對象:病理組織:收集2015年1月—2016年12月河北省滄州市中心醫院胸外科行手術切除的肺腺癌組織及其配對的癌旁組織樣本各86份,用于免疫組織化學法檢測。細胞系:肺腺癌細胞系A549購自美國ATCC細胞庫。(2)試藥、試劑:甲苯及乙醇購自天津風船試劑公司;IHC DAKO試劑盒購自丹麥;DMEM-F12培養基、胎牛血清、青霉素/鏈霉素和BCA蛋白濃度檢測試劑盒均購自美國Thermo公司;SPON2 siRNA購自上海吉凱基因有限公司;Lip2000轉染試劑購自美國Invitrogen公司;CCK8試劑購自美國sigma公司;細胞周期檢測試劑盒購自上海碧云天試劑有限公司;PARP蛋白裂解試劑和ECL化學發光試劑盒購自北京索萊寶試劑公司;Transwell小室購自美國coring公司;PVDF膜購自美國millipore試劑公司; SPON2一抗(IHC: ab215451)、SPON2一抗(westernblotting: ab171955)和GAPDH一抗(ab171955)抗體購自英國Abcam公司。(3)儀器設備:Transwell小室購自美國coring公司;酶標儀(型號 Varioskan LUX)購自美國Thermo公司;加濕培養箱(型號 BIC-100型)購自上海儒一恒溫公司;顯微鏡(型號 DM2700M)購自德國Leica公司;流式細胞儀(型號 FACSVia)購自美國BD公司。本實驗嚴格遵守赫爾辛基宣言及人體臨床組織的使用,經醫院人體實驗機構倫理委員會批準(201402104),患者及家屬均知情同意并簽署知情同意書。
1.2 實驗方法 2021年1月—2022年4月于河北省滄州市中心醫院進行實驗。
1.2.1 細胞培養:采用DMEM-F12培養基培養肺腺癌細胞系A549,并添加10%胎牛血清和青霉素/鏈霉素100 U/ml,放置在含有5% CO2的37℃加濕培養箱中培養。細胞融合度為90%時,采用胰酶消化收集細胞,進行細胞傳代,用于后續實驗。
1.2.2 SPON2 siRNA轉染細胞:處于對數期生長的肺腺癌細胞系A549消化后,以2.0×105個細胞鋪至6孔板中,分為si-NC組和si-SPON2組,放置在含有5% CO2的37℃加濕培養箱中培養。各組細胞貼壁更換為無血清培養基待轉染,采用 lip2000轉染試劑按照說明書分別將5 μg NC siRNA 轉染至si-NC組,5 μg SPON2 siRNA轉染至si-SPON2組。放置在含有5% CO2的37℃加濕培養箱中培養,12 h后更換培養基繼續培養。
1.3 觀測指標與方法
1.3.1 免疫組織化學法(IHC)檢測SPON2蛋白表達:采用4%聚氧甲基固定待檢測的肺腺癌組織及其配對的癌旁組織樣本1 h,通過乙醇梯度脫水并浸潤石蠟制成5 μm的石蠟切片。石蠟切片經烤片1 h后浸入二甲苯中脫蠟30 min,然后經乙醇梯度水化20 min。在枸櫞酸鈉抗原修復液中高溫煮沸3 min,冷卻后放置內源性過氧化物酶液中孵育30 min封閉非特異性抗原,PBS沖洗3次,每次3 min,后將切片在4℃下與SPON2一抗抗體(1∶100)孵育過夜,PBS沖洗3次,每次3 min,后經二抗37℃孵育30 min,然后經顯色及蘇木精復染后封片。2位病理學醫生采用以下標準評估IHC結果:包括染色強度0分(陰性),1分(弱陽性),2分(中度陽性)和3分(強陽性)。染色面積:0分(<5%),1分(5%~25%),2分(> 25%~50%),3分(> 50%~75%)和4分(>75%)。將染色強度得分乘以染色面積得分來計算SPON2蛋白的最終表達評分。染色得分定義如下:得分≥3分為高表達,≤2分為低表達。
1.3.2 CCK8實驗和集落形成實驗檢測A549細胞增殖能力:(1)CCK8實驗:將si-NC組和si-SPON2組A549細胞以每孔2 000個細胞、培養基150 μl鋪至96孔板中,每組設置6個平行復孔。在24、48、72 和 96 h時分別加入 CCK8溶液10 μl,放置在含有5% CO2的37℃加濕培養箱中繼續培養2 h。震蕩混勻后采用酶標儀測量0、24、48、72、96 h時各孔細胞450 nm處的吸光度值(OD值)。(2)集落形成實驗:將si-NC組和si-SPON2組A549細胞以每孔300個細胞、2 ml鋪至6孔板中,每組設置3個平行復孔,放置在含有5% CO2的37℃加濕培養箱中繼續培養,每2 d更換1次新鮮培養基。肉眼觀察到細胞克隆團后,終止培養,PBS洗3次,無水乙醇固定30 min,并用1%結晶紫染色10 min,計數細胞克隆團數目。
1.3.3 流式細胞術檢測細胞周期分布率:收集si-NC組和si-SPON2組A549細胞,采用4℃的PBS洗滌2次后,以每管5×105個細胞收集至流式細胞管中,每組設置3個平行復孔。采用緩沖液500 μl重新懸浮細胞后,加入碘化丙啶染色液(PI)25 μl和RNase A 10 μl混勻,常溫避光孵育30 min,流式細胞儀測定細胞周期分布率。
1.3.4 Transwell實驗檢測穿膜細胞數目:收集si-NC組和si-SPON2組A549細胞,PBS洗滌2次后,以每孔1.0×106個細胞重懸至無血清培養基100 μl中,并均勻加至Transwell小室上室的膜中,再放入含有500 μl完全培養基的Transwell小室下室中,放置在含有5% CO2的37℃加濕培養箱中。培養12 h后終止培養,擦掉Transwell小室上室中未穿過膜的細胞,PBS將下室面的細胞洗3次后,放入甲醇溶液中15 min以固定細胞,結晶紫染色15 min。PBS洗3次后,顯微鏡下計數穿膜細胞數目。
1.3.5 Western-blot檢測蛋白表達:收集si-NC組和si-SPON2組A549細胞,PBS洗滌2次后,加入PARP蛋白裂解液,充分裂解細胞。低溫高速離心,吸取上清液。采用BCA蛋白濃度測定試劑盒測得細胞周期蛋白D1(Cyclin D1)、細胞周期蛋白依賴激酶4(CDK4)、基質金屬蛋白酶7(MMP-7)、MMP-9濃度,加入蛋白上樣緩沖液煮沸使蛋白變性。采用10% SDS-PAGE凝膠電泳分離蛋白質,采用濕轉將蛋白轉移到聚偏二氟乙烯 (PVDF) 膜上。PVDF與5% 封閉液室溫孵育2 h后,分別與一抗稀釋液4℃孵育過夜、二抗稀釋液室溫孵育1 h。最終采用ECL試劑盒顯示曝光蛋白條帶。
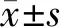
2 結 果
2.1 肺腺癌組織及其癌旁組織中SPON2表達比較 IHC結果顯示,肺腺癌組織中SPON2的陽性表達率為59.30%(51/86),高于癌旁組織中的陽性表達率43.02%(37/86),差異有統計學意義(χ2=5.821,P=0.016),見圖1。

圖1 肺腺癌組織、癌旁組織中SPON2的表達比較(免疫組織化學染色,×200)
2.2 2組肺腺癌細胞SPON2表達比較 qRT-PCR結果顯示,si-SPON2組細胞中SPON2的表達量為(1.00±0.03),明顯高于si-NC組的(0.41±0.02) (t=28.343,P<0.001)。
2.3 SPON2對肺腺癌細胞增殖能力的影響 CCK8實驗檢測結果顯示,與si-NC組比較,si-SPON2組細胞增殖活性在不同時間(24、48、72、96 h)顯著降低(P<0.05),見表1;集落形成實驗檢測結果顯示,si-SPON2組肺腺癌細胞的克隆形成數目為(50.67±8.75)個,低于si-NC組的(117.33±14.09)個,差異有統計學意義 (t=6.961,P<0.001),見圖2。
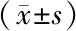
表1 si-NC組和si-SPON2組不同時點肺腺癌細胞450 nm OD值比較

圖2 2組肺腺癌細胞的克隆形成數目比較
2.4 SPON2對肺腺癌細胞周期的影響 流式細胞儀檢測結果顯示,與si-NC組比較,si-SPON2組G0/G1期的細胞分布增加(P<0.01),G2/M期的細胞分布增加(P<0.05),S期的細胞分布減少(P<0.01),見表2。

表2 si-NC組和si-SPON2組肺腺癌細胞各個細胞周期細胞比率比較
2.5 抑制SPON2對肺腺癌細胞轉移能力的影響 Transwell實驗檢測結果顯示,si-SPON2組肺腺癌細胞的穿膜數目為(20.33±4.87)個,少于si-NC組的(58.67±9.63)個,差異有統計學意義(t=6.154,P=0.002),見圖3。

圖3 抑制SPON2對肺腺癌細胞轉移能力的影響
2.6 抑制SPON2對肺腺癌細胞中細胞周期相關蛋白和轉移相關蛋白的影響 Western-blot實驗檢測結果顯示,與si-NC組比較,si-SPON2組肺腺癌細胞CyclinD1、CDK4、MMP-7、MMP-9表達均減少,差異有統計學意義(P<0.01),見圖4、表3。

圖4 抑制SPON2對肺腺癌細胞周期相關蛋白和轉移相關蛋白表達的影響
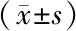
表3 si-NC組和si-SPON2組肺腺癌細胞周期相關蛋白和轉移相關蛋白表達比較
2.7 SPON2表達在肺腺癌患者不同臨床病理參數間比較 在肺腺癌T分期T3~4期、N分期N1~2期、TNM分期Ⅲ~Ⅳ期患者中SPON2表達高于T1~2期、 N0期、Ⅰ~Ⅱ期,差異具有統計學意義(P<0.05),在不同性別、年齡患者中的表達差異無統計學意義(P>0.05),見表4。

表4 SPON2在肺腺癌組織中的表達水平與臨床病理參數之間的關系 [例(%)]
2.8 SPON2表達與肺腺癌患者預后的關系 與低表達SPON2的肺腺癌患者比較,高表達SPON2的肺腺癌患者預后較差,差異有統計學意義(χ2=4.877,P=0.027),見圖5。

圖5 不同SPON2表達的肺腺癌患者預后生存曲線比較
3 討 論
SPON2通過直接與細菌和病毒病原體結合,引發先天免疫反應,是一種宿主先天免疫調節劑,是編碼細胞外基質蛋白的F-Spondin超家族成員[7]。研究表明其表達異常在腫瘤進展中發揮重要作用,既往研究報道,在腎透明細胞癌和肝細胞肝癌中SPON2過表達,其中在腎透明細胞癌中SPON2表達與患者分期、組織分級和復發均顯著相關[8],在肝細胞肝癌組織中SPON2的高表達與患者腫瘤較大及患者預后較差相關[4],可作為腎透明細胞癌和肝細胞肝癌預后生物標志物。同時Yuan等[6]研究發現,在肺腺癌中SPON2蛋白的過表達與腫瘤分化、陽性淋巴結轉移、較高的血清癌胚抗原(CEA)水平和整體存活率不佳相關。本研究結果顯示,SPON2在肺腺癌組織中的表達顯著高于其配對的癌旁組織,SPON2在T分期、N分期、TNM分期較高及預后較差的肺腺癌組織中表達相對較高,并是肺腺癌患者預后不良的獨立危險因素,與已有的報道具有一致性[6,9],均提示SPON2可以用作監測肺腺癌預后的生物標志物,但對于某個臨床病理特征的不一致,可能是由樣本量及樣本來源的區域不同而導致的,后續本研究會繼續擴大樣本量進行驗證。
SPON2具有驅動肺腺癌發生發展的生物學功能,而不僅僅是顯示患者預后不良的生物標志物。查閱文獻顯示,SPON2在結直腸癌、胃癌等惡性腫瘤中促進腫瘤的進展,其中在胃癌中SPON2與Cyclin D1的啟動子區結合,促進其轉錄水平增加,促進胃癌細胞的增殖[3,9]。結合Yuan等[6]的研究及本研究結果,SPON2在T分期和TNM分期晚期的肺腺癌患者中表達升高,提示SPON2可能促進肺腺癌細胞的增殖。本研究CCK8實驗和集落形成實驗結果均顯示,抑制SPON2的表達可抑制肺腺癌細胞的增殖能力。在正常生理過程中,細胞周期具有嚴密的調控機制,當細胞周期調控失調時,細胞增殖能力增加,是腫瘤發生發展的重要機制之一[10-12]。本研究結果顯示,抑制SPON2的表達后,肺腺癌細胞周期阻滯在G0/G1期,表明SPON2促進肺腺癌的周期進展進而促進細胞增殖。細胞周期相關蛋白Cyclin D1、CDK4是調控G0/G1期轉換的關鍵蛋白,CDK4與Cyclin D1結合形成復合物,并表現出激酶活性,促進下游蛋白磷酸化,驅動細胞周期進展[13-15]。本研究抑制SPON2的表達后,肺腺癌細胞中Cyclin D1和CDK4蛋白表達降低,表明SPON2通過增加Cyclin D1和CDK4 蛋白的表達促進細胞周期的進展,導致細胞增殖能力增加。與徐正磊等[9]報道的SPON2促進胃癌細胞中Cyclin D1的表達一致,但是本研究未對SPON2和cyclinD1直接結合進行相關研究。
研究發現,SPON2對于募集淋巴細胞和引發免疫反應至關重要,尤其是在腫瘤相關的巨噬細胞(TAM)浸潤中。TAM是腫瘤與免疫微環境之間復雜相互作用的關鍵調節劑,包括腫瘤的遷移調控[16],提示SPON2與腫瘤遷移相關。新近研究表明,SPON2在細胞遷移和腫瘤進展中具有復雜的作用,在肝細胞癌(HCC)的腫瘤微環境中,SPON2-α4β1整合素信號傳導激活增加F-肌動蛋白的重組并促進M1樣表型巨噬細胞的浸潤,而SPON2-α5β1整合素信號傳導失活并防止F-肌動蛋白組裝,抑制HCC細胞遷移能力,研究結果表明,在肝細胞癌中SPON2充當抑癌因子,并利用不同的信號通路在肝細胞肝癌的微環境中執行雙重功能[4]。但是在結直腸癌中SPON2通過促進M2樣表型巨噬細胞的浸潤,以促進腫瘤細胞的轉移。此外SPON2可促進胃癌和腎透明細胞癌的侵襲轉移能力[3]。而在本研究中干擾SPON2的表達,肺腺癌細胞的轉移能力顯著降低,與在結直腸癌和胃癌中的報道一致,也與肺腺癌N分期較高的患者癌組織中SPON2表達較高一致。細胞外基質的降解是細胞入侵和轉移開始的信號,基質金屬蛋白酶(MMP)是參與細胞外基質降解和轉移的重要分子[17],在胃癌組織中SPON2與MMP-9表達呈正比[18],本研究結果顯示抑制SPON2的表達,肺腺癌細胞中MMP-7、MMP-9蛋白表達降低,提示SPON2通過調控基質金屬蛋白酶MMP-7、MMP-9蛋白促進肺腺癌細胞轉移能力。
綜上所述,SPON2在肺腺癌組織中表達升高,與肺腺癌患者不良病理參數和預后相關,SPON2通過調控細胞周期相關蛋白和基質金屬蛋白酶促進肺腺癌細胞增殖和轉移能力。SPON2具有作為肺腺癌患者預后不良生物標志物和分子靶點的重要意義。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
李艷光:設計研究方案,實施研究過程,論文撰寫;任明明:實施研究過程,資料搜集整理,論文修改;牛潔婷:進行統計學分析;唐國杰:課題設計,論文審核;孫震:實施研究過程,分析試驗數據;孔繁義:資料搜集整理,論文修改;宋翔:提出研究思路,分析試驗數據

