解淀粉芽孢桿菌DGL1促燕麥生長分子機制及代謝通路探究
楊 雪,王 添,謝永麗,*,喬有明,陳海龍,陳 蘭,武玲玲
(1.青海省青藏高原優(yōu)良牧草種質資源利用重點實驗室,青海 西寧 810016;2.青海大學省部共建三江源生態(tài)與高原農牧業(yè)國家重點實驗室,青海 西寧 810016;3.青海大學農牧學院,青海 西寧 810016)
燕麥(Avenasativa)是一年生禾本科植物,植株高大,須根系發(fā)達,覆蓋面積廣,具有耐寒、耐鹽堿、抗旱等特點,適宜青藏高原獨特的自然地理環(huán)境,是治理草地退化的先鋒物種[1-2]。同時,燕麥的莖稈嫩而多汁,營養(yǎng)豐富,適宜青飼和曬制干草,是優(yōu)質的飼草飼料,能夠解決青藏高原冬季家畜飼草短缺及營養(yǎng)不足的問題[3-5]。因此,燕麥對于高寒地區(qū)畜牧業(yè)生產和生態(tài)建設都具有重要的意義。芽孢桿菌作為重要的植物根際促生菌[6],可以通過產生植物激素[7]、增加植物對多種營養(yǎng)元素的吸收[8]、誘導植物系統(tǒng)抗性[9]、與病原菌競爭生態(tài)位[10]等方式與寄主植物建立有益的互作關系,提高植物葉綠素、脯氨酸的含量,且增加農作物的產量,為農業(yè)可持續(xù)發(fā)展帶來了新的機遇[11]。因此,了解微生物-植物之間的互作機制,使有益菌能夠更好的適應環(huán)境,對提高植物產量和品質具有重要的應用價值。
轉錄組測序技術能夠從整體研究物種在某一發(fā)育階段或功能狀態(tài)下基因的表達水平,并因其靈敏度高,能發(fā)現(xiàn)新轉錄本等特點,為研究植物生長發(fā)育過程的分子機理奠定基礎,被廣泛應用于農業(yè)、臨床醫(yī)學、食品營養(yǎng)和衛(wèi)生等多個領域[12]。因此,從植物響應芽孢桿菌的角度了解促生機制,通過轉錄組測序分析有助于更好地了解植物應答根際促生菌信號傳導通路的復雜網(wǎng)絡。Sun等研究發(fā)現(xiàn)枯草芽孢桿菌TR21通過調節(jié)JA(茉莉酸)和BRs(油菜素內酯)生物合成途徑,提高香蕉植物對尖孢鐮刀菌(Fusariumoxysporum)的抗性,縮短生長期并增加香蕉的產量[13]。芽孢桿菌還可以提高植物對逆境脅迫的耐受能力,Samaras等報道稱枯草芽孢桿菌MBI600能夠激活水楊酸信號通路中的基因PR-1A和GLUA,茉莉酸/乙烯信號通路中的基因CHI3,LOXD,PAL等與防御機制相關基因的上調表達,這些結果表明,在番茄植株上施用促生菌后激活了番茄系統(tǒng)抗性,增強了對病原菌的抵抗能力[14]。
解淀粉芽孢桿菌DGL1分離自海拔3 010 m的大格勒干旱沙地白刺(N.tangutorum)根圍,具有較好的固氮活性和降解纖維素活性,且能夠抑制銳頂鐮孢病菌(Fusariumacuminatum)、瓜類枯萎病菌(Fusariumoxysporum)、小麥赤霉病菌(Fusariumgraminearum)病菌,并發(fā)現(xiàn)菌株DGL1能夠顯著提高燕麥‘青燕1號’的發(fā)芽率、根長、芽長[15],但其促生分子機制尚不清楚,本研究通過轉錄組測序技術初步探究芽孢桿菌DGL1對燕麥品種‘青燕1號’促生作用的調控機理,以期為芽孢桿菌菌肥促高寒牧草生長提供理論依據(jù)。
1 材料與方法
1.1 試驗材料
植物材料:燕麥(Avenasativa)品種為‘青燕1號’,由青海省青藏高原優(yōu)良牧草種質資源利用重點實驗室提供。
供試菌株:解淀粉芽孢桿菌DGL1(B.amyloliquefaciens)保藏于-80℃超低溫冰箱。
1.2 DGL1菌懸液制備
采用三區(qū)劃線法將DGL1菌株接種于無菌的LB固體培養(yǎng)基上,37℃恒溫培養(yǎng)12 h后,再將新長出的單菌落接種于20 mL LB液體培養(yǎng)基中,在恒溫搖床上(37℃,200 r·min-1)培養(yǎng)12 h,將發(fā)酵液離心收集菌體,用無菌水調整菌液細胞濃度為106cfu·mL-1,制成芽孢桿菌DGL1菌懸液[16]。
1.3 燕麥與DGL1菌懸液互作
挑選種皮完好、大小均等、無病蟲害的燕麥草種‘青燕1號’,將種子置于20% 次氯酸鈉溶液消毒處理30 min,無菌水反復沖洗5次后,播入滅菌營養(yǎng)土的穴盆中(30株·盆-1),每3 d澆灌20 mL蒸餾水,培養(yǎng)條件為25℃,光周期16 h/8 h;將培養(yǎng)12 d的燕麥幼苗從穴盆中取出,分為5組,無菌水清洗根部數(shù)次,濾紙吸去根部水分;其中4組燕麥根部完全浸于細胞濃度為1×106cfu·mL-1的DGL1菌懸液中,建立燕麥與菌液DGL1的互作體系,互作時間為2 h,4 h,8 h,12 h,其余1組為燕麥根部浸于無菌水處理,作為CK對照組(圖1)。

圖1 燕麥根部與菌懸液互作
1.4 燕麥葉部RNA提取及測序文庫構建
將互作2 h,4 h,8 h,12 h的燕麥植株分別從菌懸液取出,濾紙吸去根部液體;快速用滅菌剪刀剪斷葉部,分別用錫紙包好,液氮速凍后置于-80℃超低溫冰箱保存待用,每一處理組3次重復。樣品委托上海美吉醫(yī)藥生物公司完成RNA提取、測序和文庫構建。轉錄組測序試驗步驟如下:將燕麥葉部提取總RNA(5組樣品,每組3個重復,共15個樣品),對提取到的15個樣品進行RNA質檢,將完整的mRNA片段化,將mRNA在逆轉錄酶的作用下反轉成cDNA,隨后合成二鏈,形成穩(wěn)定的雙鏈結構,最后上機測序[17]。
1.5 轉錄組數(shù)據(jù)分析
1.5.1差異表達基因分析 運用TopHat2軟件將測序數(shù)據(jù)與燕麥參考基因組序列進行比對;使用DESeq2軟件對比較組間差異表達的基因進行統(tǒng)計分析,默認參數(shù):p-adjust <0.05、|log2FC|≥1,以無菌水互作的燕麥組為對照,使用SeqPrep軟件進行測序數(shù)據(jù)質控。
1.5.2GO功能分析及KEGG富集分析 采用軟件Goatools進行GO富集分析[18],分析燕麥與菌株DGL1互作后的差異表達基因功能,利用KEGG[19]數(shù)據(jù)庫對差異基因進行富集分析,并分析基因的表達變化情況,本研究主要分析與促生相關差異基因。
2 結果與分析
2.1 轉錄組測序數(shù)據(jù)統(tǒng)計
本研究采用Illumina測序平臺完成轉錄組測序,對獲得的15個樣品的序列數(shù)據(jù)進行Q20,Q30質量值進行堿基準確性的評估,共完成15個樣品的轉錄組分析,共獲得220.87 Gb Clean Data,15個樣品的Clean Data均達到6.24 Gb以上,Q30在95.16%以上,表明數(shù)據(jù)測序錯誤率低,測序質量較好。使用SeqPrep軟件去除掉接頭序列、低質量、含N過多的reads,運用TopHat2軟件將15個樣本分別與燕麥參考基因組序列進行比對,比對率均大于86.68%,GC含量在54%~57%之間(表1)。
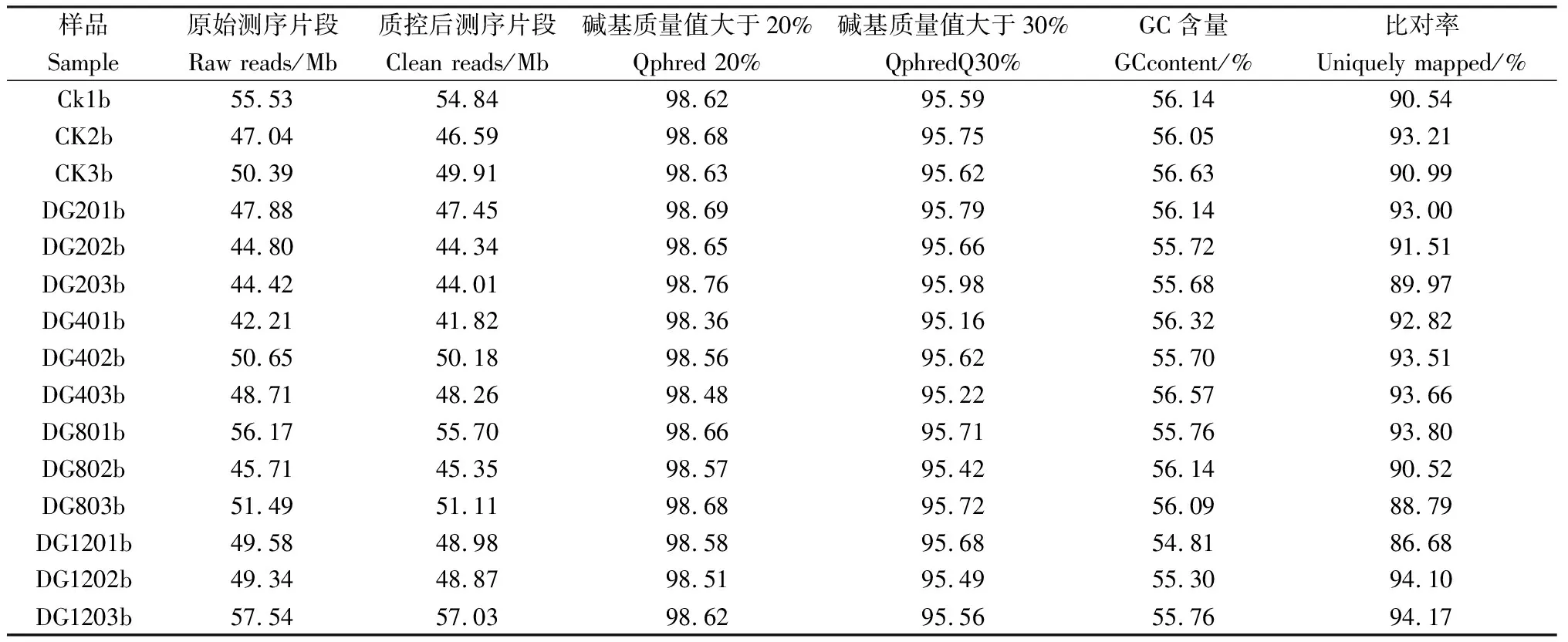
表1 轉錄組測序數(shù)據(jù)統(tǒng)計
2.2 差異表達基因分析
將4個處理組b2(2 h互作組)、b4(4 h互作組)、b8(8 h互作組)、b12(12 h互作組)與對照組(CKb)比對。結果表明:隨著互作時間的增長,差異表達基因(DEGs)的數(shù)量也隨之增加,分別在互作2,4,8和12 h時篩選到1 894,6 130,8 033和12 215個差異表達基因。在互作2 h時,619個基因發(fā)生上調表達,1 275個基因發(fā)生下調表達;在互作4 h時,1 998個基因發(fā)生上調表達,4 232個基因發(fā)生下調表達;在互作8 h時,3 010個基因發(fā)生上調表達,5 023個基因發(fā)生下調表達;在互作12 h時,4 678個基因發(fā)生上調表達,7 537個基因發(fā)生下調表達(圖2)。
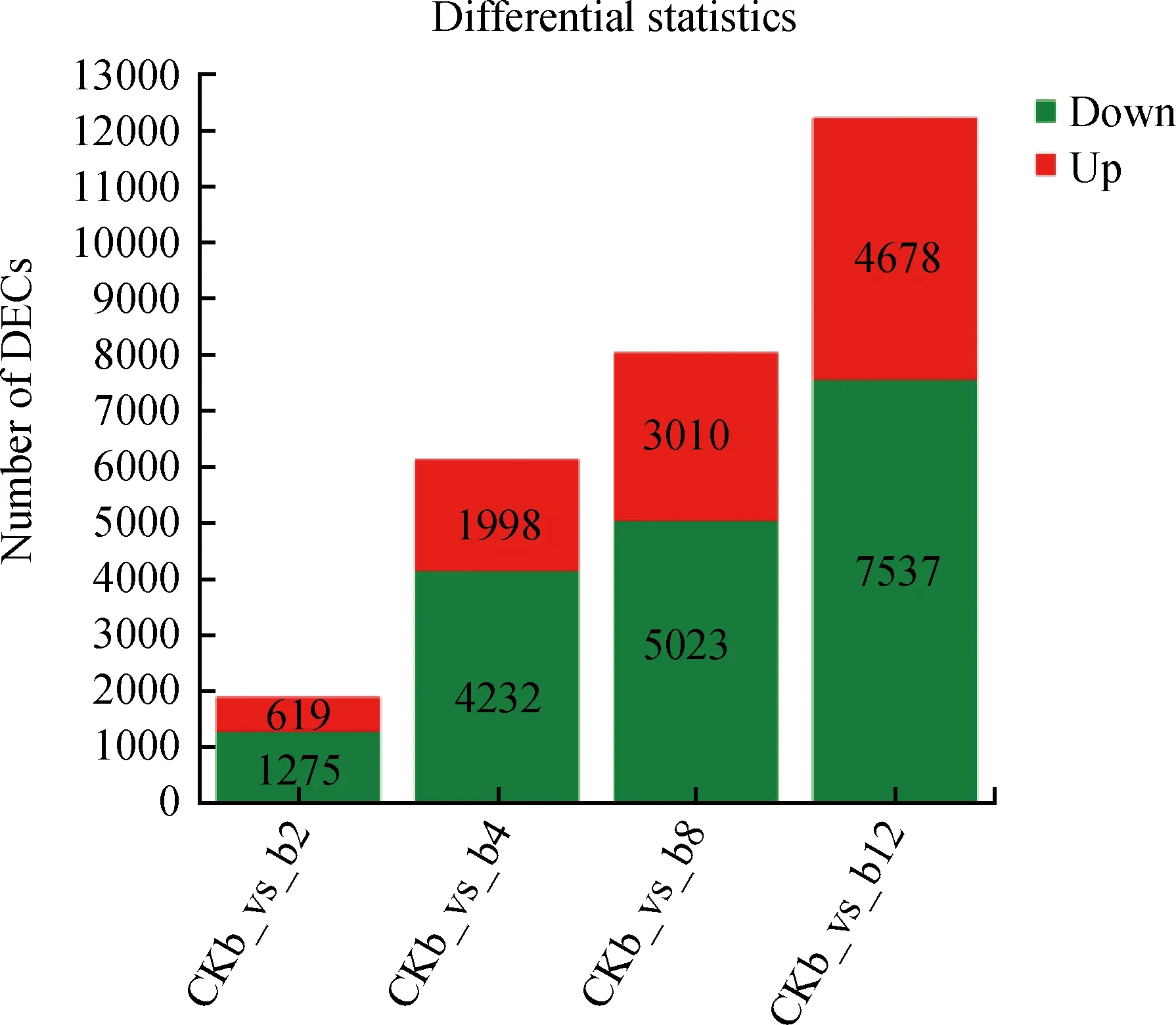
圖2 差異表達基因的統(tǒng)計量匯總
通過差異表達維恩圖分析發(fā)現(xiàn),燕麥與芽孢桿菌互作4個不同時間處理組共有410個差異表達基因,b2(2 h互作組)與b4(4 h互作組)共有581個差異表達基因(圖3),b8(8 h互作組)與b12(12 h互作組)共有3 248個差異表達基因,b4(4 h互作組)與b8(8 h互作組)共有1 843個差異表達基因,b2(2 h互作組)和b8(8 h互作組)共有686個差異表達基因,b2(2 h互作組)和b12(12 h互作組)共有746個差異表達基因(圖3)。
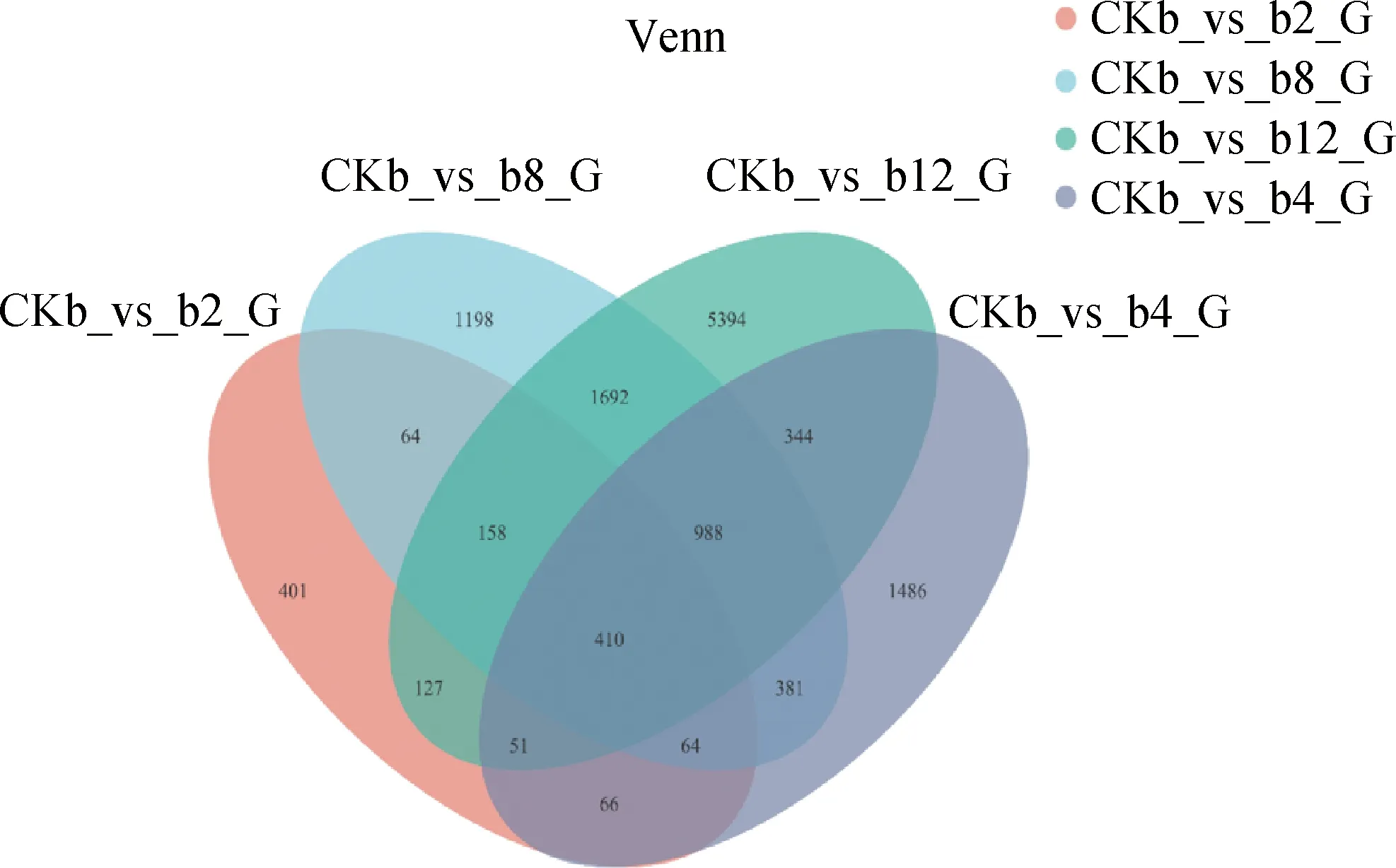
圖3 差異表達基因的統(tǒng)計量匯總
2.3 差異表達基因GO富集分析
采用軟件Goatools對4個處理組的差異基因進行GO富集,分別闡述互作2 h,4 h,8 h,12 h組中差異表達基因所參與的生物過程、分子功能、細胞組分的信息。
互作2 h,在生物過程中,差異表達基因顯著富集在多胺分解代謝過程(GO:0006598)等與植物細胞代謝相關過程中;在細胞成分過程中,基因顯著富集在與膜的組成部分(GO:0016021)、胞間連絲(GO:0009506)、細胞連接(GO:0030054)等與植物細胞、細胞膜的形成相關過程中(圖4A)。
互作4 h,在生物過程中,基因顯著富集在光系統(tǒng)(GO:0006720)、對光刺激反應(GO:0009416)、葉綠素生物合成(GO:0015995)相關過程中;在細胞過程中,基因顯著富集在與葉綠體類囊體膜(GO:0009535)、光系統(tǒng)II(GO:0009523)、光系統(tǒng)I(GO:0009522)相關過程中(圖4B)。
互作8 h過程中,在生物過程中,基因顯著富集在光合作用中光能的捕獲(GO:0009765)、植物細胞壁的生物合成(GO:0009832)有關過程中;在細胞過程中,基因顯著富集在與光系統(tǒng)I(GO:0009522)、細胞器膜的形成(GO:0031967)相關過程中;在分子功能過程中,基因顯著富集在磷酸烯醇式丙酮酸羧化酶活性(GO:0008964)、四吡咯結合(GO:0046906)相關過程(圖4C)。
互作12 h,在生物過程中,基因顯著富集在硫胺素生物合成(GO:0052837)、多胺分解代謝(GO:0006598)等與植物的生長發(fā)育以及脅迫相關的代謝過程;在細胞組分中,基因顯著富集在與葉綠體膜間隙形成(GO:0031972)、質體膜間隙(GO:0009529)等與植物細胞、細胞器、膜相關的過程;在分子功能中,基因顯著富集在蘇氨酸醛縮酶活性(GO:0004793)、蘋果酸合酶活性(GO:0004474)等與植物催化活性相關的過程中(圖4D)。
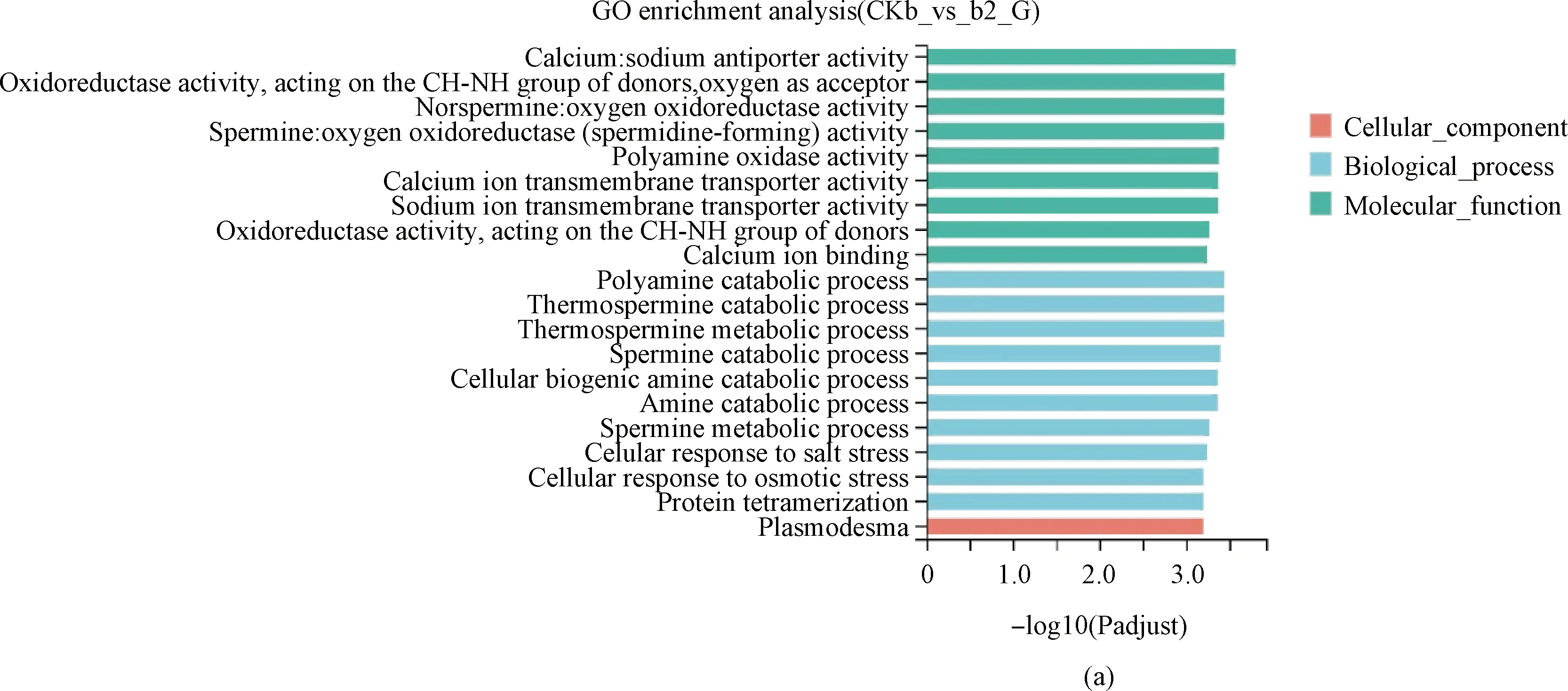
圖4 GO功能分類結果圖
綜上所述,芽孢桿菌DGL1與燕麥根部互作,主要影響燕麥葉部細胞光合器官結構穩(wěn)定、光合碳同化、氨基酸代謝等途徑以此調控燕麥的生長發(fā)育[20]。互作2 h時,差異表達基因顯著富集在多胺分解代謝過程,多胺與植物生長發(fā)育和外界環(huán)境的脅迫反應密切相關,推測DGL1可以誘導多胺分解代謝,從而促進燕麥的花器官、根的形成,提高環(huán)境脅迫的適應能力;互作4 h,差異基因顯著富集在與光合作用相關的代謝通路中,預測DGL1能夠促進葉綠體膜等細胞器膜、光合色素、光系統(tǒng)等的合成,加快光合速率,積累光合產物。互作8 h時,差異基因顯著富集在與光合作用、細胞壁、細胞器膜的合成過程中,其中磷酸烯醇式丙酮酸羧化酶(Phosphoenolpyruvate carboxyki-nase,PEPC)是參與C4碳同化途徑中固定CO2的酶[21],推測DGL1可能通過促進燕麥PEPC酶的活性,促使C3植物燕麥進行一定程度的C4碳同化方式“濃縮”CO2,提高燕麥的光合效率,此外,推測燕麥通過PEPC酶促進草酰乙酸,為保衛(wèi)細胞提供蘋果酸,增強環(huán)境脅迫耐受性。互作12 h時,差異基因顯著富集在硫胺素、多胺等與生物脅迫及非生物脅迫響應方面,蘇氨酸醛縮酶主要參與植物氮素代謝[22],預測DGL1能夠通過提高蘇氨酸醛縮酶活性,增加蛋白質的含量,提高燕麥產量。
2.4 KEGG富集分析
為了進一步探究菌株DGL1促燕麥生長的分子機制,將4個處理組的差異基因富集到KEGG數(shù)據(jù)庫。分析結果表明:互作2 h,差異基因顯著富集在β-丙氨酸代謝途徑、精氨酸和脯氨酸代謝途徑、甘油脂代謝途徑、鞘脂代謝途徑、類胡蘿卜素生物合成途徑等(圖5A);互作4 h,差異基因顯著富集在光合作用-天線蛋白代謝途徑、卟啉和葉綠素代謝途徑、β-丙氨酸代謝途徑、氰基氨基酸代謝途徑、光合生物中的碳同化途徑(圖5B);互作8 h,差異基因顯著富集在光合作用-天線蛋白代謝途徑、植物晝夜節(jié)律途徑、β-丙氨酸代謝途徑、精氨酸和脯氨酸代謝途徑、硫胺素代謝等(圖5C);互作12 h,差異基因顯著富集到植物晝夜節(jié)律途徑、β-丙氨酸代謝途徑、硫胺素代謝途徑、精氨酸和脯氨酸代謝途徑、α-亞麻酸代謝途徑等(圖5D)。
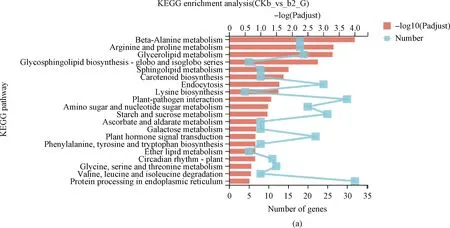
圖5 差異基因Pathway富集結果
KEGG富集分析表明,燕麥植株與芽孢桿菌DGL1互作,燕麥葉片組織的代謝通路發(fā)生了顯著的變化。差異表達基因主要富集在精氨酸、甘油脂等與氨基酸代謝、脂質代謝、多胺合成等相關途徑中,推測DGL1促進燕麥蛋白質、脂質的合成及代謝,促進燕麥的生長發(fā)育并增強逆境脅迫抗逆性;在互作4 h,8 h時,基因顯著富集在光合作用-天線蛋白代謝、卟啉和葉綠素代謝等與光合作用相關的代謝通路中,推測DGL1通過促進燕麥的光合作用,積累碳水化合物、有機酸等光合產物,促進燕麥的生長。
2.5 燕麥應答DGL1相關代謝通路分析
2.5.1植物激素信號通路分析 植物激素作為胞間信號調控植物整個生命周期的生長和發(fā)育,并在多種非生物脅迫響應中扮演著重要的角色[23-24]。通過KEGG分析發(fā)現(xiàn),芽孢桿菌DGL1與燕麥互作2 h,4 h,8 h,12 h,誘導了燕麥葉部色氨酸代謝、類胡蘿卜素生物合成、光合作用-天線蛋白通路、苯丙氨酸代謝、茉莉酸信號轉導途徑中相關基因差異表達。篩選出位于細胞膜上的生長素早期響應AUXI蛋白、Aux/IAA蛋白的編碼基因在菌株DGL1的作用下,在4個處理組中均上調表達,推測芽孢桿菌DGL1可通過誘導燕麥IAA的形成,促進燕麥細胞的分裂、根的伸長、以及果實的發(fā)育。
茉莉酸信號轉導途徑中的核心受體編碼基因COI1在互作2 h上調2.5倍,互作4 h上調3.1倍,互作8 h上調5.7倍,互作12 h上調3.6倍;推測菌株DGL1促進了燕麥的茉莉酸介導的信號轉導途徑。已有相關報道稱,茉莉酸代謝途徑能夠誘導促分裂原活化蛋白激酶(MAP)級聯(lián)反應,鈣通道以及與乙烯、水楊酸和脫落酸相關激素代謝通路之間的相互作用,提高對逆境的抵抗能力[25]。
類胡蘿卜素通過將吸收的光能傳遞到反應中心葉綠素a分子來促進光合作用,可以擴展光合作用過程中的吸收光譜,同時具有保護強光傷害的功效,通過散熱以保護膜和蛋白質免受紫外線的傷害,還為脫落酸的生物合成提供底物[26-28]。通過KEGG富集分析發(fā)現(xiàn),菌株DGL1誘導燕麥ABA受體蛋白編碼基因PYL4基因在互作2 h,4 h,8 h,12 h均上調表達,而ABA的合成能夠有效地調節(jié)植物種類胡蘿卜素的合成,據(jù)鄧昌哲等[29]報道,外源噴施脫落酸,能夠使木薯葉片中胡蘿卜素含量升高,且涉及類胡蘿卜素合成基因上調表達,因此,推測菌株DGL1能夠促進燕麥中PYL4基因上調表達,誘導類胡蘿卜素代謝通路,從而促進燕麥對光能的轉化與吸收,促進光合作用,提高生物量。
2.5.2次生代謝產物通路分析 苯丙烷類生物代謝途徑是合成植物生長發(fā)育所需要的黃酮、木質素、花青素等次生代謝產物主要方式之一,參與植物細胞分化,色素、細胞壁的形成等生理過程[30]。芽孢桿菌DGL1與燕麥互作,誘導燕麥葉部的苯丙烷生物代謝途徑,發(fā)現(xiàn)該通路的關鍵酶苯丙氨酸解氨酶編碼基因PAL在4個處理組均上調表達,作為苯丙烷類生物代謝中最重要的酶,其活性的高低能夠成為衡量植物抗病性的指標[31],因此,推測菌株DGL1通過促進合成苯丙氨酸解氨酶,從而促進次生代謝物的合成,誘導了燕麥的抗病能力,間接促進了燕麥的生長。
2.5.3光合作用相關通路分析 光合作用-天線蛋白通路途徑檢測到光系統(tǒng)Ⅰ中的光合蛋白編碼基因Lhca1,Lhca2,Lhca3,Lhca4,與光系統(tǒng)Ⅱ中的捕光色素蛋白編碼基因Lhcb1,Lhca2,Lhcb3,Lhcb4,Lhcb5,Lhcb6均上調表達。捕光色素蛋白在光能的捕獲、傳遞、分配兩個光系統(tǒng)PSI和PSII中的能量平衡,還能維持光合作用主要細胞器膜類囊體膜的結構[32](圖6),推測DGL1能夠通過誘導燕麥細胞葉綠體中光合鏈相關組分及光系統(tǒng)中相關蛋白編碼基因的表達,穩(wěn)定和增強葉綠體的結構和功能,促進燕麥光合性能、提高光合速率,促進燕麥生物量的增加。
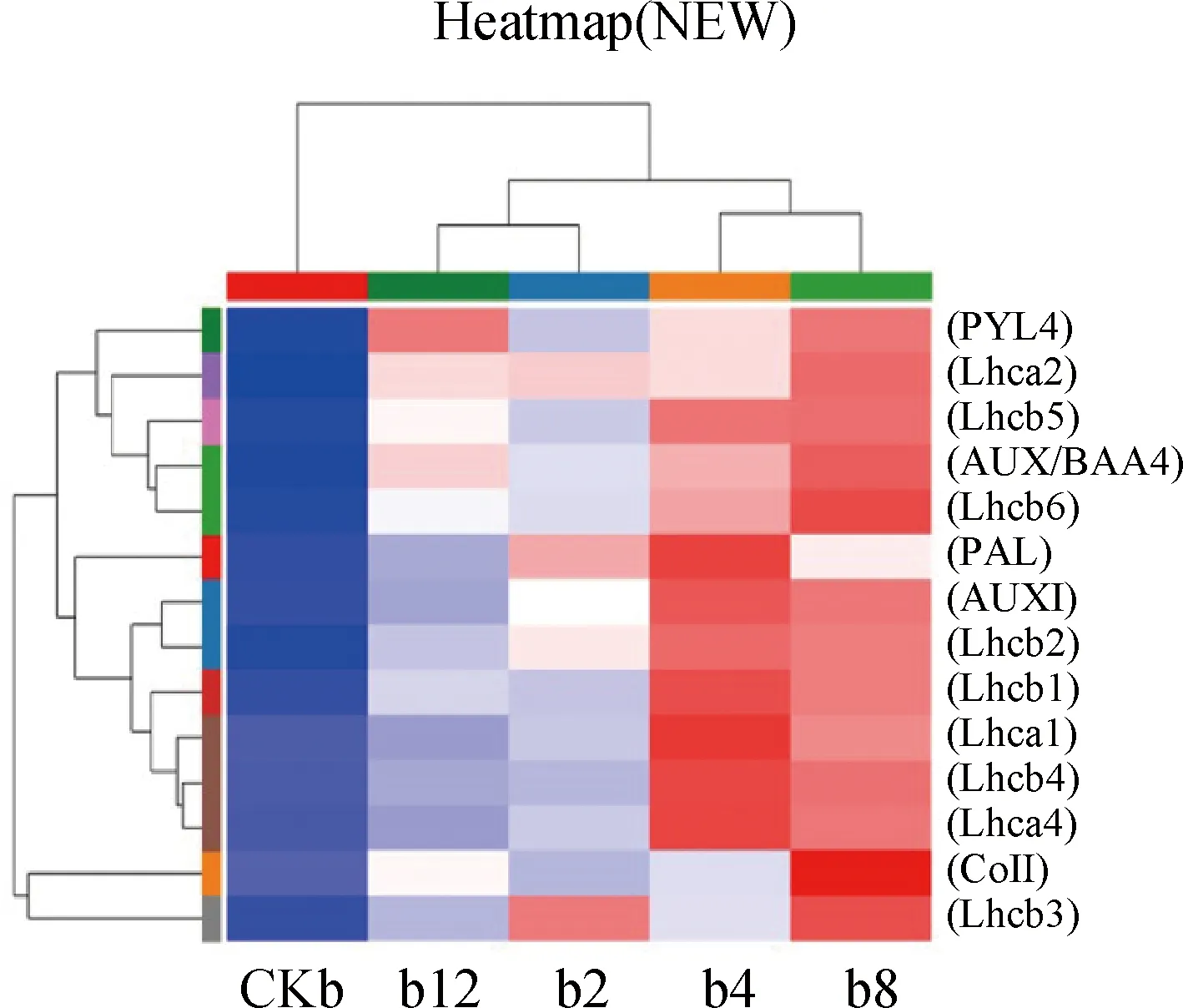
圖6 差異基因Pathway富集結果
2.6 促生相關基因分析
芽孢桿菌DGL1與燕麥互作,篩選出多個與促生相關差異表達基因顯著上調。
2.6.1信號轉導應答 生物及非生物脅迫應答方面,合成絲氨酸/蘇氨酸的蛋白磷酸酶基因PP2C在4個處理組均過度表達,在互作2 h上調7.9倍,互作4 h上調4.2倍,互作8 h上調6.8倍,互作12 h上調5.4倍;已有研究表明PP2C蛋白在植物激素ABA信號轉導途徑具有重要的作用,能夠參與調控種子萌發(fā)、營養(yǎng)器官發(fā)育以及增加植物抗逆性[33]。絲裂原活化蛋白激酶MAPKKK27表現(xiàn)出在互作2 h上調6.6倍,互作4 h上調7.1倍,互作8 h上調6.8倍,互作12 h上調8.3倍,當植物遭受逆境脅迫時,MAPK級聯(lián)激活調控植物激素信號轉導與多種生物、非生物脅迫信號轉導途徑[34]。編碼細胞色素b5蛋白的基因Cytb5在互作2 h上調1.1倍,互作4 h上調1.0倍,互作8 h上調1.6倍,互作12 h上調2.3倍,細胞色素b5蛋白是存在于內質網(wǎng)上的血紅素蛋白,能夠參與植物細胞中的各種氧化還原反應,通過調節(jié)活性氧(ROS)的平衡,提高植物抗逆境脅迫能力[35]。
2.6.2糖類代謝 在糖類代謝方面,調控多糖β-葡聚糖合成的CSLH基因在4個處理組均上調表達,互作2 h上調1.3倍,互作4 h上調1.1倍,互作8 h上調1.8倍,互作12 h上調1.9倍;編碼葡萄糖-1-磷酸腺苷酸轉移酶的基因glgC互作2 h上調1.8倍,互作4 h上調3.1倍,互作8 h上調3.0倍,互作12 h上調3.1倍(圖7)。
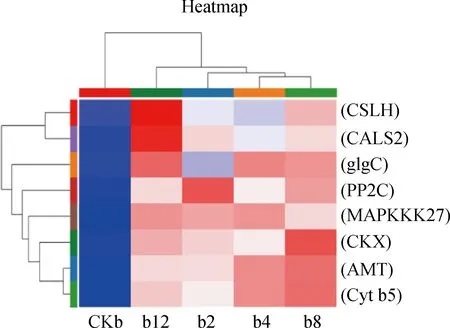
圖7 差異基因Pathway富集結果
2.6.3氮素代謝、生長發(fā)育 此外,氮素代謝、生長發(fā)育相關的基因顯著上調。植物氮同化代謝中起到重要作用的編碼銨轉運蛋白基因AMT在4個處理組中均上調表達,在互作2 h上調1.7倍,互作4 h上調2.2倍,互作8 h上調2.3倍,互作12 h上調1.6倍;位于細胞膜上的銨轉運蛋白,能夠促進植物對氮素的吸收,提高植物的產量[36]。合成胼胝質合成酶的編碼基因CALS2互作2 h上調6.4倍,互作4 h上調6.1倍,互作8 h上調6.4倍,互作12 h上調7.1倍;胼胝合成酶在花粉發(fā)育和植物營養(yǎng)物質運輸具有重要的作用。
綜上所述,芽孢桿菌DGL1誘導了燕麥體內PP2C,MAPKKK27,Cytb5基因的表達,這些蛋白質與植物應答生物、非生物脅迫的耐受反應相關,因此,推測這些蛋白的誘導表達可能會增加燕麥對環(huán)境應激的適應能力;基因CSLH,glgC與植物β-葡聚糖、淀粉的合成相關,推測這些多糖編碼基因的誘導表達可能會增加燕麥體內儲存的養(yǎng)分,為燕麥細胞正常生命活動提供能源;基因AMT與銨轉運蛋白的合成相關,因此,AMT的誘導表達可能增加燕麥對氮素的營養(yǎng)吸收,促進蛋白質的合成;胼胝質合成酶是存在植物細胞壁上的特殊成分,能夠調節(jié)胞間營養(yǎng)物質的輸送,DGL1誘導基因CALS2上調表達可能促進了燕麥細胞間的運輸能力,為生長發(fā)育輸送更多的營養(yǎng)物質。
3 討論
在生長發(fā)育過程中,植物根系與根際促生菌PGPR保持著共生關系,植物為微生物生存與繁殖提供營養(yǎng)物質,微生物也通過直接和間接作用促進植物生長,增加植物對生物和非生物脅迫的適應能力[37]。解淀粉芽孢桿菌DGL1能夠促進冷地早熟禾(Poacrymophila)、燕麥(Avenasativa)、紫羊茅(Festucarubra)等植物生長,并對多個植物病原真菌具有拮抗活性[38]。為了探究芽孢桿菌DGL1促燕麥生長的分子機制,利用轉錄組測序技術分析DGL1與燕麥互作后,燕麥葉片對菌株的應答反應。結果表明,互作后差異基因主要富集在影響燕麥細胞生長發(fā)育、代謝、光合作用、信號轉導、防御反應等相關途徑中。
據(jù)報道,芽孢桿菌可通過產生植物生長類激素供給宿主來促進植物生長,或者通過調節(jié)宿主植物的生長類激素相關基因的表達,調節(jié)植物生長發(fā)育,誘導植物產生耐逆性[39]。菌株DGL1與燕麥互作后,燕麥色氨酸代謝途徑中Aux/IAA編碼基因上調表達,Aux/IAA編碼的蛋白能夠與生長素響應因子ARF結合,調節(jié)植物生長素編碼基因的表達[40],促進燕麥的生長發(fā)育。在茉莉酸信號轉導途徑中,COI1基因在4個處理組均上調表達,COI1蛋白是茉莉素受體復合體核心成員,具有調控植物發(fā)育與誘導植物系統(tǒng)抗性的重要作用,該蛋白的缺失及突變將導致茉莉酸轉導途徑的受阻[41]。王文靜等發(fā)現(xiàn)甘藍型油菜COI1蛋白功能缺失將導致花絲、花藥發(fā)育受損,出現(xiàn)雄性不育系的表型[42]。菌株DGL1還能夠激活燕麥葉部細胞中類胡蘿卜素代謝通路,通過合成光和色素促進燕麥對光能的吸收、傳遞及轉化,促進燕麥的光合作用,提高生物量。
通過KEGG富集分析發(fā)現(xiàn),燕麥葉中編碼銨轉運蛋白的編碼基因AMT在4個處理組中均上調表達,可通過表達銨轉運蛋白提高燕麥對外界環(huán)境中銨態(tài)氮的吸收,增加對氮素的利用率;吳賢鑫等發(fā)現(xiàn)銨轉運蛋白通過促進氮同化和乙烯信號傳導來增加水稻對鞘枯病的抵抗力[43],因此推測基因AMT的上調表達,能夠促進燕麥對氮素的吸收利用,從而促進生長發(fā)育,并提高耐逆境脅迫能力。在次級代謝物的生成途徑中,植物根系能夠分泌經(jīng)苯丙烷代謝途徑產生的次級代謝物改變土壤微生物的菌群生態(tài),從而促進植物生長,提高植物抵抗不利環(huán)境的適應能力[44]。經(jīng)過菌株DGL1的處理,燕麥葉部的丙氨酸解氨酶編碼基因PAL在4個處理組均上調表達,丙氨酸解氨酶是參與木質素合成的關鍵酶,在防御病害、維持植物直立、輸送水分及營養(yǎng)物質具有重要的作用,在植物受到低溫脅迫時,丙氨酸解氨酶也能夠誘導黃酮類物質的產生以緩解氧化損傷,從而抵御低溫傷害[45]。在糖類代謝方面,調控多糖β-葡聚糖合成的CSLH基因、編碼葡萄糖-1-磷酸腺苷酸轉移酶的基因glgC均上調表達,趙凱琴等報道稱glgc基因轉入油菜基因組并成功表達,能夠促進油菜(Brassicanapus)種子中多糖淀粉的積累[46];崔雪瓊等報道重組glgc基因能夠增加馬鈴薯塊莖中淀粉的含量[47]。推測菌株DGL1通過誘導CSLH,glgc基因的表達,促進燕麥多糖的合成,積累能源物。
通過轉錄組測序發(fā)現(xiàn),差異表達基因顯著富集在光系統(tǒng)、對光刺激反應、葉綠素生物合成及葉綠體類囊體膜等與光合作用相關的途徑中,并發(fā)現(xiàn)在光合作用-天線蛋白通路中光系統(tǒng)Ⅰ中的光合蛋白編碼基因Lhca1,Lhca2,Lhca3,Lhca4,與光系統(tǒng)Ⅱ中的補光色素蛋白編碼基因Lhcb1,Lhca2,Lhcb3,Lhcb4,Lhcb5,Lhcb6均上調表達。因此,推測菌株DGL1能夠通過促進燕麥葉部的光合作用實現(xiàn)光能的轉換,并將無機物轉換為有機物,促進燕麥的生長,這與報道過的芽孢桿菌能夠促進植物光合作用的結論一致,史應武等發(fā)現(xiàn)接種芽孢桿菌菌劑S-7后,使得甜菜葉片氣孔導度、凈光合速率、蒸騰速率等指標顯著提高[48]。同時有報道稱,有益芽孢桿菌能夠減少葉綠體中活性氧的含量,增加抗氧化酶類含量,減輕植物在逆境脅迫中產生過多的活性氧造成對葉綠體的損傷,以此保護植物光合效率[49-50]。
4 結論
綜上所述,本研究通過RNA-Seq分析芽孢桿菌DGL1與燕麥不同互作時間燕麥葉部差異表達基因及相關代謝通路,探究了芽孢桿菌促進燕麥生長的分子機制,發(fā)現(xiàn)芽孢桿菌參與調控與燕麥生長、應答脅迫反應、參與光合作用相關蛋白的編碼基因,同時營養(yǎng)吸收的轉運蛋白的編碼基因在不同互作時間發(fā)生了差異表達,推測菌株DGL1對燕麥的促生機制是通過促進燕麥光合作用、激素代謝、次生代謝物合成、氨基酸代謝等多個途徑相互協(xié)調的結果,本研究為青藏高原極端生境根際促生菌促燕麥生長提供了理論基礎。

