納米銀在水產養殖中潛在生態毒性的研究進展
李 婧 ,朱小燕,何俊毅,孔慶玲,宋陽平,陳菲菲,錢夢雨,王士巖,劉 培,金詩語,李相前
(淮陰工學院生命科學與食品工程學院,江蘇省益生制劑重點建設實驗室,江蘇淮安 223003)
AgNPs是廣泛應用的納米材料之一,它能附著在細胞壁和細胞膜上,使其形態異常,通過物理作用,破壞其完整性,并與有氧代謝酶結合,使細胞死亡,因此具有廣譜抗菌性能,通常用于水處理和生物醫學領域,包括抗菌劑和抗炎劑[1-2]。此外,AgNPs進入水環境后,周圍會產生活性氧(ROS)并溶解出銀離子進一步增強毒性,這引起了水產養殖業的廣泛關注,在水產養殖業中可以用于水處理、池塘殺菌和水生疾病防治等方面,例如殺滅南美白對蝦體內的白斑綜合征病毒和弧菌屬細菌[3-6]。然而,有研究表明AgNPs在水生生態系統中會對魚類、微生物以及浮游動植物的生長產生抑制作用[7-8],同時通過各種途徑(如呼吸、進食等)在不同生物體內遷移,對長期暴露在其中的生物體有復雜且持久的毒性影響[9]。文章綜述了AgNPs在水環境中的毒性效應以及影響因素,對微生物、浮游動植物、魚、蝦、蟹等水生生物的毒性影響,并對未來的研究方向提出了對策。
1 AgNPs在水生環境中的毒性
1.1 AgNPs毒性的影響因素
在進入水環境后AgNPs毒性的影響因素主要由多方面構成,包括粒徑、pH、光照、氧化溶解、溫度、團聚、晶體狀態和產生活性氧自由基的能力等。
首先,細胞對AgNPs的攝取率與粒徑大小具有較大關系,Zhao[10]研究表明大型溞(Daphniamagna)對AgNPs的吸收速率展現出20nm>50nm>100nm的特點,15nm的AgNPs所造成的毒性明顯大于50nm和100nm。研究表明,小粒徑的AgNPs具有更大的比表面積和反應活性,具有更強的毒性[11-12]。
其次,AgNPs在水環境中的溶解度和團聚狀態會發生改變,包括氧化溶解、團聚、氧化還原(硫化和氯化)、吸附等。其中,氧化溶解是AgNPs轉化的主要途徑。AgNPs在水環境中的前6hrs毒性占59%,之后42hrs銀離子毒性占57%。由于銀離子濃度的增加伴隨著AgNPs濃度降低,在持續暴露時,銀離子毒性占主導地位[13]。Yin等[14]研究了相同濃度的AgNPs與硝酸銀溶液對植物體所產生的毒理學影響,結果表明除了AgNPs本身的毒性外,溶解出來的銀離子釋放所產生的生物毒性分顯著。AgNPs在不同環境下形態、溶解狀態、聚集狀態、抗氧化性均會改變,導致毒性差異。堿性物質會使部分銀離子轉化為AgNPs,因此pH同樣影響AgNPs的穩定性和銀離子濃度,當pH=6的時候,AgNPs的毒性相對較高;當pH=9的時候,毒性明顯下降[15]。氧氣濃度或溫度高時,AgNPs更易溶解,毒性增強[16-17]。此外,光照使AgNPs其氧化,表面形成氧化層增強銀的釋放,同時產生活性氧自由基,進一步增強毒性[18-21]。團聚會改變水環境中AgNPs和銀離子的濃度,從而導致暴露劑量和吸收速率的變化[22-24]。AgNPs的團聚效應受納米銀粒徑、形貌、類型及在水體吸附中的pH等影響,小粒徑AgNPs比表面積大,容易產生團聚效應,高pH會降低AgNPs表面上的ζ電勢,也容易產生團聚效應[25-26]。
1.2 AgNPs對生態毒性的影響
在水環境中,AgNPs會和環境因素或生物因素相互耦合,并間接產生一系列復雜的環境生態毒理效應。由于AgNPs結構性質不同,進入水環境后又會產生不同形式的遷移和代謝轉化,并且其衍生物、生物代謝物以及釋放出的銀離子同樣對生態系統產生毒理效應。銀離子在生物體中有很大的生物富集傾向,因為銀離子的化學性質使它們能夠通過類似于鈉離子通道的細胞膜離子轉運體吸收。Jiang等[27]研究發現,在水環境中,AgNPs主要沉積在表層底泥中,并在微生物和浮游動植物中大量積累,因此會通過食物鏈在不同營養級上傳遞。
2 AgNPs對水生生物的毒性效應
2.1 AgNPs對病原微生物的毒性效應
AgNPs具有廣譜抗菌性,可殺滅數百種病原微生物。其在與病原體的細胞壁、細胞膜結合后,可直接進入細胞,迅速與氧代謝酶結合,使酶失活,阻斷病原體的呼吸代謝,最終導致病原體窒息死亡[28]。即使低濃度的AgNPs也能抑制大多數病原微生物的生長[29]。表1列舉了AgNPs對多種微生物的毒性效應。 Gogoi等發現[30]小于20nm的AgNPs可與細胞膜發生反應,使細胞膜失去正常功能直至死亡。高于25mg/L的AgNPs可以完全抑制大腸桿菌(Escherichiacoli)和金黃色葡萄球菌(Staphylococcusaureus)的生長[31]。Yilma 等[32]發現沙眼衣原體(Chlamydiatrachomatis)感染的巨噬細胞中誘導出的10nm的AgNPs降低了腫瘤壞死因子和白細胞介素的水平。Manikandan等[33]研究發現20nm的AgNPs隨著濃度的增加,鏈球菌(Streptococcus),乳酸球菌(Enterococcusfaecalis),大腸桿菌,肺炎克雷伯菌(Klebsiellapneumoniae)以及一些耐藥菌株細胞活力下降。Akter等[34]發現6nm~24nm 的AgNPs對病原體表現出很強的抗菌活性。對大腸桿菌和銅綠假單胞菌(Paenarthrobacternicotinovoran)的最低抑菌/殺菌濃度分別為6.25mg/L/50mg/L和612.5mg/L/50mg/L。AgNPs對抗生素耐藥菌也具有殺菌效果,避免了細菌耐藥性的形成。此外,AgNPs粒徑小,可滲透入深層組織滅殺病原微生物,同時還具有加速傷口愈合、促進損傷細胞再生與修復、加速組織生長、減少疤痕形成等作用[35]。
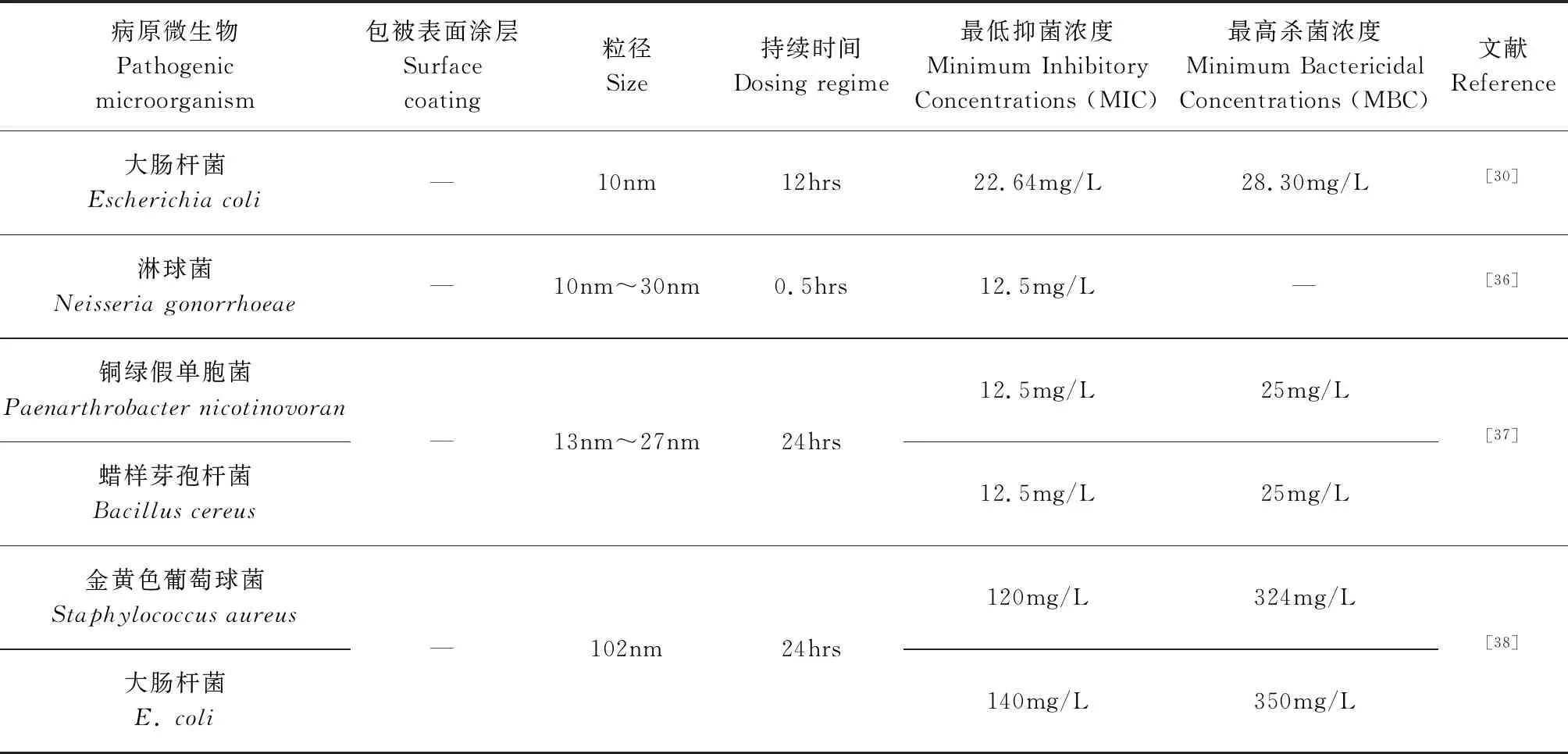
表1 AgNPs對病原微生物的毒性效應
2.2 AgNPs對浮游動植物的毒理效應
AgNPs對浮游植物光合作用產生了負面影響,這是因為AgNPs破壞了放氧復合體(OEC)和類囊體膜,促進了ROS的清除能力。Coll等[39]驗證了淡水中的各類生物在AgNPs加入早期階段,受到AgNPs的毒性影響較大,并運用概率物種敏感度分布法(pSSDs),得出不同物種對AgNPs敏感程度不同的結論。Huang等[40]發現藍藻暴露于1mg/L AgNPs下生長受到抑制。AgNPs對浮游動物的毒理學作用主要表現為對水生浮游動物器官的神經毒性[41]。Yan 等[42]發現AgNPs可以通過大型蚤母體(Daphniamagna),繁殖轉移到下一代,并會抑制F0代和F1代幼體的體外繁殖能力。An等[43]研究了70nm~92nm AgNPs在鹵蟲(Artemiasalina)中的急性暴露實驗,發現100mg/L AgNPs暴露72 hrs的蝦的死亡率為100%(表2)。
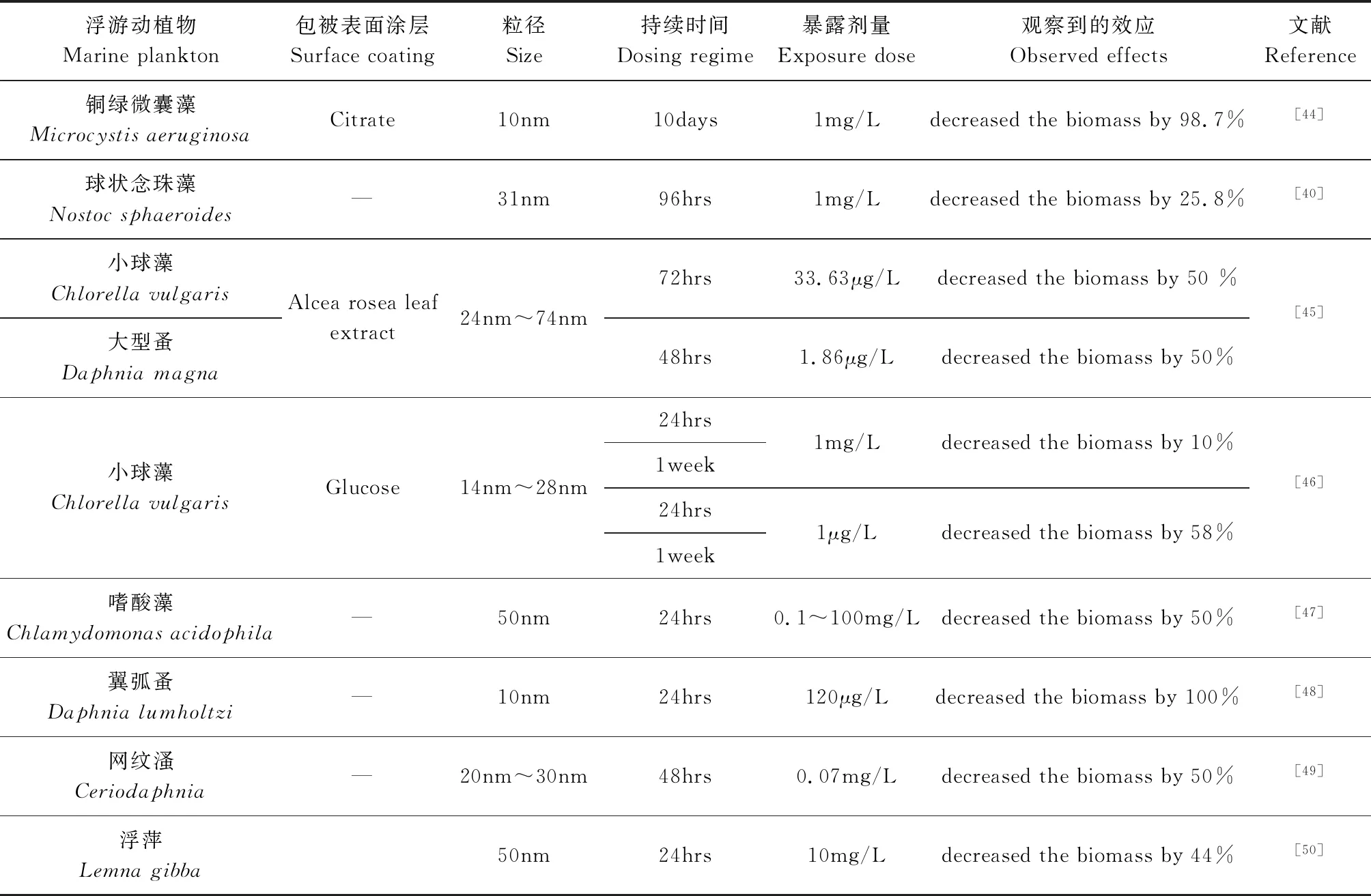
表2 AgNPs對浮游動植物的毒理效應
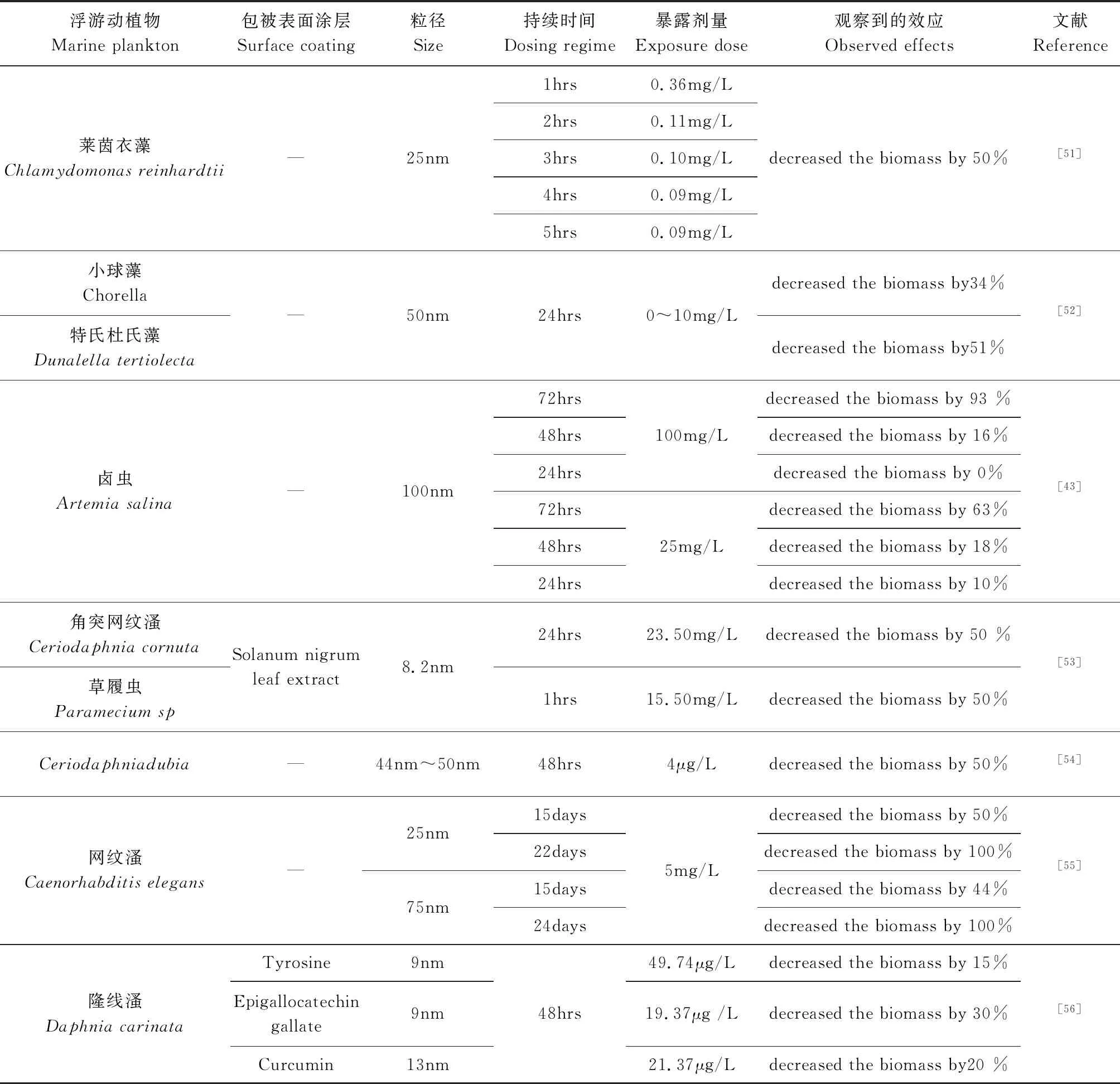
續表2
2.3 AgNPs對魚類的毒性效應
水生環境包含由生產者(微生物與浮游植物)和初級消費者(浮游動物)和次級消費者(魚類)組成的食物鏈。AgNPs作為抑菌劑,通過各種渠道釋放到水環境中,最終在魚類體內富集。鰓是呼吸和滲透調節的器官,其結構和功能特點使鰓容易受到AgNPs的破壞[57]。一些研究表明,AgNPs可以通過鰓的呼吸作用進入魚體內,破壞鰓內組織和鰓膜,導致呼吸應激,基因表達受損身體畸形以及其他問題[58-62]。Li等[63]發現AgNPs會導致鰓片層排列不規則、毛細血管擴張,并顯著調節魚鰓中96種差異表達的代謝物。Mohsenopur 等[64]研究發現AgNPs照射96hrs后,孔雀魚鰓部出現增生、肥厚、充血、出血、壞死等現象。AgNPs被動擴散到魚的胚胎中,影響胚胎發育,產生眼尾畸形、卵黃囊水腫、脊柱彎曲和心臟畸形等病變,此外還會破壞魚鰓神經結構,引起魚胚胎呼吸障礙和神經毒性疾病[65-67]。斑馬魚(Daniorerio)胚胎是一種常見的體內毒性分析模型,常用于觀察化學物質和納米顆粒對生物體的毒性。進入斑馬魚的AgNPs通常富集在斑馬魚的肝臟、鰓和頭部,這往往導致呼吸頻率增加以及過度鰓蓋運動和黏液分泌。Griffitt等[68]對斑馬魚胚胎進行了多項毒理學試驗,發現當暴露于平均粒徑約26.6nm的AgNPs時,受精后48hrs的斑馬魚胚胎的半致死濃度(LC50)為7.20mg/L。Bilberg等[69]研究證實斑馬魚胚胎暴露于PVP包裹的81nm AgNPs,受精后48hrs的LC50為84μg/L,毒性高于Griffitt等[68]的研究結果。Yen等[70]研究發現暴露于10nm的AgNPs,受精后96hrs斑馬魚胚胎的LC50為6.1mg/L。斑馬魚胚胎在受精后48hrs的LC50差異較大,可能主要是由于顆粒大小、表面涂層、被測生物種類的差異,以及暴露環境介質甚至環境條件的變化造成的。Cambier等[61]將斑馬魚胚胎暴露于AgNPs和硝酸銀溶液中,比較急性和慢性暴露實驗對胚胎的毒理學影響,發現AgNPs不能在細胞內積累并造成明顯的毒性,AgNPs對斑馬魚胚胎發育的主要毒理作用是由溶解的銀離子引起的。在魚暴露于不同粒徑的AgNPs后,AgNPs在不同的組織中積累[71],這種生物積累可能與氧化應激和組織學改變有關。不同的因素可以影響AgNPs對魚類的毒性,如尺寸、形狀、表面積、結構和釋放的銀離子等[72]。Bao等[73]研究發現AgNPs對斑馬魚腸道的毒性比對肝臟的毒性更大,雄性比雌性更容易受到AgNPs的影響。目前,AgNPs對魚類的毒理學效應研究主要集中在魚類急性暴露的研究上。隨著AgNPs濃度的增加和暴露時間的延長,AgNPs在不同組織中的積累增加。Chae等[74]發現,在硝酸銀和50nm AgNPs處理下,50nm AgNPs的LC50為25μg/L, 95%致死濃度(LC95)為50μg/L,高濃度AgNPs比硝酸銀的毒性更大。Ali等[75]將虹鱒(Oncorhynchusmykiss)暴露于35nm~70nm AgNPs中,3d的LC50為1.48mg/L,在0.04mg/L和0.06mg/L濃度下25d后觀察到鰓片表面壞死、變性、黏液物質分泌、細胞裂解和鰓片萎縮。非洲鲇魚(Silurusasotus)暴露于100μg/L的40nm AgNPs中15d后產生嚴重的肝損傷[76](見表3)。

表3 AgNPs對魚類的毒性效應
2.4 AgNPs對蝦蟹類的毒性效應
蝦蟹是底棲生物,易吸收污染物,常用于毒理學研究。AgNPs對蝦和蟹的毒性機制包括外膜完整性的不穩定、膜電位的破壞、細胞毒性、遺傳毒性、能量傳導的中斷和活性氧的形成[79]。在蟹和蝦中,重金屬污染物被隔離在肝胰臟、鰓和其他組織中[80],可以直接顯示其毒性和積累水平 ,Maribel 等[81]對凡納濱對蝦進行了AgNPs急性暴露實驗,發現肝胰臟中AgNPs的積累與AgNPs的添加量成正比,在角質層中也觀察到AgNPs的少量積累,而在肌肉中積累不顯著。克氏原螯蝦(ProcambarusClarkii)暴露于250mg/L AgNPs溶液,死亡率為43.3%,高死亡率可能是由于AgNPs對鰓上皮的直接毒性作用,使克氏原螯蝦出現缺氧、滲透調節壓力變化等情況,抑制生命活動和免疫系統導致死亡[82](見表4)。
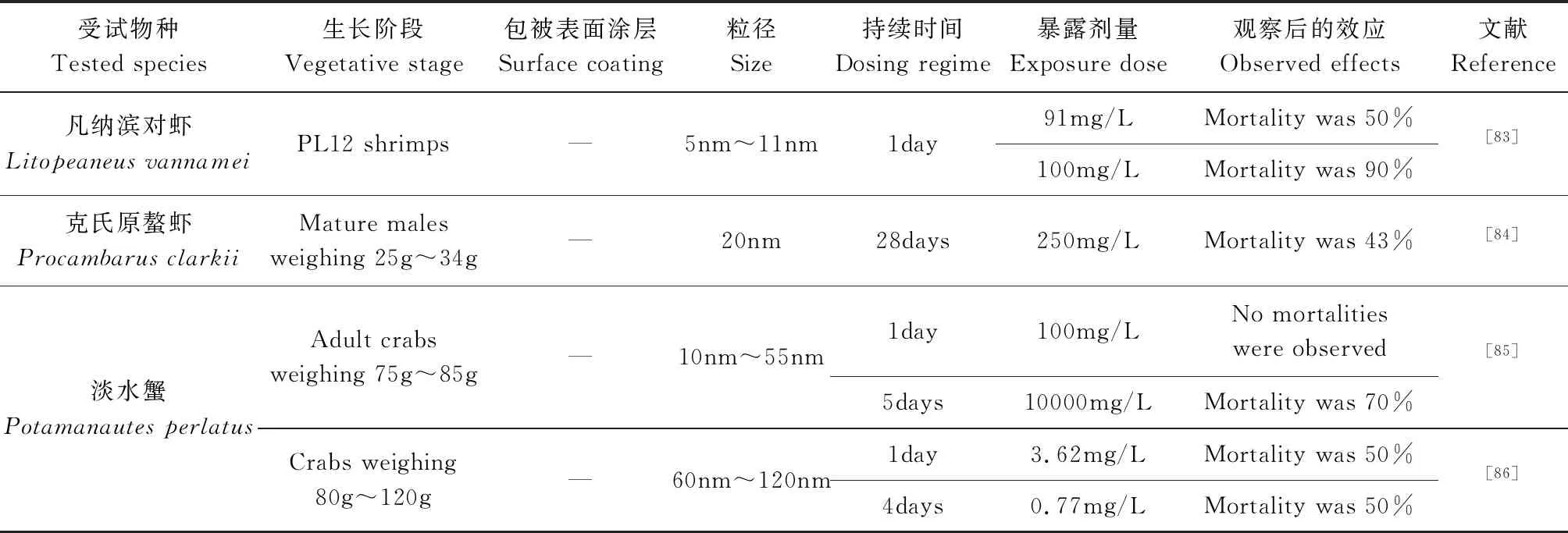
表4 AgNPs對蝦蟹類的毒性效應
3 展望
介于AgNPs擁有廣譜抗菌、強效滲入殺菌和不產生耐藥性的特點,同時還會結合其他物質增加毒性產生的作用時間和強度,現在被人們作為一種新型抗菌劑而廣泛研究,未來可應用于水體環境治理和水生生物飼養的優化方面,在生態修復和經濟生產等領域擁有良好的前景。但是,在抑菌作用同時,會在生物體內富集、遷移和代謝轉化,有可能會引發復雜的生態毒性。目前,人們對此領域還亟待研究,需要大量的AgNPs對水生生物毒性作用的數據信息,在匯總編排后,建立數學模型以此系統的充分利用AgNPs的抗菌作用。今后在開展AgNPs毒性效應的研究工作中,應更偏向于一些細致性的工作。在未來的研究中,可以考慮改進的3個方向,即可通過AgNPs的濃度的降低,提高水生生物的生存率;通過研究AgNPs對單個水生生物的影響了解對某個特定生物的毒理影響;最終建立完整的實驗模型,完善AgNPs在水環境中遷移轉化規律的研究。

