醇溶蛋白復合膠體顆粒在穩定Pickering 乳液制備中應用的研究進展
張 建,趙雪琴,張穩剛,劉利萍,張慧恩,*
(1.浙江省“生物工程”一流學科,浙江萬里學院生物與環境學院,浙江 寧波 315100;2.蘭州城市學院化學工程學院,甘肅 蘭州 730070)
乳液是兩種不相混溶的流體混合之后形成的分散體系,其中一種流體(分散相或內相)的液滴(一般在1~50 μm)分散在另一種流體(連續相或外相)中。這些液滴形成的界面區域在熱力學上不穩定,往往依賴乳化劑來提供動力學穩定性,防止液滴凝聚[1]。早在1904 年Ramden[2]發現可以使用固體顆粒作為Pickering 乳液的穩定劑,隨后各種固體顆粒被開發作為Pickering 乳液的穩定劑,如SiO2[3]、TiO2固體顆粒[4],還有一些多孔材料[5]和中空微球[6]等應用在穩定Pickering 乳液中。
在食品行業中,很多食品呈現的狀態是乳液形式,其中成分包含脂肪、淀粉、糖等,要使這些成分能夠均勻混合且能穩定共存,就需要使用穩定劑來使這些乳液的穩定性更好,表面活性劑或膠體顆粒的添加能夠起到一定的穩定乳液的作用。而乳液體系的特性對食品的質構、風味等具有重要影響,且對食品營養成分的傳遞和吸收都有一定影響。作為食品級的Pickering 乳液所使用的固體顆粒因其既具有表面活性劑的特性又具有食品特性,因此在很多領域被應用[7-9]。食品級膠體顆粒具有的優勢主要有:a.可以大大降低乳化劑的用量;b.對人體的毒害遠小于表面活性劑;c.食品級的膠體顆粒本身就可以作為食品被人體所利用和作為營養物質吸收。因此,固體顆粒穩定的乳液在食品、化妝品、醫藥等領域均有著重要的應用價值。
目前,一些食品級的膠體顆粒如纖維素納米晶體[10-13]、多糖類復合膠體顆粒[14-16]、蛋白膠體顆粒[17-19]、多糖-蛋白復合膠體等[20-22]也不斷被開發出來并應用在穩定Pickering 乳液中,另外還有一些具有生物活性的脂質體也是較好的Pickering 乳液穩定劑[23-25]。生物基膠體顆粒穩定Pickering 乳液在生物安全性和生物相容性方面具有很大優勢。同時這些生物材料制備的Pickering 乳液也是制備功能性材料很好的模板,如生物材料作為穩定劑制備的Pickering乳液通過脫除內相(油相)和連續相形成的框架結構成為很好的生物多孔材料,通過調控孔道大小,制備出具有一定吸油、吸水性能材料,常被用于原油泄漏后的吸附處理,因其具有很好的生物相容性和降解性,被認為是較好的綠色環保材料[26]。
醇溶蛋白是一種具有極強憎水性能的蛋白。因此,醇溶蛋白具有作為O/W 乳液穩定劑的潛力。許多研究者已經證明了使用醇溶蛋白制備的膠體顆粒穩定O/W 乳液具有良好效果[27]。同時,醇溶蛋白與水溶性高分子結合調節醇溶蛋白的親水性能,具有更加優良的穩定性能。目前,研究比較多的有玉米醇溶蛋白和小麥醇溶蛋白等,這些都是從谷類作物中提取出來的,高粱醇溶蛋白和藜麥蛋白也有相應的應用報道[28-29]。本文對近十年來不同醇溶蛋白基的復合膠體顆粒穩定Pickering 乳液應用研究進行總結,以期為醇溶蛋白基復合膠體顆粒穩定的Pickering 乳液在食品、工業催化、藥物包埋等領域的應用提供一定的參考價值。
1 醇溶蛋白膠體顆粒作為Pickering 乳液穩定劑的應用
1.1 玉米醇溶蛋白
玉米醇溶蛋白是玉米的主要蛋白組成,具有很強的疏水性,被認為是一種用途廣泛的食品生物聚合物。由于其特殊的三級結構,玉米醇溶蛋白可以通過液-液分散或溶劑蒸發的方式自組裝形成微納米顆粒。以玉米蛋白為基礎的給藥體系已經被研究用于疏水性藥物和營養物質的傳遞。近年來,以玉米醇溶蛋白為基礎的藥物傳遞體系越來越受到人們的關注[30]。
單一的玉米蛋白膠體顆粒具有很強的疏水性,不能有效地吸附在油水界面上,因此玉米醇溶蛋白主要與多糖、水溶性蛋白等進行復合形成復合型膠體顆粒。大多數以玉米醇溶蛋白為基礎的膠體粒子穩定Pickering 乳液,其油相分數主要限制在50%或以下。Pickering 乳液中的油滴在油相分數增加到70%時,油水融合在一起,這意味著這些乳狀液正接近倒置或相分離的閾值。Zhou 等[31]通過設計玉米醇溶蛋白與果膠的相互作用,成功構建了穩定的高內相Pickering 乳液 (HIPEs,high internal phase Pickering emulsions)。玉米醇溶蛋白/果膠復合膠體顆粒在油水界面上被不可逆吸收,形成有序、穩定的界面結構。這種情況有助于形成一個三維的油水網絡結構,具有良好的儲存穩定性和觸變性。這種HIPEs 能夠保護姜黃素免受紫外線誘導降解,使其具有理想的氧化穩定性。此外,其他二元膠體顆粒(如玉米醇溶蛋白/鞣酸顆粒)和三元膠體顆粒(玉米醇溶蛋白-丙二醇海藻酸酯-鼠李糖脂顆粒和玉米醇溶蛋白-丙二醇海藻酸酯-酪蛋白酸鈉復合物)被開發出來用于穩定HIPEs[32-34]。玉米醇溶蛋白因其疏水性強,尋找兩親性較好的大分子與其復合形成性能穩定、兩親性好的膠體顆粒是目前制備Pickering 乳液的關鍵所在,如反溶劑過程中玉米醇溶蛋白-單寧酸的相互作用,以及通過pH 循環調節形成三元絡合物膠體顆粒。目前,大量研究主要集中在對玉米醇溶蛋白復合膠體的物理性能以及在各種外部應力(如溫度、離子強度、pH)下流變特性和微觀結構的調控來達到穩定Pickering 乳液的目的。
1.2 小麥醇溶蛋白
小麥醇溶蛋白的特點是谷氨酰胺和脯氨酸含量高,而堿性氨基酸含量低。Hu 等[35]首次證明了小麥醇溶蛋白膠體顆粒(GCPs)可以作為HIPEs 開發的有效穩定劑。通過簡單的剪切法制備無表面活性劑的Pickering 乳液,將液體油物理轉化為固體狀粘彈性乳液凝膠,是一種很有前途的固體脂肪替代品。使用殼聚糖修飾GCPs 表面潤濕性,合成復合粒子構建抗氧化HIPEs 作為姜黃素的載體,制備了包埋姜黃素HIPEs,利用體外胃腸消化模型對HIPEs 的脂質氧化和姜黃素生物利用度進行了考察。結果表明,這種HIPEs 包埋方法提高了脂質氧化穩定性,使姜黃素的生物利用率從散裝油的2.13%提高到核內的53.61%,殼內的利用率甚至高達76.82%。此外,小麥醇溶蛋白還可以通過脫酰胺來提高小麥醇溶蛋白基Pickering 乳液的穩定性和包油率。不經過脫酰胺,內相含油能達到60%,而經過脫酰胺后,內相可以達到70%,同時穩定性大大提高[36]。在小麥醇溶蛋白膠體(GNP)里面添加增加酰胺化果膠也能提高Pickering 乳液的穩定性[37]。而小麥醇溶蛋白/海藻酸鈉復合的膠體顆粒包裹姜黃素,通過加入交聯劑谷氨酰胺轉移酶和Ca2+使形成的Pickering 乳液具有較高的包油率(91.8%),表面負載蛋白能力也能達到97.4%,大大提高了包油率和運載活性成分的能力[38]。將分離乳清蛋白(WPI)加入到小麥膠蛋白納米粒中制備成復合膠體顆粒,通過改變溫度、pH 和離子濃度,使乳液穩定,凝膠強度可控。當WPI 濃度為2%時,乳液凝膠的強度最強。凝膠強度也可以通過調節pH 和離子強度來調節。GNP 和WPI 穩定的Pickering乳液的流變性能很容易地通過溫度、pH 或離子強度來調節,從而使其在食品工業中具有廣泛的應用前景[39]。
1.3 高粱醇溶蛋白
高粱醇溶蛋白是從高粱種子中提取出來的醇溶蛋白,主要成分由α-高粱醇溶蛋白(分子量主要為23 和25 kDa),β-高粱醇溶蛋白(分子量分別為16、18 和20 kDa)和γ-高粱醇溶蛋白(分子量28 kDa),這些單元的比例分別為66%~80%、5%~8%和9%~12%。高粱醇溶蛋白和玉米醇溶蛋白具有很多類似的性質,包括溶解度、摩爾質量、氨基酸組成和多肽結構等。與玉米醇溶蛋白相比,高粱醇溶蛋白的疏水性和可消化性較差,通過使用反溶劑法制備納米膠體顆粒更加容易,用此方法制備的納米膠體顆粒用于包裹生物活性成分效果較好。同時,高粱醇溶蛋白的納米膠體顆粒具有強的抵御胃腸道惡劣環境的能力,增強了包裹活性成分在傳遞運載過程中的保護能力[40]。
從高粱中提取的高粱醇溶蛋白制成納米顆粒,作為穩定Pickering 乳液的膠體顆粒。通過反溶劑沉淀法制備的高粱醇溶蛋白納米顆粒對水包油型乳液具有很好的穩定性,抗聚結性好,通過反溶劑沉淀法制備的高粱醇溶蛋白納米顆粒表現出對水的潤濕性優于對油的潤濕性,內相(油相)在58.8%~78.6%表現出很好的穩定性[41]。且膠體顆粒在油水界面具有較好的穩定性。高粱醇溶蛋白納米膠體顆粒能夠滿足小分子表面活性劑的特性,在穩定油包水乳液中具有比較好的前景。高粱醇溶蛋白納米膠體顆粒用于穩定包裹含有姜黃素的植物油,所制備的Pickering乳液穩定性相比吐溫80 等效果要好,對胃腸道消化實驗進行了探討,結果表明,在胃腸道中Pickering 乳液穩定性好,能將姜黃活性成分運載遞送到腸道增加了其腸道吸收效率,具有一定的實際應用意義[42]。
1.4 花生分離蛋白
花生分離蛋白由10%水溶性蛋白和90%鹽溶性蛋白構成,其中鹽溶性蛋白又由花生球蛋白和花生伴球蛋白組成,這些組成決定了花生分離蛋白的物理、化學特性,使其具有兩親性特點,在應用中具有很好的乳化作用和氣泡性[43]。通過對花生蛋白的物理和化學改性,改變花生蛋白的兩親性特征,大大提高了花生分離蛋白膠體顆粒用于穩定Pickering 乳液的穩定性。Fang 等[44]使用富含硒的花生分離蛋白作為穩定Pickering 乳液的膠體顆粒,用于包裹含有5-羥基川陳皮素的玉米油,結果表明具有很好的穩定性,且其生物相容性、細胞攝取率和轉運率都得到大大提高。使用花生醇溶蛋白制備的Pickering 乳液是一個比較好的運載功能性營養成分的載體。而Hu等[45]則使用花生醇溶蛋白制備膠體顆粒,用于穩定Pickering 乳液過程中,使用了微流化方法和交聯劑轉谷氨酰胺酶,提高了蛋白膠體顆粒的交聯性,使得花生分離蛋白分子結構更加松散,從分子層面改變了分子存在的形式,從而提高了膠體顆粒穩定Pickering乳液的穩定性。
2 Pickering 乳液的研究發展趨勢和瓶頸
2.1 生物活性載體
自然界中具有很高生物活性成分的物質在保健和醫療領域被廣泛應用,比如:姜黃、榭皮素、蝦青素、β-胡蘿卜素等。然而這些活性成分也存在很多缺陷,如易在體外被氧化、易被胃強酸分解等,在進入人體過程中,容易出現經胃腸道給藥時,在尚未被吸收進入血循環之前,在胃、腸粘膜和肝臟中被代謝的“首過效應”,使其活性大大降低而不能被充分吸收利用。但通過植物蛋白膠體穩定的Pickering 乳液,形成W/O 型或O/W 型乳液,就能夠很好地包裹油溶性、水溶性活性成分遞送到人體具體部位釋放出來,起到靶向給藥的目的。尤其是對油溶性活性成分的載運,使用醇溶蛋白與多糖復合的膠體顆粒穩定Pickering 乳液作為載運載體。同時,對活性成分進行體外模擬胃腸道實驗,探討Pickering 乳液包裹的活性成分的釋放特性。目前,很多研究者使用醇溶蛋白膠體基顆粒穩定的Pickering 乳液用于運載活性成分,比如使用玉米醇溶蛋白/海藻酸鈣復合膠體[46]、玉米醇溶蛋白/寡聚糖復合膠體顆粒[47]以及玉米醇溶蛋白/小豆種皮多酚膠體顆粒[48]都可以較好地包裹活性成分蝦青素,且包裹后釋放效果、抗氧化性能等都得到大大提高。具有抗氧化、抗炎、降血壓、降血脂的活性成分榭皮素通過小麥醇溶蛋白/卵磷脂復合的膠體顆粒穩定Pickering 乳液包裹能夠大大提高其活性成分利用率[49]。還有研究通過玉米醇溶蛋白/殼聚糖復合膠體顆粒穩定包裹榭皮素,通過胃腸道體外模擬實驗發現能大大提高吸收效果[50]。圖1 是進行體外模擬示意圖。
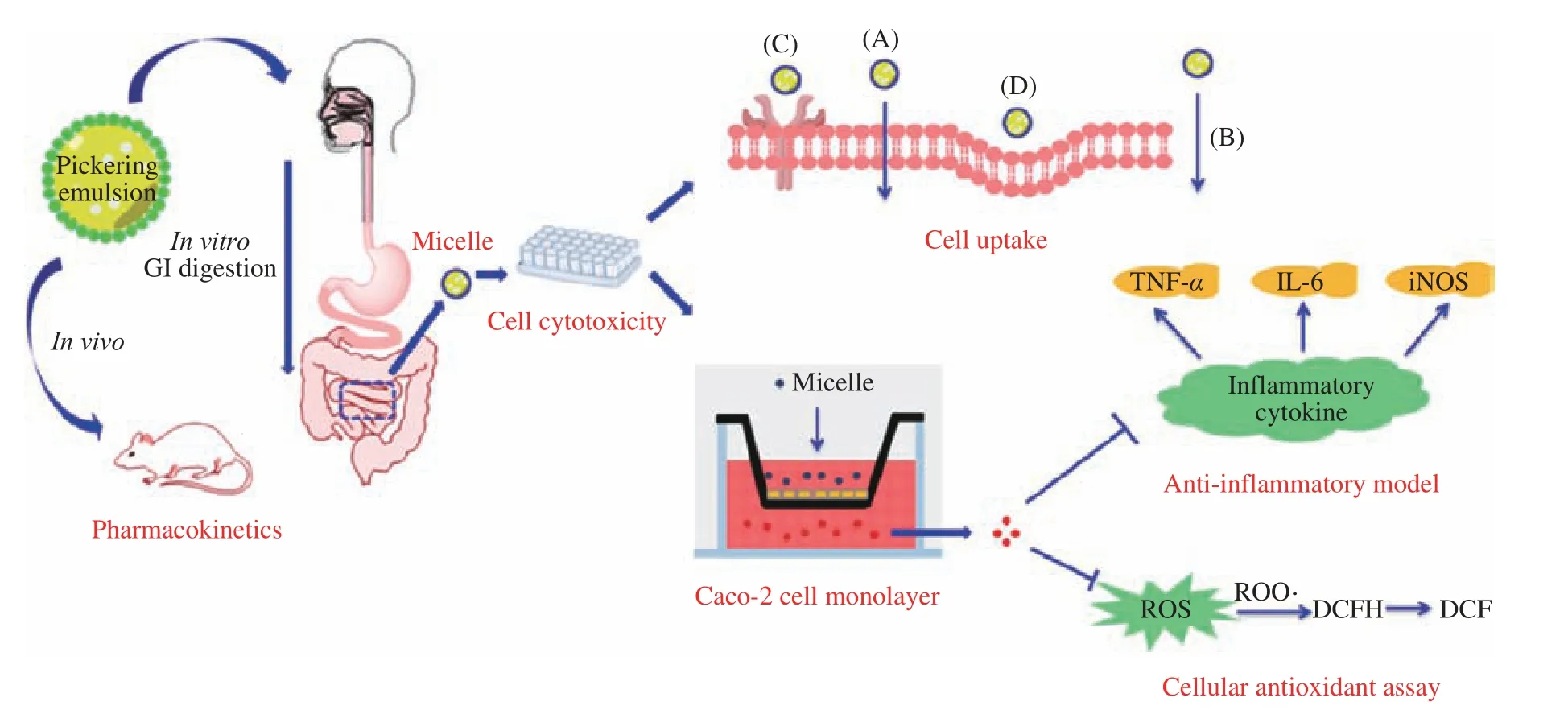
圖1 體外消化模型、體外細胞模型和體內動物實驗的示意圖[29]Fig.1 Schematic illustration of the in vitro digestion model, in vitro cell models and in vivo animal experiments[29]
2.2 多孔材料的制備
當Pickering 乳液的內相體積占比較大(>74%)時,作為高內相乳液因其內相比例遠高于外相,除了作為載體運輸內相功能性物質之外,還可以通過脫去內相,從而形成介于內相和外相之間的網絡多孔結構,這些結構則是穩定乳液的膠體顆粒所形成的。天然蛋白多孔材料具有可操作的多孔結構、高比表面積,可用于控釋,也可用于水/油的吸附和保留。多孔聚合物在微電子、生物醫學設備、膜處理和催化等應用中具有重要意義,同時也可用于合成多孔陶瓷或多孔碳的前體[51]。如使用花生分離蛋白形成的網絡結構[52],還有使用小麥蛋白/殼聚糖形成的復合膠體顆粒脫去內相后形成的網絡多孔結構(圖2),這些形成多孔結構在很多領域具有很好的應用,比如作為多孔吸附可生物降解材料,應用在日化或石油行業[26,53]。
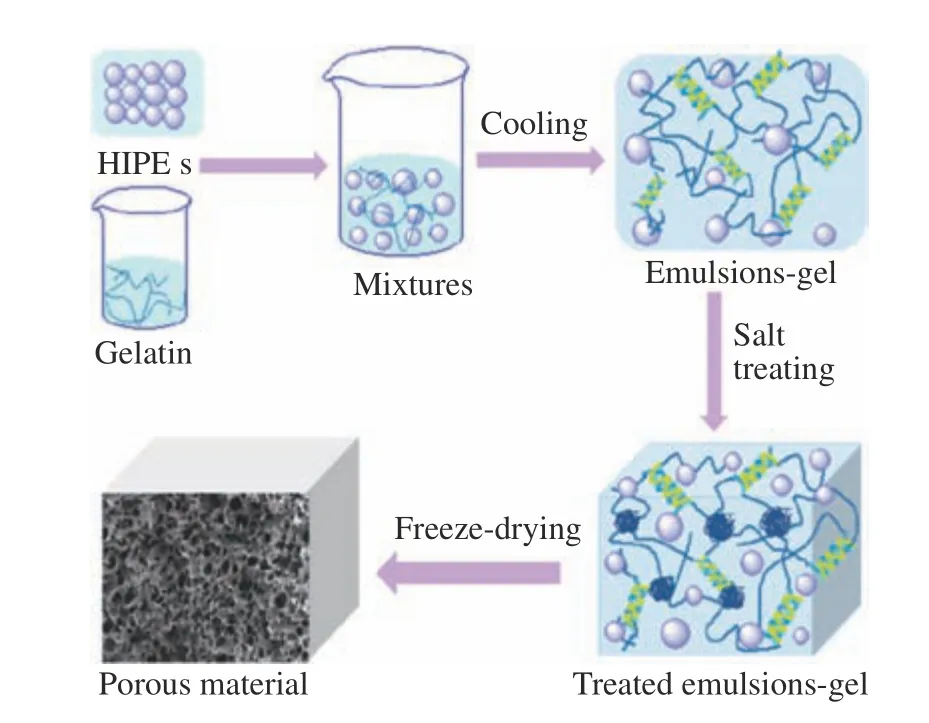
圖2 使用小麥醇溶蛋白/殼聚糖復合膠體穩定的Pickering 乳液作為模板形成的多孔蛋白材料制備示意圖[43]Fig.2 Schematic illustration for the preparation of a porous protein material using the Pickering-templating method, in which the HIPEs were stabilized by gliadin-chitosan hybrid particles (GCHPs) [53]
2.3 界面催化載體
作為醇溶蛋白復合膠體顆粒穩定Pickering 乳液,這些膠體主要處于油水界面,有研究人員利用界面作用,將催化劑控制在油水界面,然后將反應物置于內相,經過界面催化反應以后,通過相轉移,使產物和反應物進行分離,再通過外在刺激-響應性變化,從而達到反應物和產物完全分離的目的[54-55]。如圖3所示。
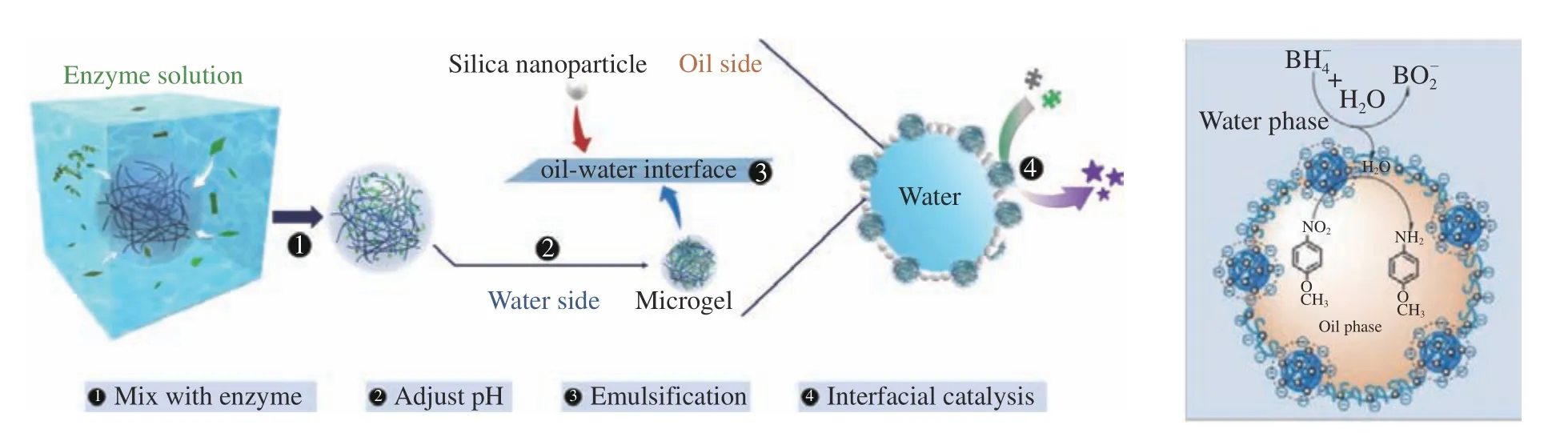
圖3 微凝膠包埋活性酶及其穩定界面催化反應的應用[55]Fig.3 Schematic illustration of enzyme encapsulation within microgels and application of interfacial catalysis via binary particlestabilized emulsion[55]
2.4 發展的瓶頸
隨著Pickering 乳液關注度的增加和在不同領域的應用,如何評價制備出的Pickering 乳液穩定性一直是研究者比較關心和難以達成一致觀點的地方。Pickering 乳液的穩定性由很多因素影響和決定,如與膠體顆粒的尺寸大小和形貌、膠體顆粒制備時分散的介質、膠體顆粒之間的相互作用、乳液的類型、連續相的流變性能、Pickering 乳液的油-水界面流變性能、乳化形式等都有關系。各個因素是相互聯系的,尤其是連續相的pH 變化對整個體系影響很大,pH 改變對連續相的流變性以及油-水界面的濕潤性和膠體顆粒吸附性能都有影響。因此,在考察Pickering 乳液穩定性時,需要綜合來考慮各個因素的相互影響。而醇溶蛋白大多數不溶于水或微溶于水,需要使用有機溶劑或者在強堿性環境才能溶解,因此,在制備醇溶蛋白膠體顆粒過程中,這些苛刻條件在工業應用上遇到很多阻礙。這也是目前很多研究只是處于探究階段而很難實行產業化的重要原因之一。醇溶蛋白與多糖、水溶蛋白等復合過程中,由于相互溶解性問題,容易出現混合不均一導致各自凝聚或復合不均勻。對大多數醇溶蛋白“天然”粒子不是單分散的,形狀也不均勻,因此在制備過程中不可能在液滴上均勻堆積,而目前分析膠體顆粒過程中,都認為是單分散或者接近單分散來討論和分析測試性能,這樣只能是接近于“理想化”,不能完全真實反映實際膠體顆粒的性能。至少目前沒有通過物理或數學物理模型來建立理論基礎。
3 結論
食品級醇溶蛋白膠體顆粒作為Pickering 乳液穩定劑的優點主要體現在不可逆的界面吸收、優異的抗聚結穩定性和獨特的流變特性等。此外,還因其生物相容性、降解性、成本問題和表面修飾的可行性,使其有望比無機納米顆粒材料具有更大的應用優勢。在乳液結構的修飾、活性物質的包埋和釋放以及靈活的界面調控等方面進行突破性的應用研究一直具有很好的研究前景。以醇溶蛋白膠體顆粒為基礎的Pickering 乳液不僅在理論研究上成為焦點,在乳液應用領域也將產生重大影響。醇溶蛋白膠體顆粒穩定Pickering 乳液目前比較有前景的研究方向包括:a.開發可調控的界面結構及其機理;b.闡明其在胃腸道等環境下的消化特性;c.擴大其在靶向給藥和穩定性增強的雙乳液等領域的應用。

