奶渣酪蛋白特性及營養價值分析
許涌捷,王冠華,伍昌軍,劉衛震,隋文杰*
(1.天津科技大學食品營養與安全國家重點實驗室,食品科學與工程學院,天津 300457;2.天津科技大學輕工科學與工程學院,天津 300457;3.湖北百特威生物科技有限公司,湖北 仙桃 433099)
牦牛乳又被稱為“天然濃縮乳”,含有多種營養物質,如蛋白質、維生素、鈣以及乳糖等,是高原地區各族人民重要的食品和乳品加工原料[1-2]。奶渣是牦牛乳提取酥油后留下的一種副產物,由提制酥油后的脫脂乳經加熱后凝固沉淀、過濾、曬干制得,呈淡黃色塊狀[3-4]。奶渣作為一種副產品,產量高并且價格低,營養價值豐富,富含蛋白質、乳糖、礦物質及多種維生素[5-6]。林亞秋等[7]測得牦牛奶渣的脂肪含量和蛋白質含量分別為1.69%與63.92%,并且含有16種水解氨基酸,必需氨基酸含量豐富,具有高蛋白、低脂肪的特點,可作為優質蛋白來源。鄭旭華等[8]利用堿溶酸沉的方法從奶渣中提取干酪素,并通過調節顆粒度、含脂率、水分含量等獲得高品質干酪素。李玉萍等[9]探究九龍牦牛奶渣的氨基酸含量和蛋白組成分析,測得九龍牦牛奶渣中總氨基酸含量約為36.5%,蛋白組分以酪蛋白為主,比例約為82%。李進波等[5]對牦牛奶渣理化成分及干酪素生產工藝進行研究,確定奶渣生產干酪素的最佳工藝參數。目前對奶渣的研究局限于奶渣基本組分的測定和生產干酪素的工藝研究,并沒有對奶渣酪蛋白的理化性質和功能特性進行系統分析評價,并且奶渣相關產品的開發也有限,大多為奶渣制備干酪素和蛋白肽,利用價值較低,本研究對奶渣中酪蛋白的理化特性和營養價值進行了系統分析,深入研究了奶渣酪蛋白的各項理化性質,對于提高奶渣的附加值和經濟效益具有重要意義。
本文以牦牛奶渣為原料,通過堿溶酸沉的方法分離奶渣酪蛋白,采用多種分析表征手段,對所提取酪蛋白純度、溶解度、乳化性、表面疏水性、交聯度、熱穩定性、分子量以及氨基酸含量和潛在活性多肽片段進行分析,并與市售酪蛋白進行對比,為實現奶渣的高值化利用及相關產品的開發提供理論支持。
1 材料與方法
1.1 材料與試劑
奶渣:四川甘孜藏族自治州理塘縣;市購酪蛋白1:新西蘭恒天然公司;市購酪蛋白2:湖北百特威生物科技有限公司;谷氨酰胺轉氨酶(30 000 U/g):山東元泰生物工程有限公司;十二烷基硫酸鈉(sodium lauryl sulfate,SDS)、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、鄰苯二甲醛、Tris-甘氨酸、電泳制膠液、蛋白Marker:北京索萊寶科技有限公司;氫氧化鈉(分析純)、鹽酸(分析純)、石油醚(分析純)、Tris-鹽酸緩沖溶液(分析純)、甲酸(色譜純)、乙腈(色譜純):國藥集團化學試劑有限公司。
1.2 儀器與設備
高速離心機(H1850):湖南湘儀有限公司;冷凍干燥機(Scientz-10N/A):寧波新芝生物科技股份有限公司;凱氏定氮儀(Kjeltec):福特(中國)有限公司;傅里葉紅外光譜儀(IS50):美國尼高利儀器公司;熱重分析儀(TGAQ50):美國 TA 儀器公司;電泳儀(DYY-8C):北京市六一儀器廠;熒光分光光度計(F-7000):日本日立公司。
1.3 奶渣酪蛋白提取及其理化性質測定
1.3.1 奶渣酪蛋白的提取
取1 g奶渣,加入100 mL蒸餾水,用1%氫氧化鈉溶液調節pH值為7.5,待完全溶解后,放入高速離心機10 000 r/min離心5 min,除去不溶性雜質和脂肪,取上清液置于燒杯中,然后用1%鹽酸溶液調節pH值為 4.6,離心(10 000 r/min、5 min、25 ℃),取沉淀,多次水洗后去除乳糖,于105℃干燥4 h,得到奶渣酪蛋白,經過一次脫脂、堿溶酸沉得到奶渣酪蛋白1,經過兩次脫脂、堿溶酸沉得到奶渣酪蛋白2。
1.3.2 基本組分的測定
蛋白質含量的測定參照GB 5009.5—2016《食品安全國家標準食品中蛋白質的測定》;脂肪含量的測定方法參照GB 5009.6—2016《食品安全國家標準食品中脂肪的測定》;水分含量的測定參照GB 5009.3—2016《食品安全國家標準食品中水分的測定》;灰分含量的測定參照GB 5009.4—2016《食品安全國家標準食品中灰分的測定》;乳糖含量的測定參照GB 5413.5—2010《食品安全國家標準嬰幼兒食品和乳品中乳糖、蔗糖的測定》。
1.3.3 溶解度測定
參考Chattaraj等[10]的方法測定蛋白質的溶解度。分別配制不同pH值的Tris-鹽酸緩沖溶液(0.1 mol/L,pH2.0~11.0),取 0.2g酪蛋白樣品溶于100 mL Tris-鹽緩沖溶液中,8000r/min離心15min,取上清液,參照GB 5009.5—2016《食品安全國家標準食品中蛋白質的測定》中的方法測定上清液中的蛋白質含量,計算不同pH值下酪蛋白的溶解度,其計算公式如下。

1.3.4 乳化性的測定
參考趙城彬等[11]的方法測定蛋白乳化性。取5 mL菜籽油與15 mL待測樣品溶液,均質1 min,取100 μL混合液,用質量分數為0.1%SDS溶液稀釋至10 mL,在500 nm波長下測定吸光度。將乳狀液靜置10 min后再以同樣的方法稀釋并測定,得到的吸光度A1與初始吸光度A0用來衡量乳化活力指數(emulsification activity index,EAI)與乳狀液穩定性(end system identifier,ESI)。EAI與ESI計算公式如下。

式中:EAI為每克蛋白質的乳化面積,m2/g;C為溶液中樣品蛋白的濃度,1 g/mL;L為比色杯直徑1 cm;A為500 nm處的吸光度;N為稀釋倍數;Φ為油相所占的分數;ESI為乳狀液穩定性,%;A0為初始吸光度;A1為10 min后的吸光度。
1.3.5 表面疏水性的測定
參考Zhang等[12]的方法測定表面疏水性。將待測樣品溶液溶解于0.01 mol/L磷酸鹽緩沖溶液中,8 000 r/min離心15 min,收集上清液并使得蛋白質濃度在0.02 mg/mL~0.14 mg/mL。取30 μL濃度為2.3 mg/mL的8-苯胺-1-萘磺酸溶液(采用0.01 mol/L pH7.0的磷酸鹽緩沖液配制)與3 mL待測蛋白質樣品溶液混勻,2 min后測定熒光強度。激發波長390 nm、發散波長470 nm、縫隙波長5 nm,并以熒光強度為縱坐標,蛋白質濃度為橫坐標作圖,曲線初始階段的斜率即為蛋白質的表面疏水性指數。
1.3.6 交聯度的測定
參考閆爽等[13]的方法并稍作修改。稱取2 g谷氨酰胺轉氨酶,溶于水中,定容至50 mL容量瓶中,在37℃下保溫30 min。取20 mL濃度為5 mg/mL的樣品溶液,添加3 mL谷氨酰胺轉氨酶溶液,在47℃的恒溫水浴中反應120 min。反應結束后,在85℃水浴鍋中滅活5 min,取出冷卻后,稀釋至0.5 mg/mL。吸取稀釋后濃度為0.5 mg/mL改性前后的樣品溶液2 mL分別和2 mL鄰苯二甲醛試劑振蕩混合后,精確靜止反應2 min后,在336 nm下測定吸光度,依據公式計算樣品中游離氨基的含量,鄰苯二甲醛試劑的配制參考閆爽等[13]的方法。游離氨基含量和交聯度的計算公式如下。

式中:Ai為樣品的吸光度;C為樣品的濃度,mg/mL;M1為樣品交聯前游離氨基含量,μg/mg;M2為樣品交聯后游離氨基含量,μg/mg。
1.3.7 熱穩定性測定
通過熱重分析測定奶渣酪蛋白的熱穩定性。稱取5 mg酪蛋白樣品置于坩堝中,設置溫度量程為20℃~600℃,升溫速率為10℃/min,以溫度(℃)為橫坐標,樣品的失重率(%)為縱坐標,記錄樣品在加熱過程中質量隨溫度的變化,從而得到熱重曲線,即TG曲線,并對失重率求一階導得到失重率的變化曲線,即微商熱重曲線。
1.3.8 蛋白凝膠電泳分析
采用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析奶渣酪蛋白的分子量。分離膠為12%、濃縮膠為4%,取50 μL蛋白分散液(10 mg/mL)加入50μL SDS-PAGE蛋白緩沖液,混合均勻,沸水浴5min,之后取15 μL處理后的樣品上樣后進行電泳。
1.3.9 傅里葉紅外光譜分析
參考薛海燕等[14]的方法稍作修改后測定蛋白二級結構。將干燥后的2 mg樣品與200 mg溴化鉀混合于瑪瑙研缽中,研磨均勻后壓成半透明薄片,用傅里葉變換紅外光譜儀(Fourier transform infrared spectrometer,FTIR)對樣品掃描,掃描范圍在 4 000 cm-1~400 cm-1,分辨率為4 cm-1,得到不同蛋白質的分子結構光譜圖,使用Omnic軟件進行數據分析。
1.4 奶渣酪蛋白營養價值分析
1.4.1 氨基酸組成分析
氨基酸組成的測定參考GB 5009.124—2016《食品安全國家標準食品中氨基酸的測定》。
1.4.2 一級序列分析
酪蛋白樣品經過酶解后,酶解產物經毛細管高效液相色譜分離,液相所用A液為0.1%甲酸水溶液,B液為0.1%甲酸乙腈水溶液。分離后用Q Exactive質譜儀進行質譜分析,分析時長為60 min,檢測方式為正離子,質譜測試原始文件用軟件MaxQuant 1.5.5.1檢索相應的數據庫,分析蛋白的一級序列片段。
1.4.3 活性多肽片段預測
借助 Biopep數據庫(https://biochemia.uwm.edu.pl/biopep-uwm/)提供的在線酶解功能與活性多肽數據庫,將質譜鑒定到的蛋白多肽片段進行在線模擬酶解,設置為胃蛋白酶和木瓜蛋白酶復合酶解的方式,最終得到蛋白的潛在活性多肽片段。
1.5 數據統計與分析
試驗均重復3次,試驗數據采用SPSS 22.0軟件的ANOVA(變異系數分析)和Tukey法進行方差分析和多重比較。
2 結果與分析
2.1 奶渣酪蛋白的理化性質與二級結構分析
2.1.1 基本組分分析
不同酪蛋白基本組分含量見表1。
由表1可知,奶渣中含量最高的為蛋白質,含量為64.09%,其次為脂肪,含量為9.36%,水分含量和乳糖含量分別為8.54%和6.30%。李進波等[5]研究香格里拉干奶渣濕基蛋白質和脂肪含量分別為59.35%與8.31%。奶渣酪蛋白1的蛋白質含量為91.41%,奶渣酪蛋白2的蛋白質含量為92.26%,奶渣酪蛋白1與奶渣酪蛋白2的蛋白質含量差異不顯著(P>0.05),與兩種市購酪蛋白的蛋白質含量差異不顯著(P>0.05)。奶渣酪蛋白中的脂肪、乳糖含量相較于奶渣明顯降低,且酪蛋白含量符合GB 31638—2016《食品安全國家標準酪蛋白》中的酪蛋白標準。
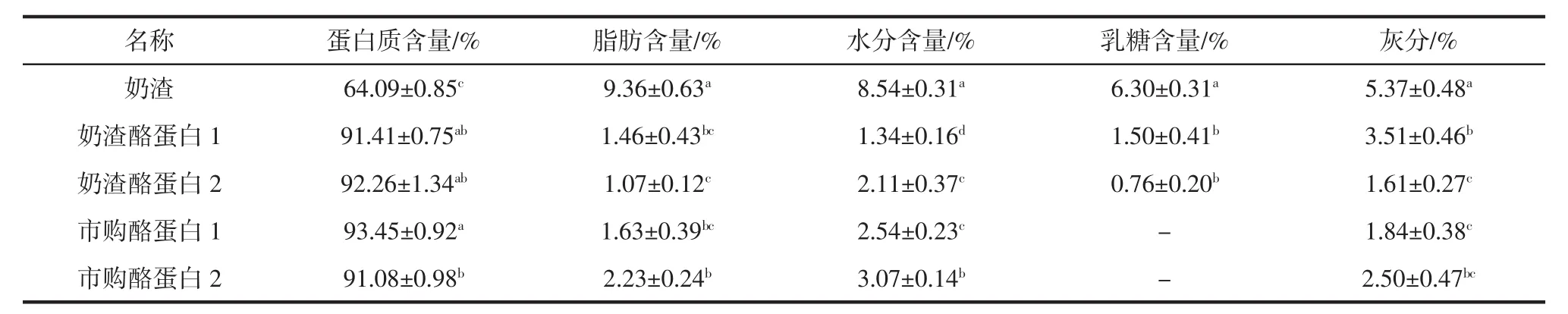
表1 不同酪蛋白基本組分含量Table 1 Basic component content of different casein
2.1.2 溶解度分析
蛋白質溶解度的大小與pH值有關,通常在等電點時溶解度是最低的[15]。不同pH值下奶渣酪蛋白的溶解度見圖1。
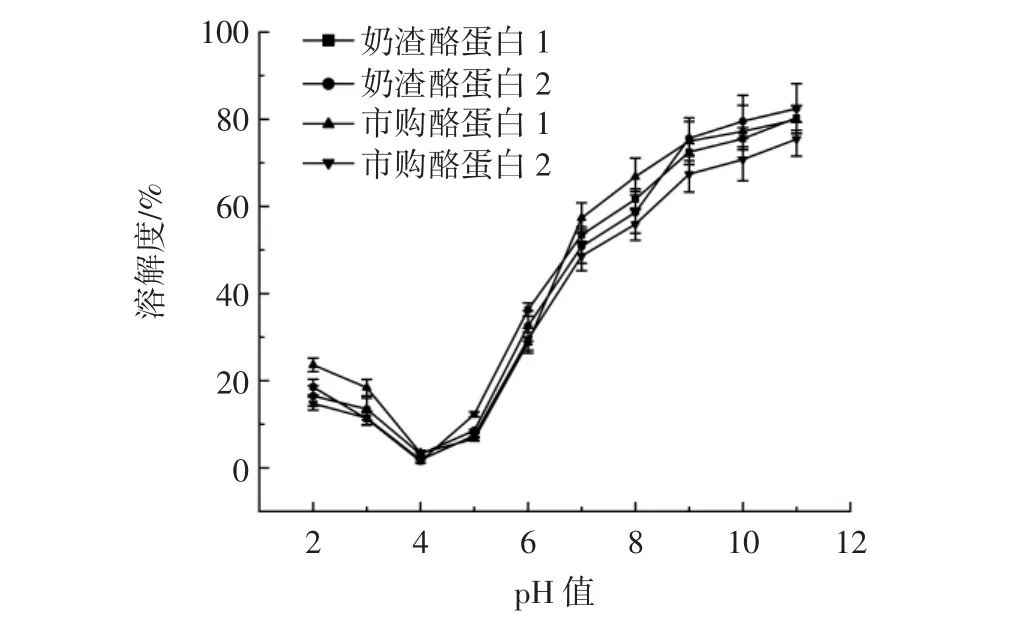
圖1 不同pH值下奶渣酪蛋白的溶解度Fig.1 The solubility of milk residue protein at different pH values
由圖1可知,在pH4時,4種酪蛋白的溶解度均最低,奶渣酪蛋白1溶解度為1.51%,奶渣酪蛋白2溶解度為3.16%,市購酪蛋白1溶解度為3.41%,市購酪蛋白2溶解度為1.82%,說明幾種酪蛋白的等電點在pH4附近,這與朱玉英等[16]對羊乳酪蛋白等電點的研究結果一致。隨著pH值的升高,4種酪蛋白的溶解度逐漸增大,并且在pH11時均達到最大,奶渣酪蛋白1溶解度為80.33%,奶渣酪蛋白2溶解度為82.44%,市購酪蛋白1溶解度為79.92%,市購酪蛋白2溶解度為75.44%,奶渣酪蛋白與市購酪蛋白表現出了同樣優異的溶解性能,在堿性條件下有很好的溶解性,良好的溶解性有利于發揮其功能特性,如形成凝膠和泡沫的能力[17]。
2.1.3 乳化性分析
蛋白質的乳化性質是蛋白質的一項重要的功能性質,是指能使油和水形成穩定乳化液的性質[18]。蛋白質的乳化性與其溶解性、表面疏水性等多種因素相關,不同加工方式的蛋白質的乳化能力可能因為蛋白分子量、表面基團分布、變性程度等的變化而變化[19-21]。不同種類酪蛋白的乳化性見圖2。
由圖2可知,兩種奶渣酪蛋白的乳化活力指數與市購酪蛋白1差異不顯著(P>0.05),并且奶渣酪蛋白1的乳化液穩定性較高(>70%),與市面上的兩種酪蛋白的乳化液穩定性差異不顯著(P>0.05),這說明奶渣經過堿溶酸沉等分離純化的處理后,制備的酪蛋白性能較好,具有優異的乳化能力,可作為成本較低的乳化劑應用于食品領域。
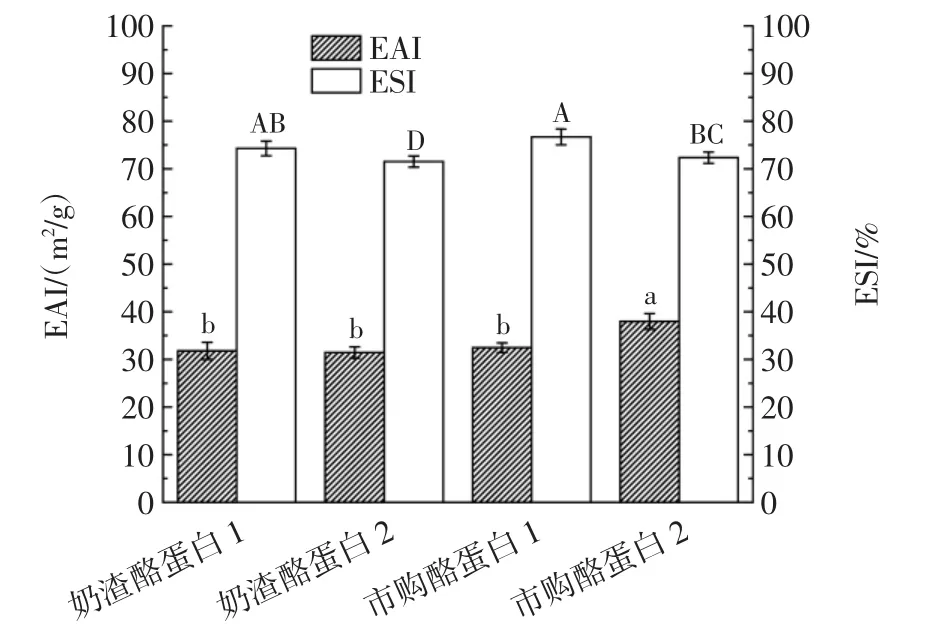
圖2 不同種類酪蛋白的乳化性Fig.2 Emulsification of different kinds of casein
2.1.4 表面疏水性
蛋白質在天然狀態下,其中的疏水氨基酸殘基大多數是處在分子內部,形成疏水內核,從而維持緊密的結構,當蛋白質受到某些外力作用時,包埋在分子內部的疏水基團會暴露在蛋白分子表面,因此蛋白質的疏水性會發生改變[22]。研究蛋白質的疏水性可應用熒光探針法,在一定范圍內,最大熒光強度與蛋白質的表面疏水性呈線性關系[23]。不同種類酪蛋白的表面疏水性見圖3。
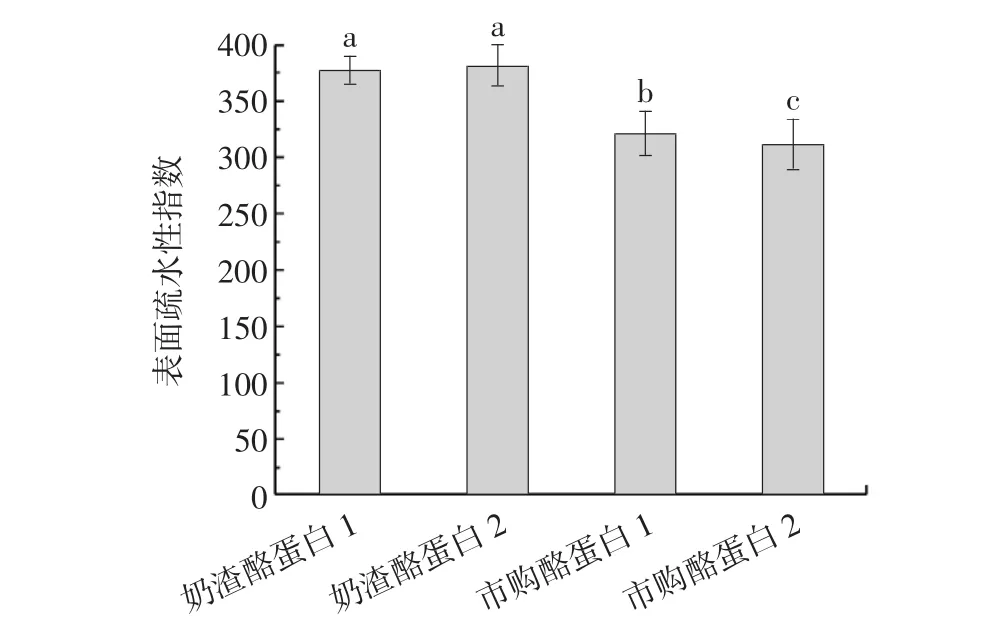
圖3 不同種類酪蛋白的表面疏水性Fig.3 Surface hydrophobicity of different kinds of casein
由圖3可知,兩種奶渣酪蛋白的表面疏水性要高于市購的兩種酪蛋白,可能是由于奶渣在制備過程中,由于經過加熱等工藝,蛋白質結構展開,包埋于酪蛋白膠束內部的疏水基部分轉移至表面,疏水性能增強[12]。蛋白質的二級結構發生變化,一些聚集在α-螺旋、β-折疊處的親水區域因結構的變化而減少,使蛋白質分子內部的疏水基團暴露,導致熒光強度增強[14]。
2.1.5 交聯度的測定
蛋白質交聯是常見蛋白改性技術之一,可改善其功能性質,從而發揮更廣泛的作用。谷氨酰胺轉氨酶(transglutaminase,TGase)可使蛋白質發生交聯,引起蛋白質分子聚集,形成更加致密的網狀結構,對外界有更強的抵抗能力,顯著改善蛋白質的穩定性[24]。不同酪蛋白的交聯度見圖4。
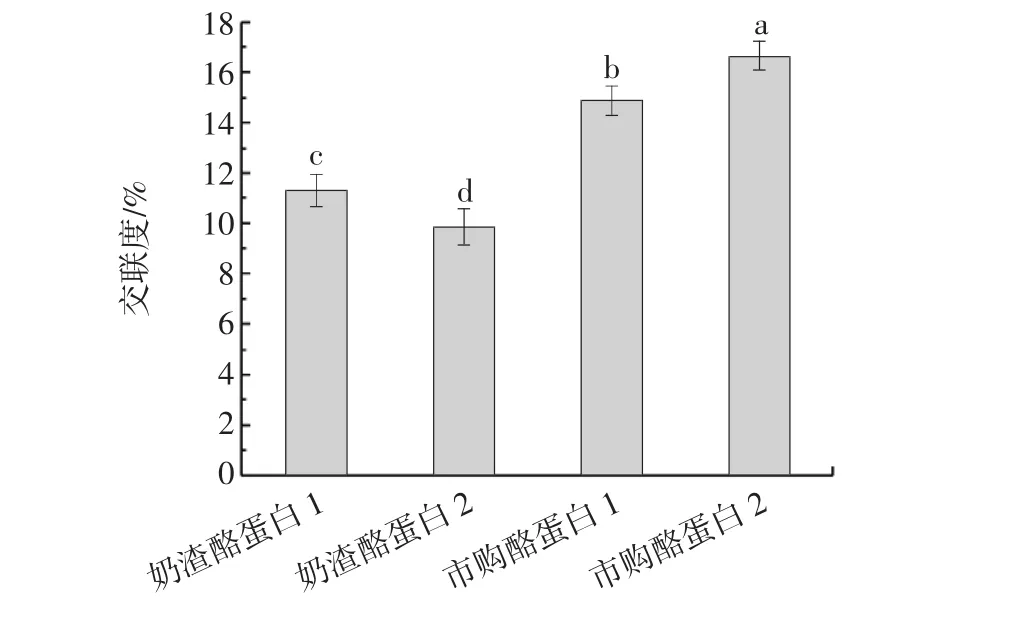
圖4 不同種類酪蛋白的交聯度Fig.4 The cross-linking degree of different kinds of casein
由圖4可知,市購的兩種酪蛋白交聯度較高,這是由于幾種蛋白結構不同,通過TGase催化交聯反應得到的修飾產物游離氨基也存在明顯差異,因此交聯度會有差異[13]。在交聯過程中,TGase催化的蛋白質側鏈的賴氨酸及谷氨酰胺殘基發生分子內及分子間交聯,引起酪蛋白結構改變,從而影響酪蛋白的凝膠性、乳化性、起泡性、黏度和持水能力等[25]。
2.1.6 熱穩定性的測定
酪蛋白的熱降解特征可通過熱重曲線進行測定,4種酪蛋白的熱重分析圖見圖5。
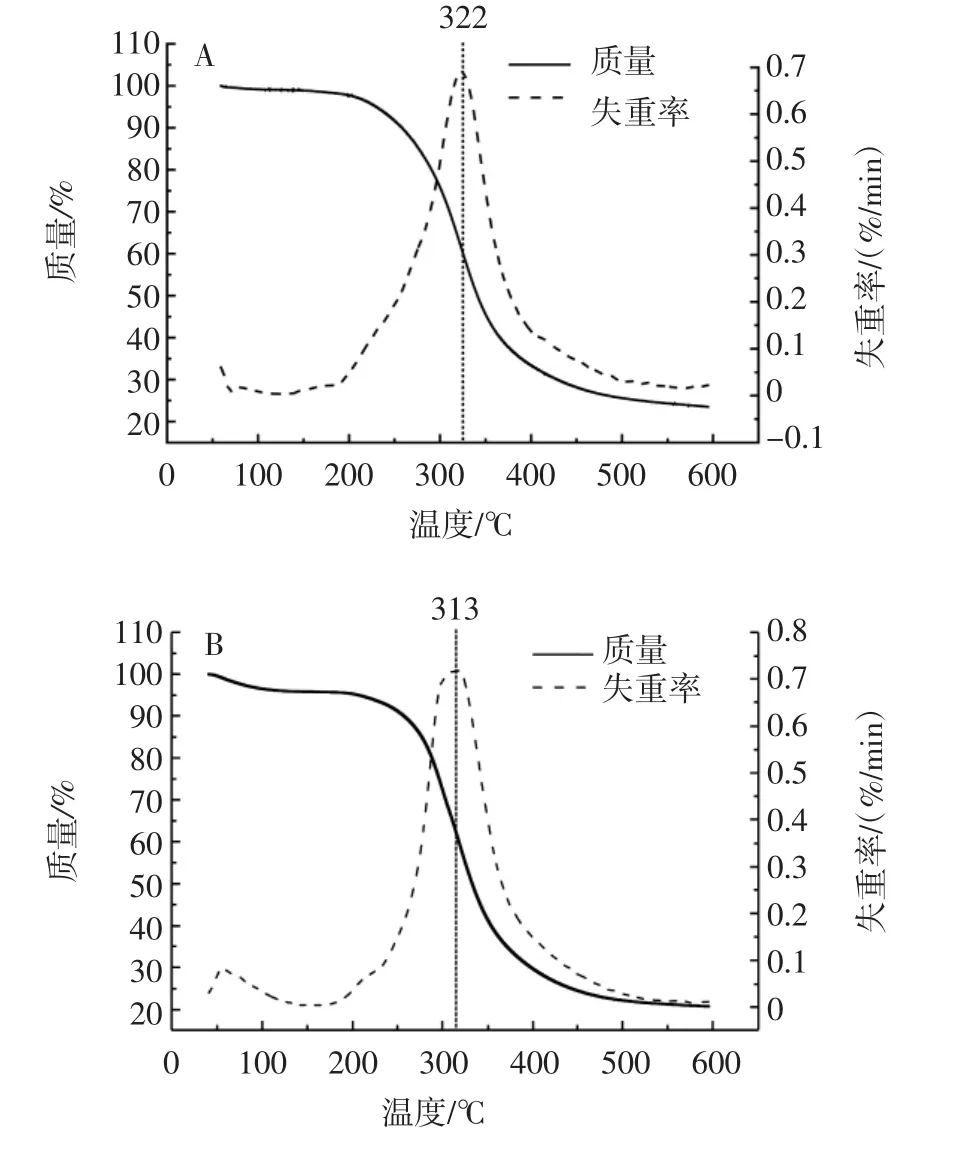
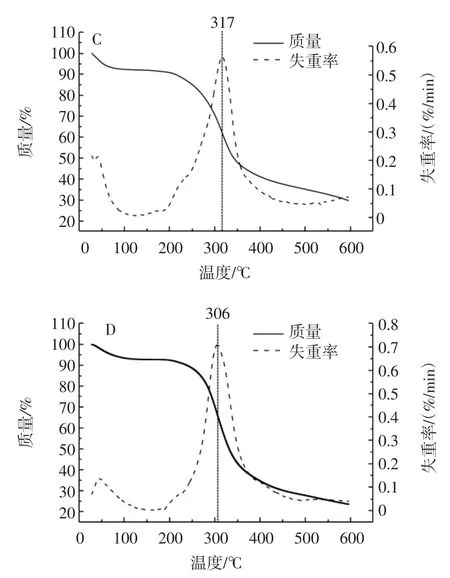
圖5 不同種類酪蛋白的熱重分析Fig.5 Thermogram of different kinds of casein
由圖5可知,4種酪蛋白的第一個失重峰位于50℃左右,在20℃~150℃出現一定程度的質量損失,這主要是樣品失水造成的,第二個熱降解階段位于200℃~500℃,質量損失在50%~70%,失重峰出現于310℃左右,此溫度區間的失重加快,說明在此過程中樣品含有的主要成分即蛋白質發生化學結構降解。兩種奶渣酪蛋白和兩種市購酪蛋白都具有較好的熱穩定性,在300℃下不易分解,在食品的加工過程中,對食品進行熱處理是非常重要的一步,因此溫度的控制十分必要。對奶渣酪蛋白和市購酪蛋白進行熱重分析,可以了解其熱穩定性,結果表明奶渣酪蛋白具有良好的熱穩定性,在300℃下不易分解,適合于工業熱加工處理。
2.1.7 亞基組成分析
根據其主要結構的不同,酪蛋白可以被分為3種不同的類型,即 α-酪蛋白(α-CN)、β-酪蛋白(β-CN)和k-酪蛋白(k-CN)[26-27]。不同種類酪蛋白的SDS-PAGE電泳圖譜見圖6。
由圖6可知,奶渣酪蛋白1、2與兩種市購酪蛋白分子量分布大致相同,依據標準蛋白Marker,α-CN和β-CN的分子量分別約為30、26 kDa,還有少量k-CN,分子量約為24 kDa,與朱玉英等[16]對羊乳酪蛋白分子量的研究保持一致。在63 kDa和180 kDa左右有不清晰條帶,這可能是由于蛋白不純或者測定過程中電壓不穩造成。
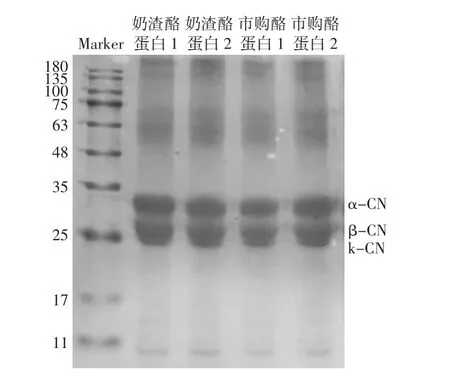
圖6 不同種類酪蛋白的SDS-PAGE電泳圖譜Fig.6 SDS-PAGE electrophoresis analysis of different kinds of casein
2.1.8 傅里葉紅外光譜分析
蛋白質二級結構是指由于主鏈原子間相互作用而在多肽內部形成的局部折疊結構,其與蛋白質功能特性密切相關[28]。幾種酪蛋白樣品的紅外光譜圖見圖7。
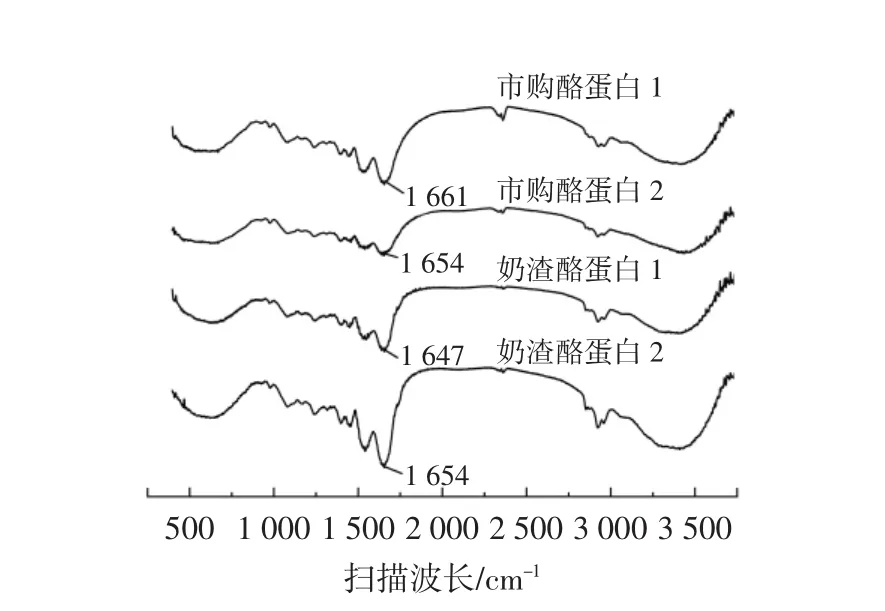
圖7 不同種類酪蛋白的紅外光譜Fig.7 Fourier transformation infrared spectroscopy spectra of different kinds of casein
酰胺Ⅰ帶的振動頻率取決于C=O和N-H之間的氫鍵性質,此波段的吸收峰主要表示蛋白質分子之間及分子內部形成的二級結構[29]。酰胺Ⅰ帶的波長范圍為1 700 cm-1~1 600 cm-1。由圖7可知,幾種蛋白質酰胺Ⅰ帶的特征吸收峰分別在 1661、1654、1647、1654 cm-1。
不同種類酪蛋白二級結構含量見表2。
由表2可知,奶渣酪蛋白的α-螺旋和β-折疊含量較高,無規則卷曲含量相對較低,表明奶渣酪蛋白分子能夠形成緊密的無空腔結構,二級結構穩定性較好,而與α-螺旋和β-折疊結構相比,無規則卷曲結構的構象穩定性和緊密程度則相對較差[30]。
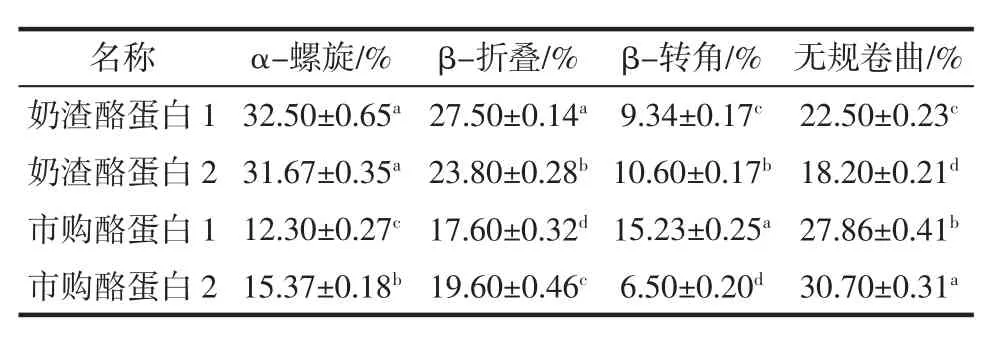
表2 不同種類酪蛋白二級結構含量Table 2 Secondary structure content of differrent kinds of casein
2.2 奶渣酪蛋白與市購酪蛋白營養價值分析
由兩種奶渣酪蛋白和市購酪蛋白理化性質的測定可知,經過兩次堿溶酸沉得到的奶渣酪蛋白2相較于奶渣酪蛋白1純度提升不明顯,且得率降低,乳化性和交聯度等理化性能差異不明顯,基于成本的考慮,在工業生產中,宜選用經過1次堿溶酸沉的奶渣酪蛋白,因此營養價值的分析對象不再包括奶渣酪蛋白2,選取經過一次堿溶酸沉的奶渣酪蛋白1與市購酪蛋白1進行深入研究,包括氨基酸組成分析與潛在活性多肽片段分析。
2.2.1 氨基酸組成分析
奶渣酪蛋白1與市購酪蛋白1的氨基酸組成和含量見表3。
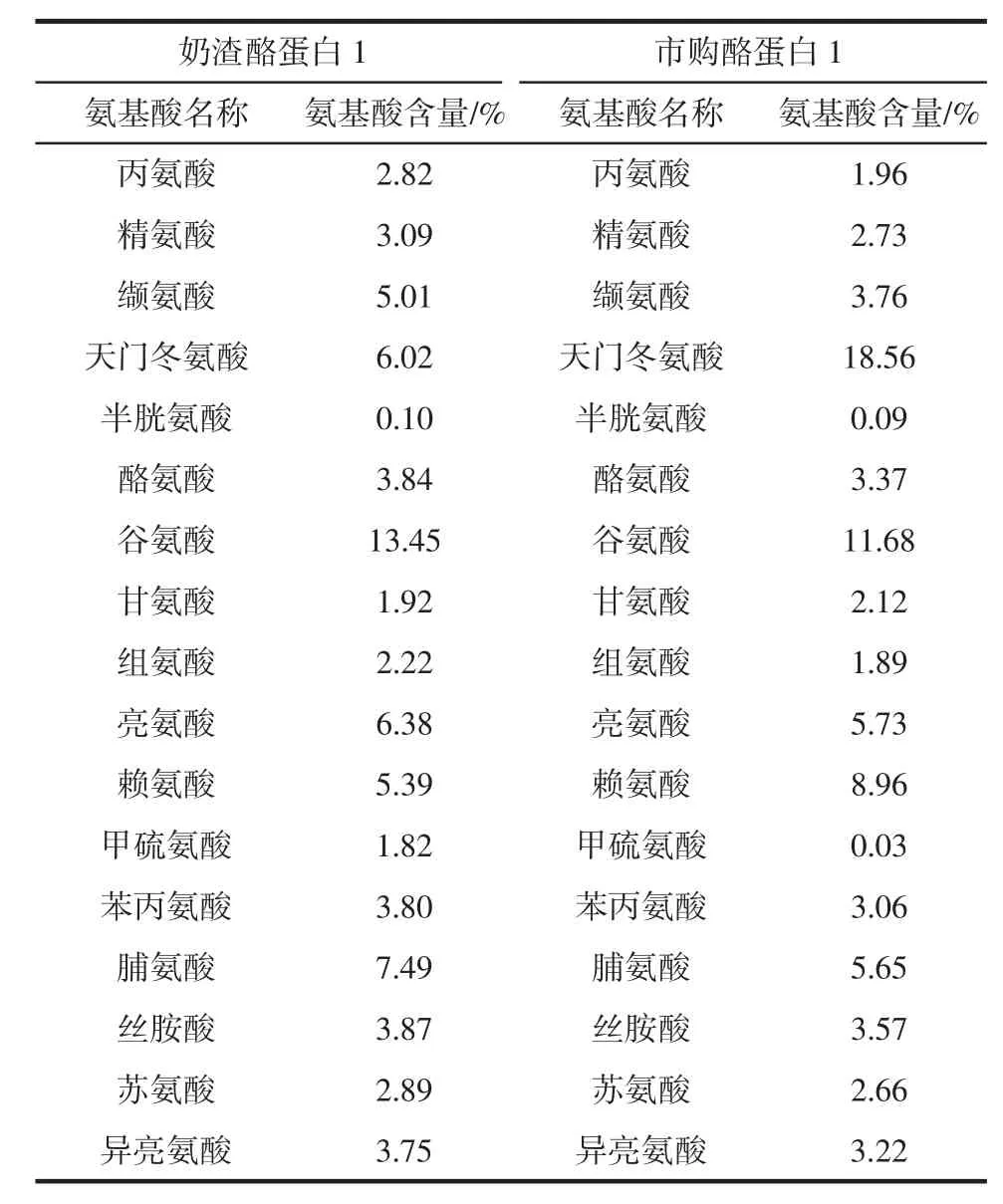
表3 氨基酸組成與含量Table 3 Amino acid composition and content
由表3可知,經過酸解處理后,奶渣酪蛋白1與市購酪蛋白1分別檢測出17種氨基酸,與乳蛋白質類似[31],奶渣酪蛋白1富含谷氨酸(13.45%)、脯氨酸(7.49%)、亮氨酸(6.38%)和賴氨酸(5.39%),半胱氨酸(0.10%)和甲硫氨酸(1.82%)含量較少,市購酪蛋白1富含天門冬氨酸(18.56%)、谷氨酸(11.68%)和賴氨酸(8.96%)。奶渣酪蛋白1含有必需氨基酸7種,包括亮氨酸、異亮氨酸、甲硫氨酸、苯丙氨酸、蘇氨酸、纈氨酸和賴氨酸,除賴氨酸外的其余6種必需氨基酸含量均高于市購酪蛋白1,其中異亮氨酸(3.75%)和纈氨酸(5.01%)均高于聯合國糧食組織和世界衛生組織提出的相對氨基酸評分模式下的兒童推薦值(分別為2.8%、3.5%),亮氨酸(6.38%)、賴氨酸(5.39%)、苯丙氨酸(3.8%)、蘇氨酸(2.89%)和甲硫氨酸(1.82%)含量稍低于相對氨基酸評分模式下的兒童推薦值(分別為6.6%、5.8%、6.3%、3.4%、2.8%)。奶渣酪蛋白中氨基酸種類豐富,含有多種必需氨基酸,并且有6種必需氨基酸含量高于市購酪蛋白,表明奶渣營養價值較高,可作為優質蛋白質的來源。
2.2.2 蛋白一級結構及在線酶解分析
本研究中將奶渣酪蛋白1和市購酪蛋白1用胰蛋白酶、胃蛋白酶和木瓜蛋白酶進行酶解,酶解產物經高效液相色譜分離后用質譜儀進行質譜分析,并與活性多肽數據庫進行對比,對潛在活性多肽片段進行初步預測,為評估奶渣酪蛋白生理功效提供數據依據[32]。
2.2.2.1 覆蓋序列分析
通過MaxQuant可視化分析,得到奶渣酪蛋白1和市購酪蛋白1的一級序列部分片段見表4。樣品用胰蛋白酶酶解,作用位點為賴氨酸和精氨酸,因此對應片段末端氨基酸為R或K[32]。
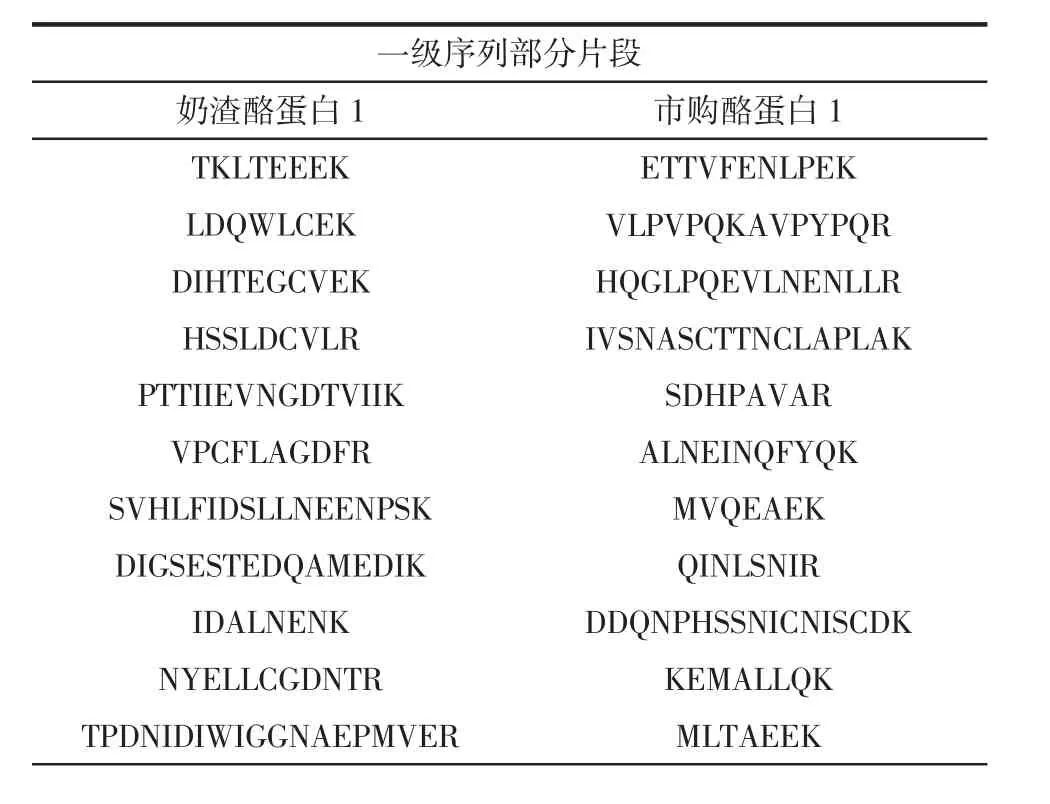
表4 奶渣酪蛋白1和市購酪蛋白1一級序列部分片段Table 4 Partial fragments of primary sequence of milk residue casein 1 and commercially available casein 1
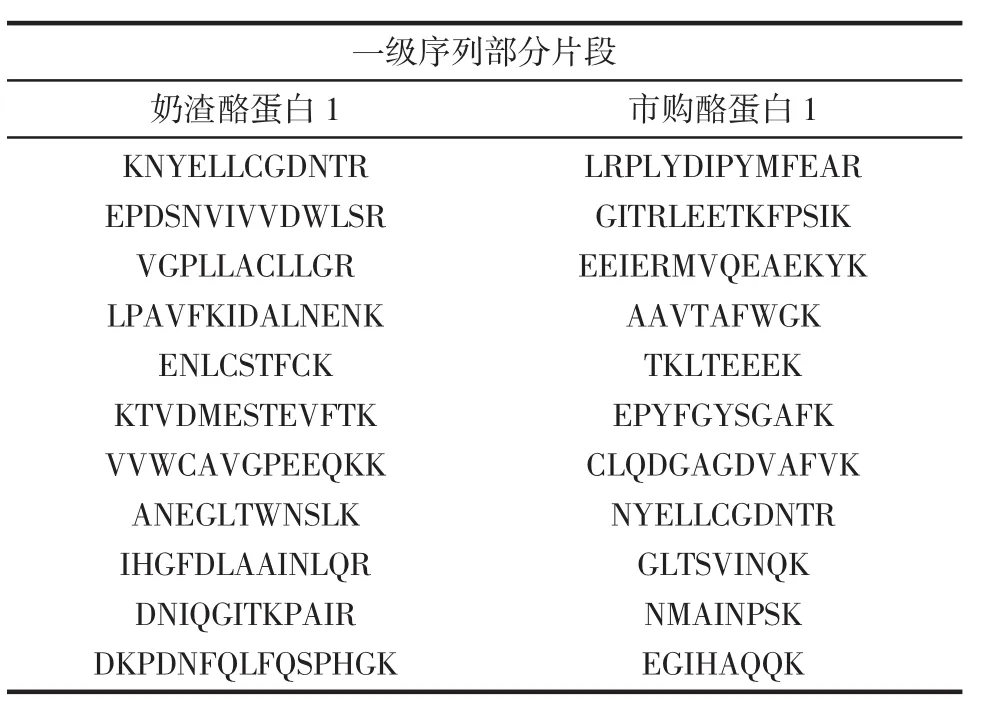
續表4 奶渣酪蛋白1和市購酪蛋白1一級序列部分片段Continue table 4 Partial fragments of primary sequence of milk residue casein 1 and commercially available casein 1
2.2.2.2 活性多肽片段分析
將表4中的片段進行在線模擬酶解,所用酶為胃蛋白酶和木瓜蛋白酶,酶解后與數據庫進行比對,得到奶渣酪蛋白1與市購酪蛋白1的潛在活性多肽片段。奶渣酪蛋白1酶解后潛在活性多肽片段見表5。

表5 奶渣酪蛋白1酶解后潛在活性多肽片段Table 5 Potential active polypeptide fragments of milk residue casein 1 after enzymatic hydrolysis
由表5可知,奶渣酪蛋白1共有129條潛在活性肽段,均為二肽或三肽,說明奶渣酪蛋白1酶解較徹底,產生的二肽和三肽更有利于吸收[32]。其中有48條多肽具有降壓功能,71條多肽具有降糖功能,部分多肽還具有抗血栓、促進代謝等功效。
市購酪蛋白1酶解后潛在活性多肽片段見表6。
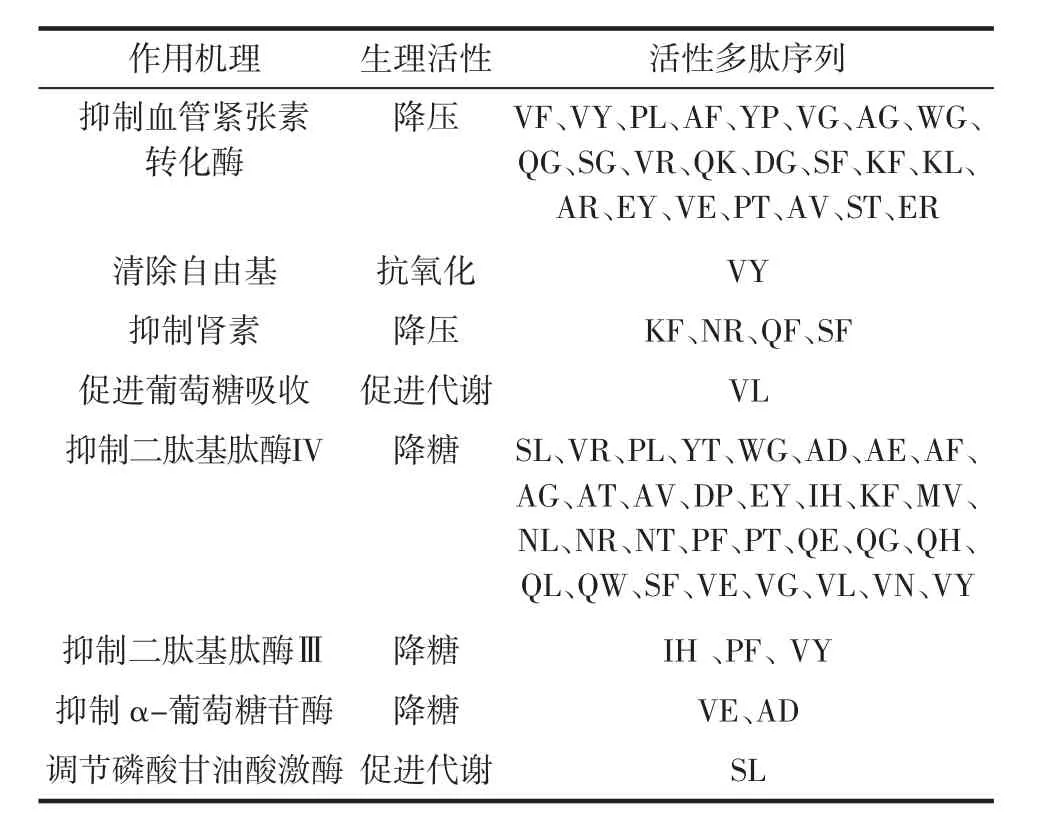
表6 市購酪蛋白1酶解后潛在活性多肽片段Table 6 Potential active polypeptide fragments of commercially available casein 1 after enzymatic hydrolysis
由表6可知,市購酪蛋白1的潛在活性多肽片段,其中27條多肽具有降壓功能,37條多肽具有降糖功能,相較于市購酪蛋白,奶渣酪蛋白酶解后的潛在活性多肽片段還具有修護胃黏膜、抗血栓、安神和抗炎等多種生理功效,生理活性更廣泛,營養價值更高。
3 結論
為實現奶渣的高值化利用,本文使用牦牛奶渣為原料,通過堿溶酸沉法獲得了高純度的奶渣酪蛋白。研究表明,奶渣酪蛋白在堿性條件下具有較好的溶解性,并且具有良好的乳化性和熱穩定性,較高的表面疏水性和堿溶性等理化特性。奶渣酪蛋白含有7種必需氨基酸且其中6種必需氨基酸含量高于市購酪蛋白,酶解后具有多種生理活性的潛在活性片段,可能在降壓、降糖等功能上具有一定生理活性,表明奶渣酪蛋白營養價值豐富。研究表明由成本較低的副產物奶渣提取的酪蛋白的各項理化性質與較昂貴的市購酪蛋白沒有明顯差異且營養價值較高,為實現其高值化利用以及開發相關產品提供了有力的理論支撐。

