幾種去蠟殼方法對提取紅蠟蚧基因組DNA的影響
路廣亮 羅卿權 孫雪婷 高磊 李躍忠
(上海市園林科學規劃研究院國家林業和草原局城市困難立地生態園林重點實驗室/上海城市困難立地綠化工程技術研究中心,上海 200232)
紅蠟蚧(Ceroplastes rubens Maskell)屬于蚧科(Coccidae)蠟蚧亞科(Ceroplastinae)蠟蚧屬(Ceroplastes Gray)昆蟲,一年發生一代,是園林、果樹、林木植物上的重要害蟲,紅蠟蚧以刺吸植物汁液進行為害,發生嚴重時極易引發煤污病,從而影響植株長勢、果樹產量和林木的觀賞功能[1],寄主達104種(1986年中華人民共和國住房和城鄉建設部《中國園林植物病蟲害和天敵資源普查及檢疫對象研究》課題結題材料記錄)。紅蠟蚧具有固定取食的特性,初孵若蟲固定后即開始分泌蠟質分泌物,然后蟲體逐漸被厚厚的蠟殼緊密包裹,且很難將蟲體和蠟殼進行分離。
紅蠟蚧的蠟殼很難剝離,這給紅蠟蚧的觀察和研究造成了一定影響,特別是在提取紅蠟蚧基因組DNA時,在研磨破碎蟲體過程中,大量蠟質黏附于研棒和容器壁上,很難剝離。筆者通過查閱有關文獻發現,有的研究者在制作蠟蚧玻片標本前,用氯仿或正己烷浸泡去除蠟殼[2-3],有的研究者采用白熾臺燈烘烤軟化后用解剖針輕輕撥去蠟質[4],有的研究者采用20%氫氧化鈉煮的方法去除蠟殼[5],有的研究者在顯微鏡下用解剖針和鑷子將蠟殼去除[6]。但在文獻查閱中,筆者尚未發現快速有效去除蠟蚧表面蠟殼的方法,也尚無蠟殼對提取蠟蚧基因組DNA影響的相關研究報告。在此背景下,筆者特進行了幾種去蠟殼方法對提取紅蠟蚧基因組DNA的影響試驗,以期探明不同去蠟殼方法對紅蠟蚧基因組DNA提取質量的影響,從而篩選出快速有效去除紅蠟蚧蟲體表面蠟殼的方法。現將相關試驗結果報道如下。
1 材料與方法
1.1 紅蠟蚧來源
紅蠟蚧于2021年11月9日采自上海市浦東新區金海路街頭綠化帶內的火棘,即剪取受紅蠟蚧為害的火棘枝條,帶回實驗室,室溫下保存,11月15日用鑷子將紅蠟蚧從火棘枝條上慢慢剝下,目測挑選外形完整、大小類似、蠟色正常的紅蠟蚧作試驗材料。
1.2 試驗設計
試驗依據去蠟殼方法不同,設處理:(1)去蠟殼方法1(開水法)。將供試紅蠟蚧放入有刻度的50mL離心管里,注入100 ℃沸水30 mL,在Vortex-Genie 2振蕩器(Scientific Industries,美國)上渦旋振蕩2 min,用無污染挑針將已溶解掉蠟殼的蟲體挑到1.5 mL離心管里。(2)去蠟殼方法2(吸水紙法)。在低倍解剖鏡下,將紅蠟蚧腹部向上,先用滅菌挑針刺破紅蠟蚧,擠出體液,用吸水紙吸收,再用挑針盡量刮取紅蠟蚧體內破碎的組織殘體,也用吸水紙吸取,將吸有紅蠟蚧體液和組織殘體的吸水紙放到1.5 mL離心管里。(3)去蠟殼方法3(石蠟油法)。將紅蠟蚧放入2 mL離心管里,加入石蠟油浸泡,50 ℃水浴30 min后,用滅菌挑針將紅蠟蚧蟲體轉移到1.5 mL離心管里。(4)去蠟殼方法4(正己烷法)。將紅蠟蚧放入2 mL離心管里,加入正己烷浸泡46 h,將浸泡過的紅蠟蚧倒在吸水紙上,在低倍解剖鏡下,用無菌挑針輕輕剝去蠟殼,將剝去蠟殼的蟲體轉移到1.5 mL離心管里。(5)去蠟殼方法5(冰凍法)。將紅蠟蚧連同枝條一起放在-20 ℃的冰箱里冰凍46 h,取出后立即用挑針剝去蠟殼,將剝去蠟殼的蟲體轉移到1.5 mL離心管里。(6)不去除蠟殼對照(CK),直接連同蠟殼將蟲體一起放入1.5 mL離心管里。每處理重復3次,每重復5頭紅蠟蚧。
1.3 紅蠟蚧基因組DNA的提取
將各處理離心管里的紅蠟蚧蟲體,分別用研棒盡可能研碎。使用DNeasy Blood Tissue Kit(Qiagen,德國)提取試劑盒,按照說明書提取紅蠟蚧基因組DNA,最后加入125 μL Buffer AE洗脫液二次洗脫DNA,室溫下靜置 1 min后,以8 000轉/min的轉速離心1 min收集DNA溶液。提取的DNA溶液于-20 ℃冰箱內保存備用。
1.4 基因組DNA質量檢測和擴增測序
1.4.1 紅蠟蚧基因組DNA的濃度與純度檢測
使用NanoDrop 2000超微量分光光度計,測定基因組DNA的濃度及紫外吸收峰值A260/A280值。每樣品溶液測3次,取平均值。
1.4.2 紅蠟蚧基因組DNA的PCR擴增檢驗及測序
取等量DNA樣品溶液作為模板,采用昆蟲線粒體COI基因通用引物對(由上海派森諾生物科技有限公司合成,上游引物L C O-1 4 9 0,5’-G G T C A A C A A A T C A T A A A G A T A T T G G-3’;下游引物H C O -2 1 9 8 ,5 ’-T A A A C T T C A G G G T G A C C A A A A A A T C A-3 ’),采用25 μL PCR 反應體系(其中,Mix為12.5 μL,引物LCO-1490為1 μL,引物HCO-2198為1 μL,模板 DNA 為 1.5 μL,ddH2O 為 9 μL,見表1),使用SimpliAmp Thermal Cycler PCR儀(Thermo Fisher Scientific,美國),擴增紅蠟蚧基因組DNA的COI基因片段。

表1 PCR反應體系
反應程序:94 ℃預變性4 min;94 ℃變性30 s,47 ℃退火45 s,72 ℃延伸45 s,32個循環;72℃終延伸20 min;PCR產物置于4 ℃保存待用。
以3 μL 的2 kb Ladder(DL2000 TM DNA Marker; Takara) 作為標準,將3 μL PCR 產物在1%瓊脂糖凝膠(電極緩沖液1×TAE)上進行電泳檢測,并切膠回收目標條帶,純化后送上海派森諾生物科技股份有限公司測序。
2 結果與分析
2.1 紅蠟蚧基因組DNA的濃度與純度
由圖1可知,6個處理的紅蠟蚧基因組DNA的濃度均能滿足后續一般分子生物學實驗的DNA濃度要求。除去蠟殼方法2(吸水紙法)處理外,其他處理都能提取出較高濃度的DNA,且各處理間紅蠟蚧基因組DNA的濃度差異不大。去蠟殼方法2處理的紅蠟蚧基因組DNA濃度較低,其原因可能是吸水紙僅吸取了部分體液和混雜在體液中的蟲體破碎組織,損失了較多蟲體組織。在GraphPad Prism 9中,對各樣品溶液的D N A濃度進行O n e-w a y ANOVA(uncorrected Fisher’s LSD test)統計分析,結果表明,不去除蠟殼對照、去蠟殼方法1處理、去蠟殼方法3處理、去蠟殼方法5處理的紅蠟蚧基因組DNA濃度相當,處理間差異不顯著;去蠟殼方法4處理的紅蠟蚧基因組DNA濃度顯著高于不去除蠟殼對照;去蠟殼方法2處理的紅蠟蚧基因組DNA濃度顯著低于不去除蠟殼對照。
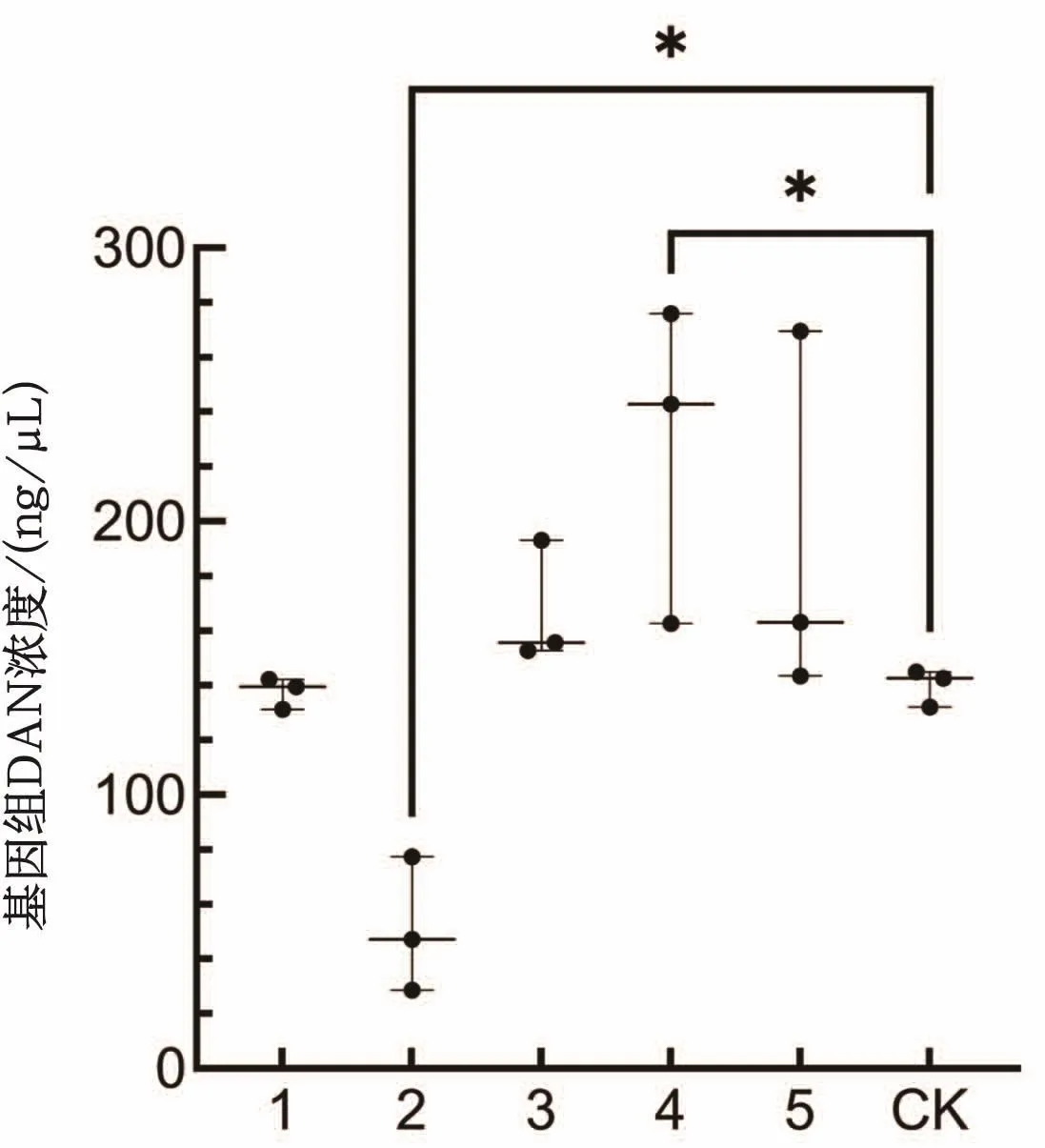
圖1 不同去蠟殼方法的紅蠟蚧基因組DNA濃度比較
A260/A280值常被用作核酸DNA純度的指示值[7-10],是DNA質量分析的指標之一。一般來講,DNA樣品溶液的A260/A280值介于1.8~2.0之間時,表示提取的DNA純度較好;DNA樣品溶液的A260/A280值低于1.8時,表示提取的DNA中存在蛋白質或者酚類物質。由圖2可知,6個處理的DNA樣品溶液的A260/A280值均超過1.8,且大部分介于1.8~2.0之間。以上結果表明,6個處理提取的紅蠟蚧基因組DNA純度均較好,均可滿足后續一般分子生物學實驗的DNA純度要求。
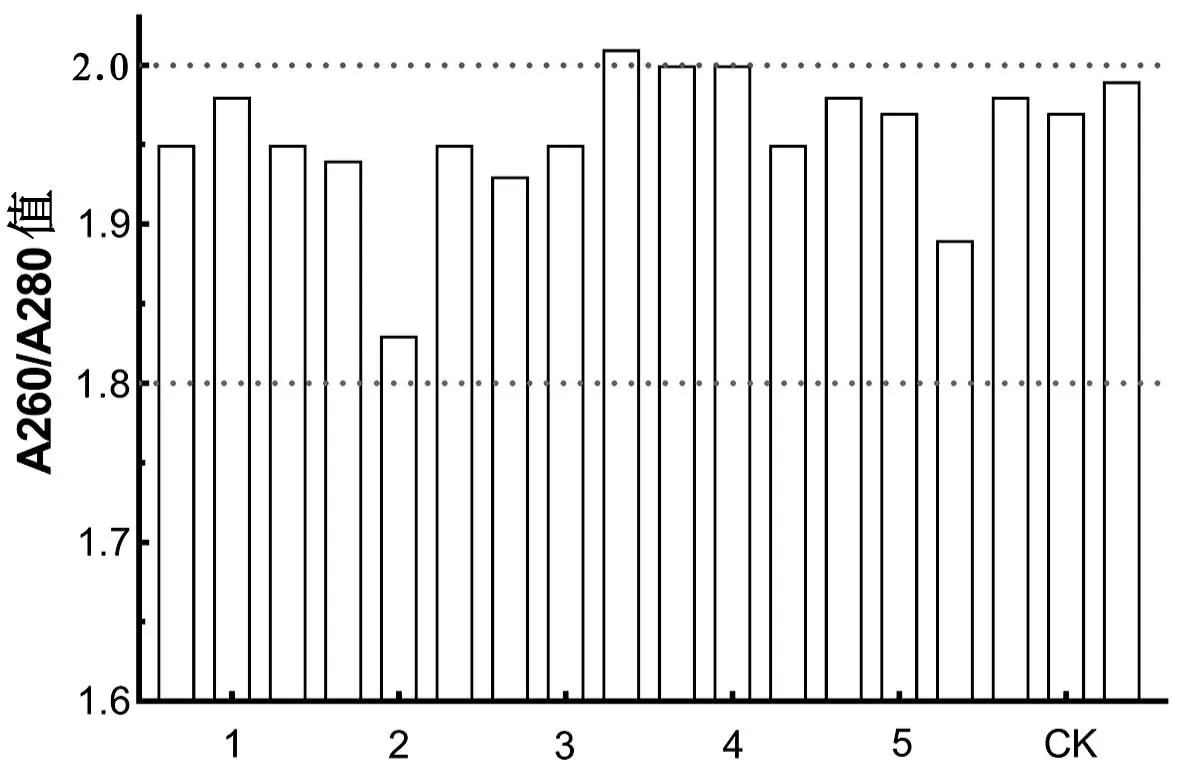
圖2 不同去蠟殼方法的DNA樣品溶液的A260/A280值
2.2 基因組DNA的PCR擴增檢驗及測序
由圖3可知,以各處理提取的紅蠟蚧基因組DNA為模板進行PCR擴增,均可獲得大小約為700 bp的擴增產物,與預期的COI片段大小相當,再將各處理測得的序列使用NCBI進行blast比對,各處理測得的序列都與紅蠟蚧COI序列一致。以上結果表明,各處理提取的紅蠟蚧基因組DNA的COI基因片段均得到成功擴增,提取的基因組DNA確實是紅蠟蚧的遺傳物質,不同去蠟殼方法或不去除蠟殼均不影響基因組DNA的提取,且均未對紅蠟蚧基因組DNA造成污染,提取的紅蠟蚧基因組DNA均能滿足后續一般分子生物學實驗的需求。
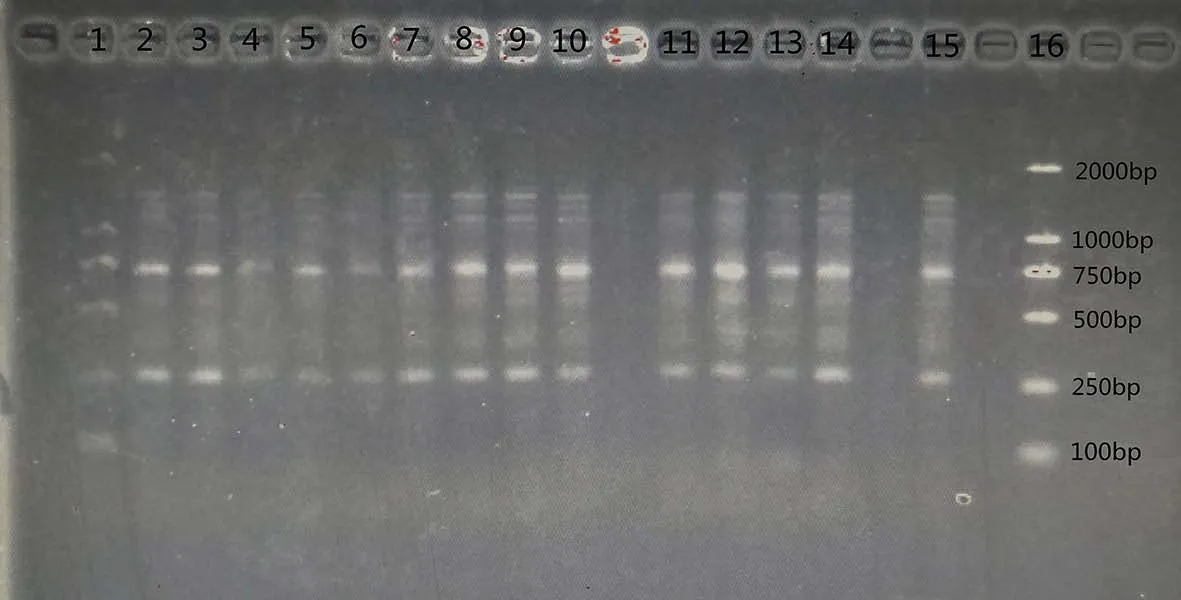
圖3 不同去蠟殼方法的紅蠟蚧基因組DNA的PCR擴增COI產物凝膠電泳圖
3 結論和討論
本試驗結果表明,可用帶蠟殼的蟲體作為試驗材料直接提取紅蠟蚧的基因組DNA,蠟殼的存在與否,對提取的紅蠟蚧基因組DNA的濃度與純度沒有影響;同時,通過基因組DNA的PCR擴增檢驗及測序,進一步證明了蠟殼對紅蠟蚧基因組DNA提取及下游PCR擴增沒有影響。
值得注意的是,筆者在試驗中發現,若是蟲體連帶蠟殼一起采用DNeasy Blood Tissue Kit 提取試劑盒提取基因組DNA,在第1次離心時,吸附柱中約有30%的液體會留存,需要進行2次離心才能全部離心到收集管中,但這并不影響最終的DNA提取質量。同時,本試驗僅采用了DNeasy Blood Tissue Kit 提取試劑盒提取紅蠟蚧基因組DNA,而基因組DNA的提取方法有很多,蠟殼的存在是否影響其他提取方法的DNA提取結果尚無試驗數據支持,這仍有待進一步驗證。此外,蠟蚧科蠟蚧屬蚧殼蟲約有147種[11],蠟蚧蟲體表面有蠟殼是其重要特征,且不同蠟蚧的蠟質分泌物在結構和化學成分上有所差異[12],本試驗證明紅蠟蚧的蠟殼對基因組DNA的提取質量沒有影響,而其他蠟蚧的蠟殼是否對基因組DNA的提取質量沒有影響目前仍不明確,故在相關屬種介殼蟲基因組DNA提取技術上或許有進一步優化的空間。
雖然本研究表明蠟殼的存在與否對紅蠟蚧基因組DNA的提取質量沒有影響,但是研究篩選出既快速便捷、又操作性強的蠟殼去除技術仍有其必要性,例如,可以提高離心效率,縮短紅蠟蚧基因組DNA提取時間,便于對紅蠟蚧蟲體外觀特征進行直接觀察,從而補充完善外觀描述的準確性等。然而,紅蠟蚧去除蠟殼是一項難度很高的操作,且本試驗選用的去蠟殼方法都存在一定的缺陷。例如,用開水法去蠟,蟲體很容易因水溫下降蠟質再次凝固,從而將蟲體黏附于試管壁上;采用吸水紙法去蠟,提取的DNA濃度較低,有較多損失,且不能獲得完整的蟲體;用石蠟油法去蠟需要水浴,且不能將蠟殼完全去除;用正己烷法去蠟,要正確掌握浸泡時長,一般以浸泡時長介于24~72 h較為合適(少于24 h,蠟殼沒有充分松軟;大于72 h,蠟殼太軟逐漸呈膠糊狀、黏度較大,蠟殼和蟲體不易分離,而且黏連挑針,去除蠟殼的難度大幅增加),浸泡后,蠟殼的紅色表面變為灰色,蠟殼松軟合適,解剖鏡下用挑針輕輕一挑,蠟殼即分成幾塊,便于將蠟殼從蟲體上輕輕挑離,露出金黃色、飽滿、完整的半球形蟲體,但是正己烷極易揮發,長時間操作會影響操作人員的健康;采用冰凍法去蠟,雖然可以較容易去除蠟殼(用挑針輕刺蠟殼,冰凍硬化的蠟殼即會破裂,便于用挑針將蠟殼從蟲體上小心挑離),但是在室溫下,蠟殼會很快解凍回軟而黏連,故采用該方法去除蠟殼需要操作迅速,或放在冰盒上進行操作。綜合考慮,去除紅蠟蚧蠟殼較為方便、快捷且剝離效果好的方法為正己烷法,且筆者發現,以純酒精取代正己烷去除蠟殼的效果更好。

