中粒種咖啡新發磚紅鐮刀葉枯病病原菌鑒定及其病原生物學分析
王 倩,吳偉懷,賀春萍,梁艷瓊,陸 英,易克賢
中粒種咖啡新發磚紅鐮刀葉枯病病原菌鑒定及其病原生物學分析
王 倩1,2,吳偉懷2*,賀春萍2,梁艷瓊2,陸 英2,易克賢2*
1. 海南大學植物保護學院/熱帶農林生物災害綠色防控教育部重點實驗室,海南海口 570228;2. 中國熱帶農業科學院環境與植物保護研究所/農業農村部熱帶作物有害生物綜合治理重點實驗室,海南海口 571101
針對引起海南省白沙農場中粒種咖啡成株葉片呈磚紅色枯萎癥狀的一種未知病害的病原菌進行分離,分離得到菌株21BS02-1和21BS02-2。將分離菌株接種到葉片并觀察癥狀,發現菌株21BS02-1的發病癥狀與田間癥狀一致,通過再分離獲得的菌株發病癥狀也與初始病原菌癥狀一致,由此確定菌株21BS02-1即為致病菌。菌株21BS02-1的菌落主要呈白色,氈狀,菌絲致密,菌落中央呈玫瑰色;其菌絲體細長,部分菌絲為有隔菌絲;大型分生孢子兩端稍彎曲,形狀似鐮刀,其大小為(56.26~175.76)μm × (12.93~19.78)μm,有3~7個分隔;小型分生孢子較少,呈橢圓形,0~1個分隔;根據形態特征初步鑒定該病原菌為鐮刀菌(sp.)。進一步對菌株21BS02-1的、、基因序列進行克隆測序,經Blast搜索表明,其、、序列與的同源性分別達到99.56%(MN686293)、100%(KJ00154)、99.68%(KF918550)。3個單基因聚類樹均一致,表明菌株21BS02-1屬于磚紅鐮刀菌()。生物學特性測定表明,致病菌21BS02-1最適合的培養基為OMA和CMA培養基;碳源為蔗糖時的利用率最高;牛肉浸膏為致病菌最適生長的氮源;12 h光暗交替條件下菌絲生長最快;pH在7~9范圍內最適合該致病菌生長。本研究是磚紅鐮刀菌()侵染中粒種咖啡較為詳細的報道。
咖啡;葉枯病;病原鑒定;磚紅鐮刀菌
咖啡屬于茜草科(Rubiaceae)咖啡屬()多年生灌木或小喬木,原產于非洲[1-2]。咖啡在國際貿易市場上有著非常重要的地位,目前已在50多個國家廣泛種植,其產量、產值和消費量均位居世界三大飲料(咖啡、茶、可可)之首[3-4]。我國主要種植的是小粒咖啡()與中粒咖啡(),前者主要在高海拔低緯度的云南種植[5],而后者則主要在高溫高濕海拔低于600 m的海南島種植[6-7]。我國小粒種咖啡最早由法國傳教士于1892年傳入云南省大理賓川縣朱苦拉,而中粒種咖啡則于20世紀初引入海南島(引自International Trade Center)。海南有著上百年的咖啡種植歷史,受南洋文化、華僑文化的影響,海南逐漸形成了獨具特色的咖啡文化,目前海南正在探索自由貿易港建設,海南省委省政府也高度重視咖啡產業的發展,鼓勵推動海南咖啡產業提質增效、做精做強,并適度擴大種植規模,因此,海南咖啡迎來了極佳的發展時期。
在咖啡生產過程中,病害是制約咖啡產業健康發展的重要限制因素之一[8]。咖啡整個生產周期中均可遭受不同病害的影響,如咖啡銹病嚴重時可能導致完全落葉[9];咖啡漿果病侵染未成熟咖啡豆,影響咖啡果實的產量和后期加工效果[10-11];咖啡枯萎病能夠導致咖啡樹整株死亡[12-13],這些世界性的病害曾對咖啡產業造成了巨大的經濟損失,嚴重影響了咖啡產業的健康發展[14]。此外,咖啡樹品種老化、氣候變化、極端天氣、引種或種質交換可導致新的病害不斷出現[15-18]。因此,生產過程中加強對咖啡病害的監測、預警以及防控,是保障咖啡產業健康發展不可或缺的環節。
本研究針對海南省白沙農場中粒種咖啡種植園中引起咖啡樹葉片呈磚紅色枯萎癥狀的一種未知病害,采集病葉樣本,對其病原菌進行分離鑒定,并測定該病原菌的生物學特性,研究結果可為該病害發生條件以及防治技術研究提供參考依據。
1 材料與方法
1.1 材料
2021年4—5月,于海南省白沙農場13隊中粒種咖啡種植園中采集咖啡病葉,將病葉置于樣品盒中,帶回試驗室備用。
1.2 方法
1.2.1 病原菌分離與純化 將田間采集的新鮮病葉,用自來水清洗葉片后,于超凈工作臺將葉片病健交界處剪5 mm × 5 mm的小塊,用無菌水清洗葉片30 s,用75%酒精浸泡20 s,后用0.1%升汞浸泡15~20 s,再用無菌水清洗3遍,置于滅菌濾紙上晾干水分,將葉片小塊置于提前倒制的PDA平板上,每皿放4~5塊。28℃恒溫培養4~5 d,待長出菌絲后挑取轉接至新的培養基中。28℃恒溫培箱中繼續培養,待菌絲體長滿約2/3皿時,加入適量無菌水,刮去氣生菌絲后,于自制產孢箱中培養2 d。然后用無菌水清洗孢子,用血球計數板計算孢子懸浮液濃度后,通過系列稀釋,將孢子懸浮液稀釋至濃度為10個/mL的孢子懸浮液,再將稀釋后的孢子懸浮液均勻涂布在PDA平板上,于28℃培養后挑取單菌落轉接至新PDA平板上完成純化過程。最后挑取菌絲體塊,接種到斜面試管中,低溫保存菌種[19]。
1.2.2 致病性測定 摘取新鮮、長勢一致的健康嫩葉,無菌水清洗,用滅菌昆蟲針刺傷葉片,將培養的分離物菌餅接種(菌絲面朝下)到葉片刺傷部位,以接種清水為對照,各接種3片葉,于瓷盤保濕培養并定期觀察;同時配制濃度為1×106個/mL的孢子懸浮液,于咖啡植株葉片噴霧接種,保濕,定期觀察接種癥狀;將發病組織進行再分離以觀察其孢子形態。
1.2.3 病原菌形態學與分子鑒定 將純化獲得的病原菌在PDA平板活化,觀察菌落形態、顏色、質地等。利用光學顯微鏡觀察菌絲體形態結構、孢子形態,隨機選取100個分生孢子,測量其大小,并參考BOOTH[20]的分類標準進行病原菌的形態學鑒定。
采用PDB液體培養基搖瓶培養,長出大量菌絲體后,收集菌絲體凍干,于液氮中研磨至粉狀,再參照OMEGA真菌提取試劑盒說明書提取致病菌的DNA。采用通用引物ITS1(5?TCCGTAG GTGAACCTGCGG?3)和ITS4(5?TCCTCC GC TTATTGATATGC?3)[21]、基因引物Bt2a(5?GGTAACCAAATCGGTGCTGCTTTC?3)和Bt2b(5?ACCCT CCGTGTA GTGACCCTTGGC? 3)[22]、基因引物EF1-728F(5?CATCGAGAA GTTCGAGAAGG?3)和EF1-986R(5?TACTTG AAGGAACCCTTACC?3)[23]分別對病原菌DNA進行PCR擴增。ITS與β-tubulin反應程序:94℃預變性3 min;94℃變性30 s,55℃退火30 s,72℃延伸1 min,35個循環;72℃延伸10 min,4℃條件下保存;TEF反應程序:94℃預變性3 min; 94℃變性1 min,60℃退火30 s,72℃延伸1 min,35個循環;72℃延伸10 min,4℃條件下保存。將擴增產物通過1%瓊脂糖凝膠電泳分離,并對電泳凝膠條帶回收。回收產物通過連接pMD18-T后,轉化大腸桿菌DH5α,在含有氨芐的LB平板上進行藍白斑篩選。采用M13通用引物對白斑進行菌落PCR鑒定,各選取3個陽性克隆送華大基因科技股份有限公司進行測序。將獲得的序列通過NCBI進行Blast比對,根據比對結果下載同源性較高的菌株,使用Seqman軟件將下載的序列進行校對(確保比對菌株序列開始、終止位點及方向一致),將處理好的序列使用MEGA 6.0軟件中的鄰接法(neighbour-joining)構建系統發育樹。
1.2.4 病原菌生長培養條件測定 (1)病原菌較佳培養基篩選。將直徑為5 mm的病原菌菌餅分別接種到馬鈴薯葡萄糖瓊脂培養基(PDA)、馬鈴薯蔗糖瓊脂培養基(PSA)、玉米瓊脂粉培養基(CMA)、燕麥粉瓊脂培養基(OMA)、Czapek培養基、牛肉膏蛋白胨培養基、薩氏(Sabouraud)等培養基上[17],每種培養基設置3次重復,28℃恒溫培養7 d,用十字交叉法測定菌落的直徑。
(2)病原菌生長不同營養條件篩選。以Czapek為基礎培養基,將其中的蔗糖用麥芽糖、果糖、葡萄糖、乳糖、甘露醇、可溶性淀粉代替;將基礎培養基Czapek中的硝酸鈉用牛肉浸膏、半胱氨酸、甘氨酸、硫酸銨、硝酸銨、氯化銨、尿素代替;以Czapek培養基為對照,每個處理設置3個重復,28℃恒溫培養7 d,用十字交叉法測定菌落的直徑[24]。
(3)病原菌生長不同非營養條件篩選。將溫度為50~60℃的PDA培養基用濃度為1 mol/L HCl和1 mol/L NaOH溶液調節pH,pH依次調為3、4、5、6、7、8、9、10、11、12的培養基,再分別倒入平板中晾干備用,將直徑為5 mm的病原菌接種到PDA平板上,將平板分別置于光照條件為24 h全光照、24 h全黑暗、12 h光照12 h黑暗。每個處理設置3個重復,28℃恒溫培養7 d,用十字交叉法測定菌落的直徑[25]。所有處理均按照1.2.1的方法制備孢子懸浮液,觀察不同條件下致病菌的產孢情況。
1.3 數據處理
使用Excel 2010軟件進行數據統計,采用IBM SPSS Statistics 22.0軟件進行分析,采用Duncan’s新復極差法檢驗不同處理間的差異顯著性(<0.05),使用Origin 2019軟件制圖。
2 結果與分析
2.1 病害癥狀與病原菌的形態觀察
大田觀察該病害主要侵染咖啡老葉的葉尖、葉緣。發病葉片葉尖干枯皺縮,失去水分的葉片變得易碎,后期呈紅棕色,干枯部位有輪紋狀病斑出現,病健交界處偶有淡黃色暈圈(圖1A~圖1C)。
分離獲得的菌株21BS02-1在PDA培養基上菌落呈圓形,菌絲為白色毛氈狀,菌落中央有玫瑰色色素產生,外部菌絲呈白色,菌落背面中心近橘紅色,靠近中心的菌絲白色,較密集,外圈主要為氣生菌絲,較稀疏(圖1D)。菌絲體細長,表面不光滑,部分菌絲為有隔菌絲(圖1E)。顯微鏡下觀察其小型分生孢子卵形或橢圓形,有0~1個分隔,但小型分生孢子較少,主要為大型分生孢子,大型分生孢子兩端呈喙狀且稍彎曲,形狀似鐮刀(圖1F,圖1G)。顯微鏡40倍觀察其大小為(56.26~ 175.76)μm×(12.93~19.78)μm,3~7個分隔,與BOOTH[20]描述的分類情況一致。據此初步鑒定菌株21BS02-1為鐮刀菌(sp.)。

A、B、C:為病害田間癥狀;D:菌落在PDA平板上的正反面形態;E:致病菌菌絲形態;F:分生孢子梗和大型分生孢子;G:大型分生孢子形態。
2.2 病原菌柯赫氏法則驗證
將分離物接種至中粒種咖啡離體葉片,接種3 d后,葉片病斑為棕褐色,后期病斑逐漸擴大,病部有輪紋狀病斑,與原寄主癥狀相似,而接種清水(CK)則未見擴散性病斑(圖2A,圖2B);無刺傷孢子噴霧接種后,30 d時出現深褐色病斑,病健交界處偶有淡黃色暈圈(圖2C),60 d時,病健交界處的淡黃色暈圈較為清晰,發病部位葉片干枯卷曲,部分已破裂缺失(圖2D)。對上述發病葉片進行再分離獲得的病原菌孢子形態均為鐮刀狀,兩端喙狀且彎曲,形似鐮刀且有分隔,小型分生孢子卵圓形(圖2E~圖2H),與接種菌株21BS02-1一致。

A、B:分別為致病菌接種3、4 d的癥狀,左側虛線框為CK,右側實線框為接種致病菌后葉部癥狀;C:無刺傷接種30 d癥狀;D:無刺傷接種60 d癥狀;E、F:再分離獲得的大型分生孢子和小型分生孢子;G:小型分生孢子;H:大型分生孢子。
2.3 病原菌分子特征
通過使用、、基因通用引物ITS1/ITS4、Bt2a/Bt2b、EF1-728F/EF1-986R對致病菌株21BS02-1的DNA分別進行PCR擴增,單一條帶克隆測序獲得3個基因引物,其擴增片段大小依次為557、340、317 bp。經blast搜索表明,致病菌的、、基因克隆序列與的同源性分別達到99.56%(MN686293)、100%(KJ00154)、99.68%(KF918550)。
根據系統發育單基因樹表明,基因樹中,菌株21BS02-1與DQ655721序列聚為同一支,其節點支持率為99%(圖3);基因樹中,菌株21BS02-1與KJ001543序列、KJ001544序列聚為同一支,節點支持率為99%(圖4);基因樹中,菌株21BS02-1與KF918549序列聚為同一支,且節點支持率為99%(圖5)。綜上,3個單基因發育樹均一致,表明致病菌株21BS02-1與高度同源。由此表明,該致病菌株屬于。
2.4 病原菌生物學特性測定
2.4.1 不同培養基對病原菌生長的影響 致病菌株21BS02-1在不同培養基上的生長情況各不相同。適于菌絲生長的培養基是OMA和CMA培養基,其菌落平均直徑分別為71.25 mm和70.17 mm,但菌絲稀薄且產孢量較低;其次是牛肉膏蛋白胨培養基,菌落平均直徑為63.00 mm,產孢量最低,僅為0.5×105個/mL;在PDA、PSA、Czapek培養基上菌落較小,在PDA和PSA培養基上菌絲密集,薩氏培養基中的生長情況最差。適于產孢的培養基為PSA,產孢量為28.3×105個/mL;其次為PDA(圖6)。
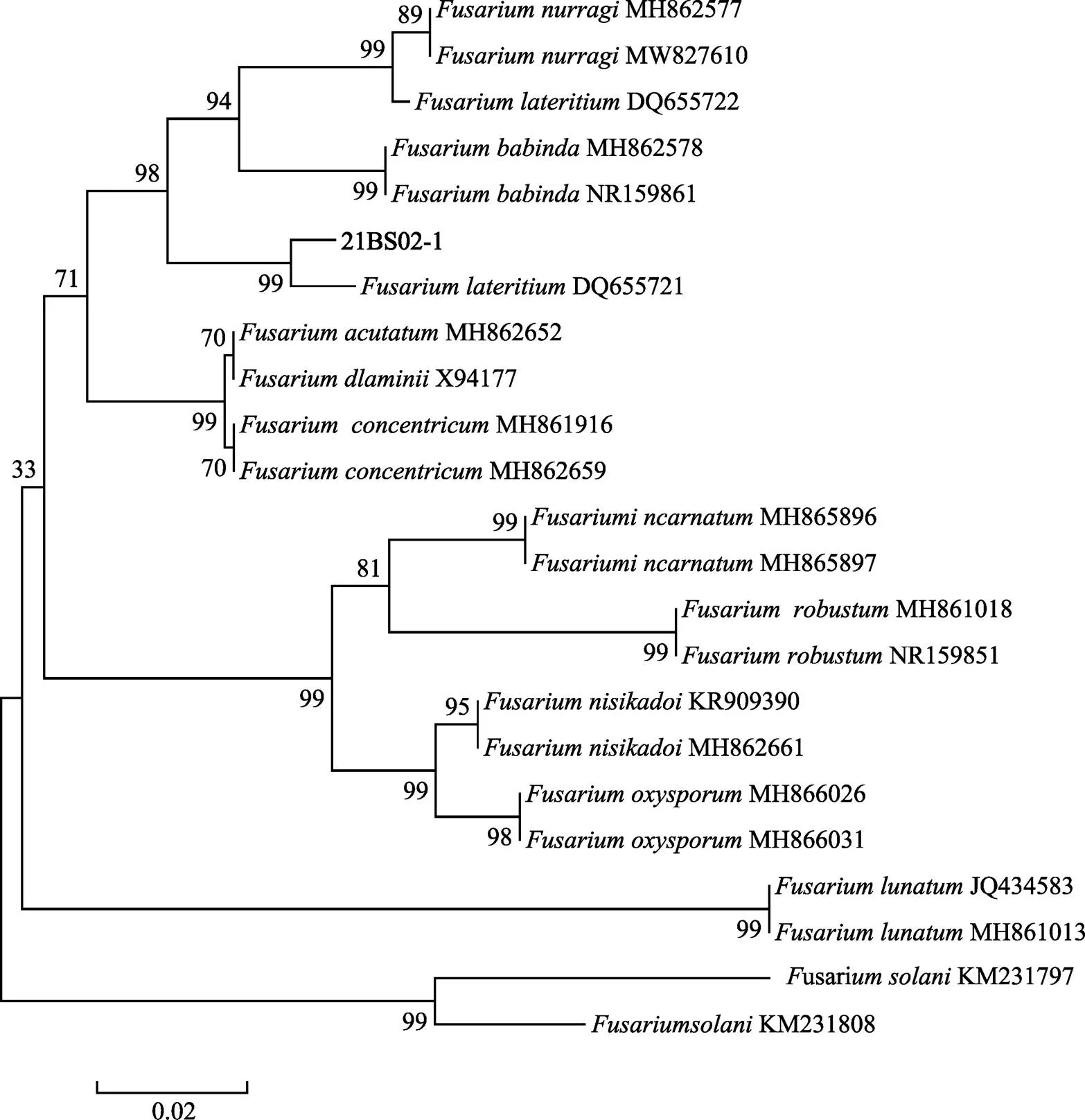
圖3 基于ITS基因序列構建的菌株21BS02-1系統發育進化樹
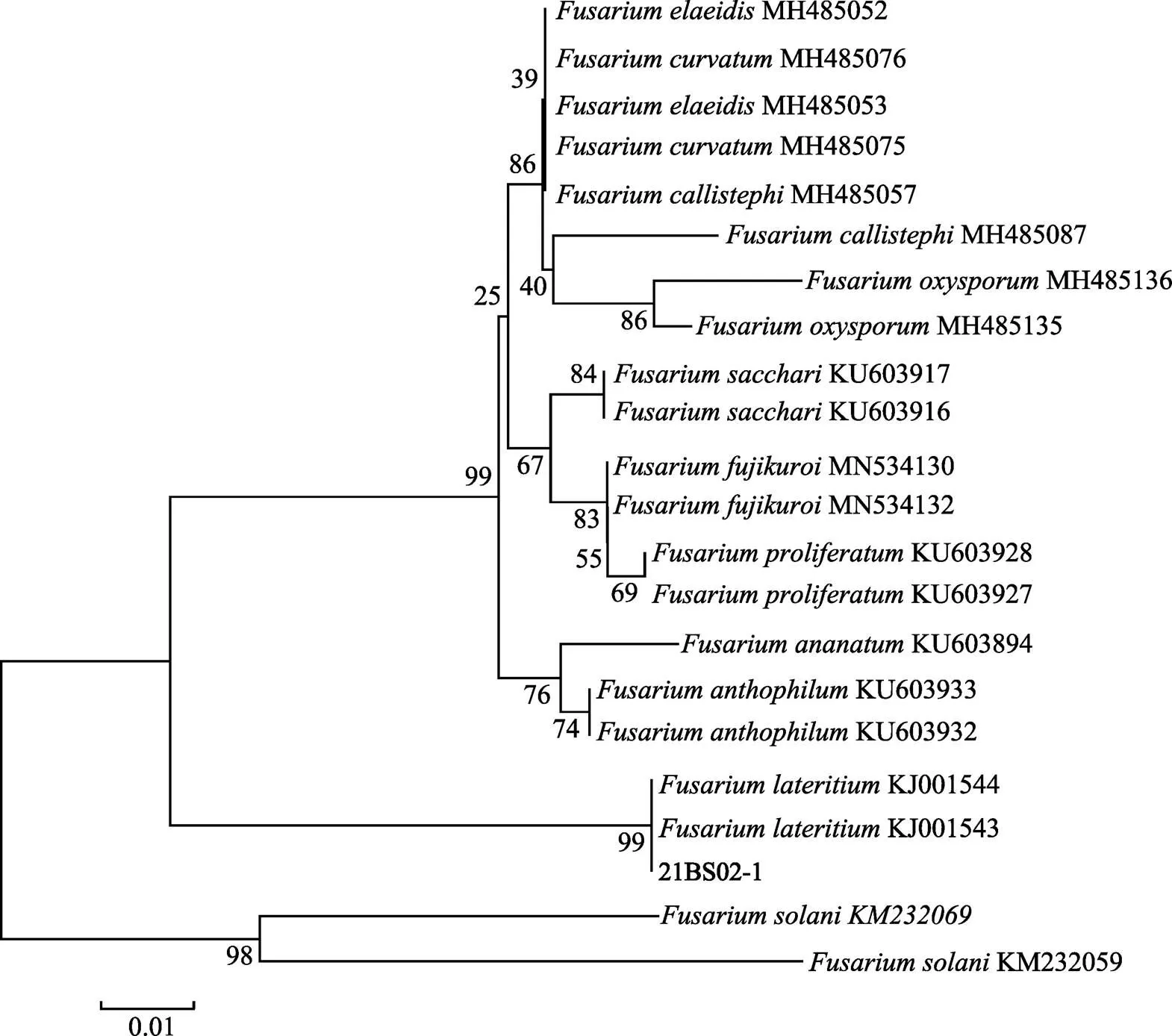
圖4 基于β-tubulin基因序列構建的菌株21BS02-1系統發育進化樹
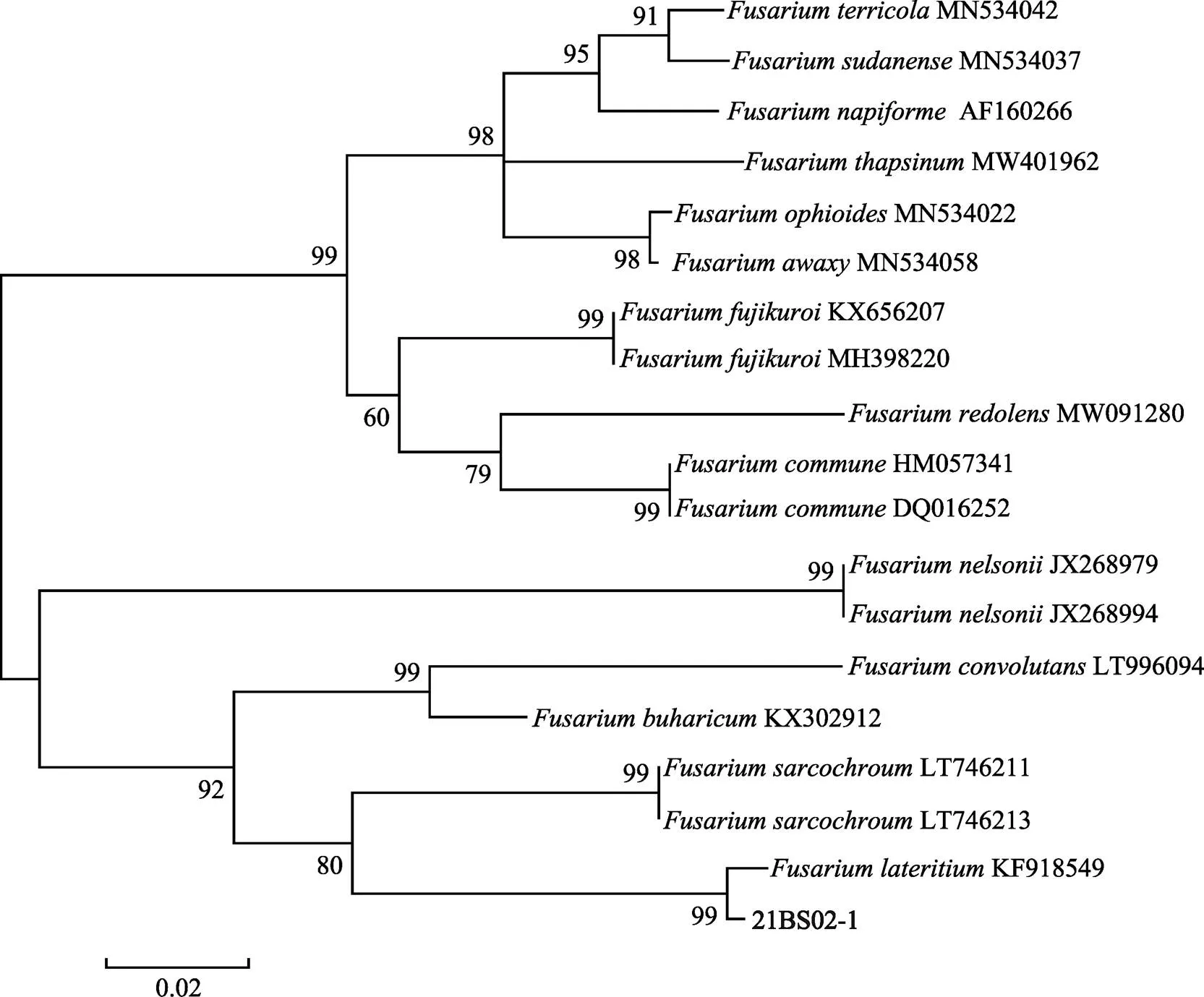
圖5 基于TEF基因序列構建的菌株21BS02-1系統發育進化樹
2.4.2 不同營養條件對病原菌生長的影響 不同碳源培養條件下,蔗糖的利用率最高,菌落平均直徑為65.08 mm,且其產孢量最高,達到17×105個/mL;其次為麥芽糖培養基,其菌落平均直徑為61.42 mm(圖7A)。果糖、葡萄糖和可溶性淀粉的產孢量無顯著差異。其他碳源利用率相對較差,最不適合致病菌生長的碳源為可溶性淀粉和果糖,其菌落平均直徑分別為53.50 mm和53.00 mm,乳糖和可溶性淀粉培養基的菌絲較稀疏,其中,乳糖培養基產孢量最低,僅有3.8×105個/mL(圖7B)。
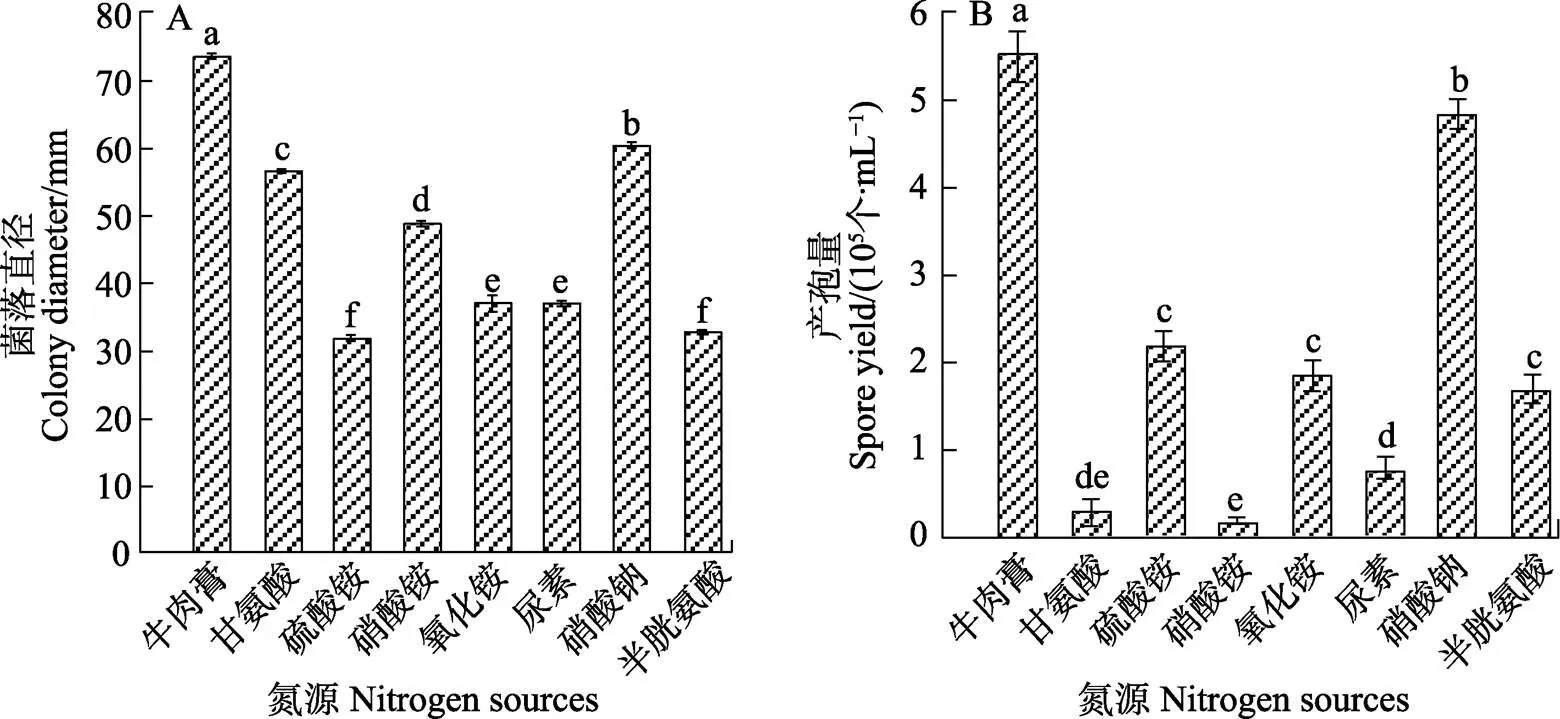
在氮源方面,培養效果最好的是牛肉浸膏,其菌落平均直徑為73.58 mm,顯著高于其他氮源培養基,產孢量也最高,為5.5×105個/mL,但菌絲最稀薄;硝酸鈉效果次之,其菌落平均直徑為60.42 mm;效果最差的是以硫酸銨和半胱氨酸為氮源的培養基,其菌落平均直徑分別為31.58、32.67 mm。甘氨酸和硝酸銨為氮源的平板上產孢量最低,分別為0.25×105個/mL和0.125×105個/mL(圖8)。
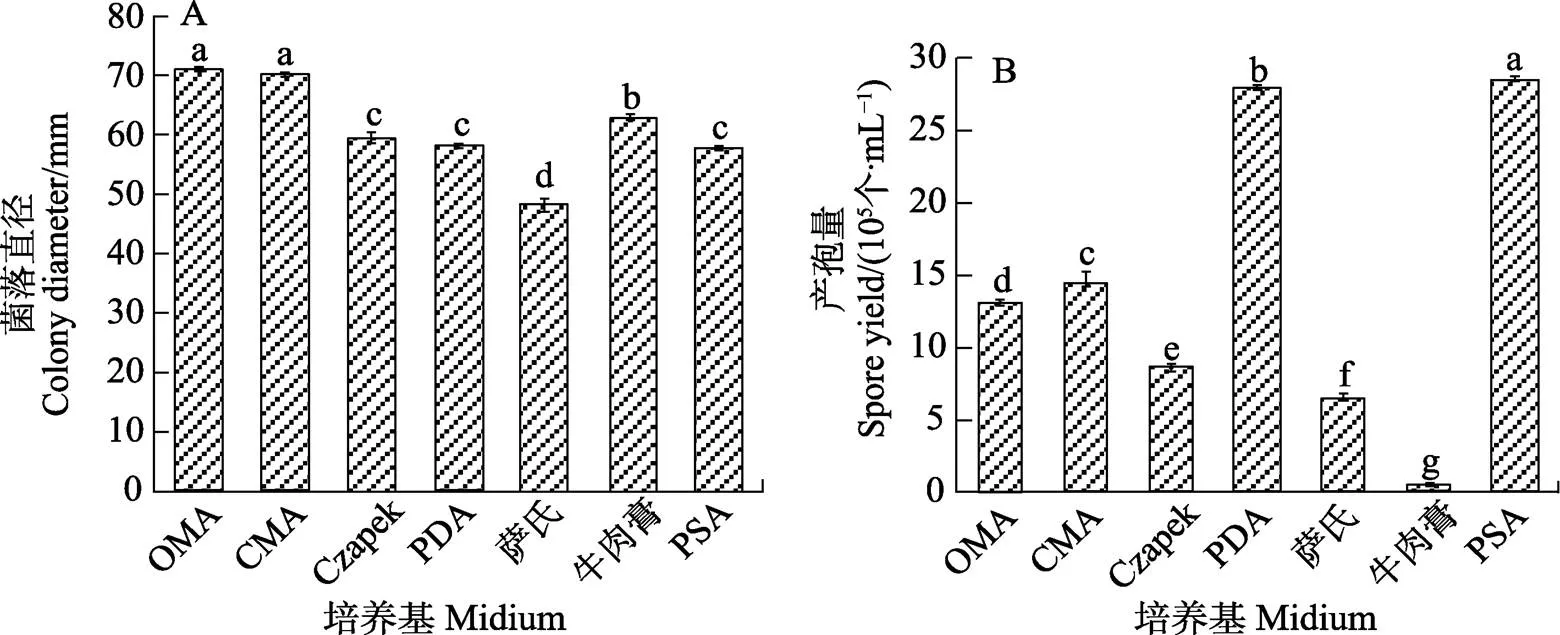
不同小寫字母表示差異顯著(P<0.05)。

不同小寫字母表示差異顯著(P<0.05)。
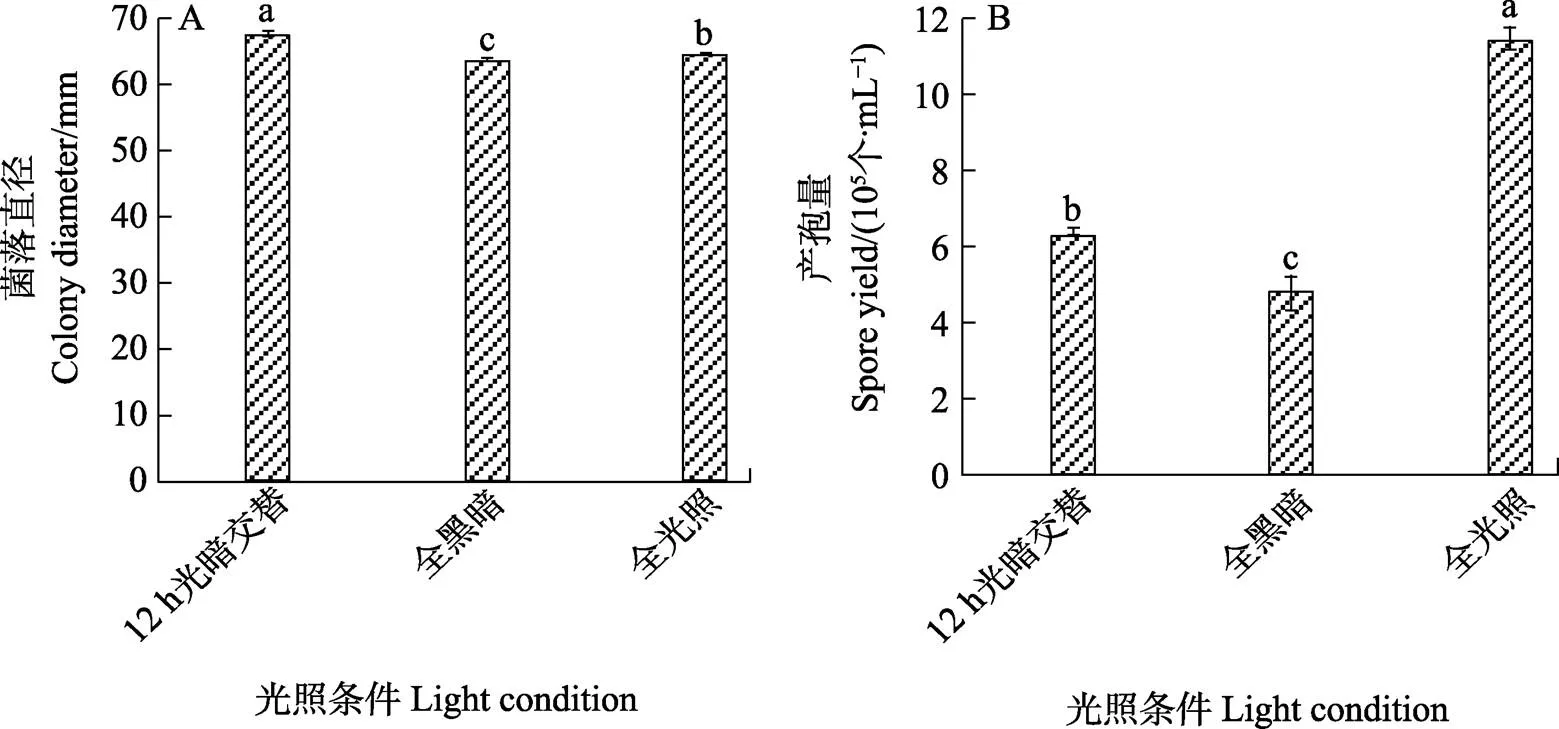
2.4.3 菌株21BS02-1生長所需較佳非營養條件 在不同光照條件下,菌絲體的生長也存在差異,由圖9可以看出12 h光暗交替的條件下,菌絲生長最快,其菌落平均直徑為67.33 mm;而全光照條件更有利于菌株產孢,且顯著高于其他2種處理,其產孢量為11.5×105個/mL;在光暗交替條件下,雖然菌絲生長最快,但產孢量顯著低于全光照條件(圖9)。
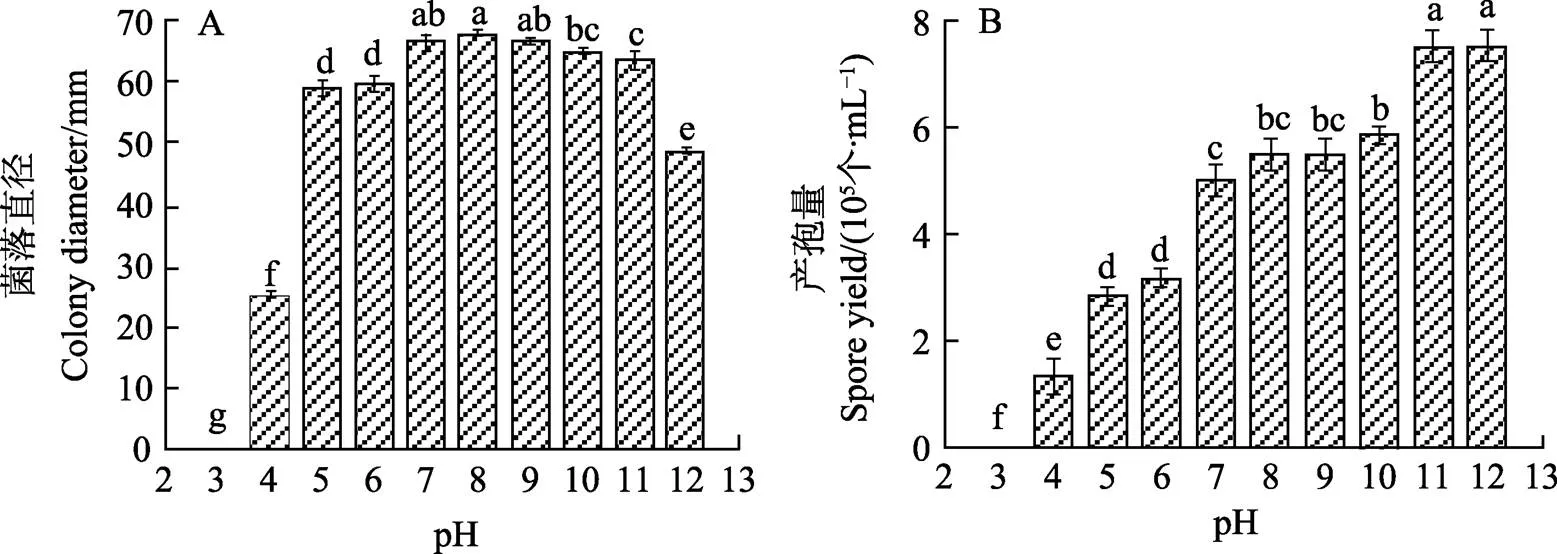
不同pH條件對菌絲體生長有一定的影響。在設置的10個pH條件下,pH為8時,菌絲生長情況最好,其菌落平均直徑為67.75 mm;pH為7、9、10的條件下,菌絲體生長情況無顯著差異,菌落平均直徑分別為66.25、66.58、64.75 mm。pH低于5以及高于11都對菌絲體生長有抑制作用,強酸性條件對菌絲生長抑制效果更加明顯。當pH≥8時,產孢量逐漸增加,且pH為11和12時的產孢量最高,其產孢量為7.5×105個/mL,相比較而言,堿性條件更適合菌株產孢;酸性條件明顯對產孢有抑制作用,酸性越強,產孢量越低(圖10)。
不同小寫字母表示差異顯著(P<0.05)。
不同小寫字母表示差異顯著(P<0.05)。
不同小寫字母表示差異顯著(P<0.05)。
3 討論
鐮刀菌(sp.)在自然界內分布極廣,是一類重要的病原真菌。目前世界上已經發現的鐮刀菌有500多個種[19],其宿主非常廣泛。其中,尖孢鐮刀菌()具有較強的致病性[24]能夠引起香蕉、黃瓜等多種作物的枯萎病[26],也有能引起中草藥類和牧草類如滇重樓[27]、苜蓿[28]等的根腐、莖腐、葉枯等癥狀的鐮刀菌。而磚紅鐮刀菌可引起國槐潰瘍病[29]、榛子樹樹枝腐爛[30-31]以及向日葵枯萎病[32]等。總之,鐮刀菌能嚴重危害多種作物的健康生長,還可能引起作物的死亡,造成許多作物的經濟損失[33]。
在咖啡樹上,由引起的咖啡枯萎病是咖啡一種毀滅性病害,該病在埃塞俄比亞、烏干達、坦桑尼亞等國家發生嚴重[34];而由鐮刀菌(,)與根結線蟲復合侵染引起的咖啡木栓根病(coffee corky-root disease)也對咖啡造成了嚴重的影響[35]。近期,朱孟烽等[17]對云南咖啡園出現的一種咖啡果實變黑的黑果病害進行病原菌分離與鑒定,基于病原菌孢子形態以及結合構建的、、、四個單基因以及與基因的加合樹,將該病原菌鑒定為腐皮鐮孢菌()。雖然早在20世紀90年代已在云南思茅小粒種咖啡病害調查中初步認定咖啡鐮刀菌枯萎病病原為磚紅鐮刀菌(),但未見病原菌的柯赫法則及病原學等相關研究報道[36]。而本研究針對引起中粒種咖啡葉枯萎癥狀的致病菌進行了分離與鑒定,經形態與分子學鑒定,引起海南中粒種咖啡葉枯萎病的病原為磚紅鐮刀菌()。進一步研究表明,菌株21BS02-1的致病性較強,刺傷接種葉片后3 d即可發病;無刺傷接種發病較慢,但發病癥狀與田間癥狀一致。根據生物學特性測定可知,最適于致病菌生長的培養基為OMA和CMA培養基,但最適合產孢的培養基為PSA培養基;蔗糖為最適宜致病菌生長的碳源,且蔗糖為碳源時致病菌的產孢量最高。牛肉浸膏為最適合病原菌生長的氮源,也是最適合致病菌產孢的氮源;光照條件為12 h光暗交替更適合致病菌生長,但全光照條件更適合產孢;偏堿性環境比酸性環境更適合病原菌生長,在一定范圍內,強堿性環境下致病菌的產孢能力更強。本研究中菌株21BS02-1的生物學特性與柴兆祥等[25]和朱磊等[37]對磚紅鐮刀菌的研究結果較為一致。
鑒于磚紅鐮刀葉枯病在我國云南小種咖啡上危害較為普遍,以及國外的多種咖啡毀滅性病害均由鐮刀菌引起[34-36]。為此,需要進一步加強對該病害的監測預警與防治研究,以便及時、準確地為病害防控提供理論基礎和參考依據。
[1] DAVIS A P, GOVAERTS R, BRIDSON D M, STOFF ELEN P. An annotated taxonomic conspectus of the genus(Rubiaceae)[J]. Botanical Journal of the Linnean Society, 2006, 152(4): 465-512.
[2] WIERSUM K F, GOLE T W, GATZWEILER F, VOLK MAN J, BOGNETTEAU E, OLANIWIRTU. Certification of wild coffee in Ethiopia: experiences and challenges[J]. International Tree Crops Journal, 2008, 18(1): 9-21.
[3] BATISTA K D, ARAUJO W L, ANTUNES W C, CAVA TTE P C, MORAES G, MARTINS S C V, DAMATTA F M. Photosynthetic limitations in coffee plants are chiefly governed by diffusive factors[J]. Trees, 2012, 26(2): 459-468.
[4] YEBASSE M, SHIMELIS B, WARKU H, KO J, CHEOI K J. Coffee disease visualization and classification[J]. Plants, 2021, 10(6): 1257.
[5] 周 華, 李文偉, 張洪波, 釧相仙, 趙云翔, 李桂琳. 咖啡種質資源的引進、研究及利用[J]. 云南熱作科技, 2002(2): 1-6.
ZHOU H, LI W W, ZHANG H B, CHUAN X X, ZHAO Y X, LI G L. Introduction, research and utilization of coffee germplasm resources[J]. Journal of Yunnan Tropical Crops Science & Technology, 2002(2): 1-6. (in Chinese)
[6] 陳德新. 海南島咖啡早期引種擴種史考——中國咖啡早期引種擴種歷史考證系列文章(Ⅲ)[J]. 熱帶農業科學, 2010, 30(5): 52-57.
CHEN D X. A study on the history of early introduction and expansion of coffee in Hainan Island - a series of articles on the history of early introduction and expansion of coffee in China (Ⅲ)[J]. Chinese Journal of Tropical Agriculture, 2010, 30(5): 52-57. (in Chinese)
[7] 李亞男, 李榮福, 黃家雄, 王萬東, 程金煥, 王雪松. 咖啡主要栽培品種特性研究[J]. 安徽農業科學, 2012, 40(35): 17038-17041.
LI Y N, LI R F, HUANG J X, WANG W D, CHENG J H, WANG X S. Study on characteristics of main cultivated varieties of coffee[J]. Journal of Anhui Agricultural Sciences, 2012, 40(35): 17038-17041.
[8] AVELINO J, ANZUETO F. CHAPTER 9: coffee rust epidemics in Central America: chronicle of a resistance breakdown following the great epidemics of 2012 and 2013[M]//Emerging Plant Diseases and Global Food Security, 2020: 185-198.
[9] HINDORF H, OMONDI C O. A review of three major fungal diseases ofL. in the rain forests of Ethiopia and progress in breeding for resistance in Kenya[J]. Journal of Advanced Research, 2011, 2(2): 109-120.
[10] TALHINHAS P, BATISTA D, DINIZ I, VIEIRA A, SILVA D N, LOUREIRO A, TAVARES S, PEREIRA A P, AZINHEIRA H G. The coffee leaf rust pathogen: one and a half centuries around the tropics[J]. Molecular Plant Pathology, 2017, 18(8): 1039-1051.
[11] ADEM A, AMIN M, MAMO M. Assessment of coffee berry disease in west Hararge zone, eastern Ethiopia[J]. International Journal of Food Science and Agriculture, 2020, 4(4): 465-469.
[12] RUTHERFORD M A. Current knowledge of coffee wilt disease, a major constraint to coffee production in Africa[J]. Phytopathology, 2006, 96(6): 663-666.
[13] TIRU M, MULETA D, BERECHA G, ADUGNA G. Antagonistic effects of rhizobacteria against coffee wilt disease caused by[J]. Asian Journal of Plant Pathology, 2013, 7(3): 109-122.
[14] AMICO A L, ITUARTE-LIMA C, ELMQVIST T. Learning from social–ecological crisis for legal resilience building: multi-scale dynamics in the coffee rust epidemic[J]. Sustainability Science, 2020, 15(8): 485-501.
[15] 趙會杰, 趙 璟. 云南小粒咖啡綠色產業競爭力研究[J]. 合作經濟與科技, 2017(24): 48-49.
ZHAO H J, ZHAO J. Study on the competitiveness of green industry ofin Yunnan[J]. Co-Operative Economy & Science, 2017(24): 48-49. (in Chinese)
[16] BELACHEW K, TEFERI D. Climatic variables and impact of coffee berry diseases () in Ethiopian coffee production[J]. Journal of Biology, Agriculture and Healthcare, 2015: 2224-3208.
[17] 朱孟烽, 吳偉懷, 賀春萍, 梁艷瓊, 陸 英, 習金根, 莫麗珍, 譚施北, 易克賢. 咖啡腐皮鐮孢黑果病病原鑒定及其生物學特性測定[J]. 熱帶作物學報, 2021, 42(3): 822-829.
ZHU M F, WU W H, HE C P, LIANG Y Q, LU Y, XI J G, MO L Z, TAN S B, YI K X. Identification and biological characteristics ofcausing coffee black berry disease[J]. Chinese Journal of Tropical Crops, 2021, 42(3): 822-829. (in Chinese)
[18] 付興飛, 胡發廣, 程金煥, 婁予強, 呂玉蘭, 黃家雄, 李亞男, 李貴平. 七種種植模式下小粒咖啡病蟲害調查[J]. 熱帶農業科學, 2021, 41(9): 74-81.
FU X F, HU F G, CHENG J H, LOU Y Q, LV Y L, HUANG J X, LI Y N, LI G P. A survey of diseases and insect pests ofunder 7 agroforestry cultivation patterns[J]. Chinese Journal of Tropical Agriculture, 2021, 41(9): 74-81. (in Chinese)
[19] 閆文雪, 石延霞, 李盼亮, 柴阿麗, 謝學文, 李寶聚. 大白菜枯萎病病原鐮刀菌種類的初步研究[J]. 植物病理學報, 2018, 48(5): 587-593.
YAN W X, SHI Y X, LI P L, CHAI A L, XIE X W, LI B J. Preliminary study onspecies causing Chinese cabbage wilt[J]. Acta Phytopathologica Sinica, 2018, 48(5): 587-593. (in Chinese)
[20] BOOTH C. 鐮刀菌屬[M]. 陳其煥, 譯. 北京: 農業出版社, 1988.
BOOTH C. The genus[M]. CHEN Q H, Translated. Beijing: Agricultural Publishing House, 1988. (in Chinese)
[21] WHITE T, BRUNS T, LEE S, TAYLOR FJRM, LEE S H, TAYLOR L, SHAWETALOR J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//PCR protocols: a guide to methods and applications. Amsterdam: Elsevier, 1990: 315-322.
[22] GLASS N L, DONALDSON G C. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J]. Applied and Environmental Microbiology, 1995, 61(4): 1323-1330.
[23] REHNER S A, SAMUELS G J. Taxonomy and phylogeny ofanalysed from nuclear large subunit ribosomal DNA sequences[J]. Mycological Research, 1994, 98(6): 625-634.
[24] 敬雪敏, 羅英花, 秦忠成, 李向陽, 閆紅秀, 劉香萍. 尖孢鐮刀菌生物學特性及殺菌劑毒力測定[J]. 中國草地學報, 2019, 41(5): 144-151.
JING X M, LUO Y H, QIN Z C, LI X Y, YAN H X, LIU X P. Biological characteristics ofand determination of fungicide toxicity[J]. Chinese Journal of Grassland, 2019, 41(5): 144-151. (in Chinese)
[25] 柴兆祥, 李金花, 辛劍鋒. 磚紅鐮孢生物學特性研究[J]. 植物病理學報, 2004(5): 409-413.
CHAI Z X, LI J H, XIN J F. Study on biological characteristics of[J]. Acta Phytopathologica Sinica, 2004(5): 409-413. (in Chinese)
[26] 李華平, 李云鋒, 聶燕芳. 香蕉枯萎病的發生及防控研究現狀[J]. 華南農業大學學報, 2019, 40(5): 128-136.
LI H P, LI Y F, NIE Y F. Occurrence and control of bananawilt[J]. Journal of South China Agricultural University, 2019, 40(5): 128-136. (in Chinese)
[27] 何 翔, 李 翱, 李 楚, 張 慶, 楊群輝, 朱紅業, 陳齊斌, 楊佩文. 滇重樓稻曲擬盤多毛孢葉斑病病原鑒定及其生物學特性測定[J]. 植物保護, 2020, 46(6): 47-54, 64.
HE X, LI A, LI C, ZHANG Q, YANG Q H, ZHU H Y, CHEN Q B, YANG P W. Pathogen indentification and biological characteristics ofvar.leaf sopt disease caused by[J]. Plant Protection, 2020, 46(6): 47-54, 64. (in Chinese)
[28] 叢麗麗, 康俊梅, 張鐵軍, 龍瑞才, 楊青川. 苜蓿鐮刀菌根腐病病原菌的分離鑒定與致病性分析[J]. 草地學報, 2017, 25(4): 857-865.
CONG L L, KANG J M, ZHANG T L, LONG R C, YANG Q C. Identification and pathogenicity test of pathogenicof alfalfa root rot[J]. Acta Agrestia Sinica, 2017, 25(4): 857-865. (in Chinese)
[29] 李良壯, 劉南南, 袁鳳英, 王桂清. 國槐潰瘍病致病菌磚紅鐮刀菌毒素的寄主專化性研究[J]. 農業科技與裝備, 2018(4): 15-18.
LI L Z, LIU N N, YUAN F Y, WANG G Q. Host specificity oftoxin, a pathogen ofcanker[J]. Agricultural Science & Technology and Equipment, 2018(4): 15-18. (in Chinese)
[30] BELISARIO A, MACCARONI M, CORAMUSI A. First report of twig canker of hazelnut caused byin Italy[J]. Plant Disease, 2005, 89(1): 106-106.
[31] VITALE S, SANTORI A, WAINBERG E, CASTAGNONE-SERENO P, LUONGO L, BELISARIO A. Morphological and molecular analysis of, the cause of gray necrosis of hazelnut fruit in Italy[J]. Phytopathology, 2011, 101(6): 679-86.
[32] 高 婧, 張園園, 王 凱, 張 鍵, 張 貴, 趙 君. 向日葵枯萎病菌的分離鑒定及其生物學特性[J]. 中國油料作物學報, 2016, 38(2): 214-222.
GAO J, ZHANG Y Y, WANG K, ZHANG J, ZHANG G, ZHAO J. Identification of sunflower wilt pathogen and its biological characteristics[J]. Chinese Journal of Oil Crop Sciences, 2016, 38(2): 214-222. (in Chinese)
[33] 謝安娜, 徐浩飛, 張志林, 魏 婷, 佘艷萍, 劉欣然, 史紅安. 致病鐮刀菌的研究進展[J]. 湖北工程學院學報, 2020, 40(6): 37-41.
XIE A N, XU H F, ZHANG Z L, WEI T, SHE Y P, LIU X R, SHI H A. Research progress of pathogenic[J]. Journal of Hubei Engineering University, 2020, 40(6): 37-41. (in Chinese)
[34] PECK L D, NOWELL R W, FLOOD J, RYAN M J, BARRACLOUGH T G. Correction to: historical genomics reveals the evolutionary mechanisms behind multiple outbreaks of the host-specific coffee wilt pathogen[J]. BMC Genomics, 2021, 22: 404.
[35] GAMBOA-BECERRA R, LOPEZ-LIMA D, VILLAIN L, BREITLER J C, DESGARENNES D. Molecular and environmental triggering factors of pathogenicity ofandisolates involved in the coffee corky-root disease[J]. Journal of Fungi - Open Access Mycology Journal, 2021, 7(4): 253.
[36] 莫麗珍, 周燕飛. 咖啡鐮刀菌枯萎病及其防治[J]. 云南熱作科技, 1996, 19(2): 36-37.
MO L Z, ZHOU Y F. The control of coffeewilt[J]. Tropical Agricultural Science & Technology, 1996, 19(2): 36-37. (in Chinese)
[37] 朱 磊, 劉 凡, 黃 云, 李文光. 白術鐮刀根腐病菌()生物學特性研究[J]. 安徽農學通報(上半月刊), 2012, 18(11): 45-48.
ZHU L, LIU F, HUANG Y, LI W G. The biology characteristics ofon root rot ofKoidz.[J]. Anhui Agricultural Science Bulletin, 2012, 18(11): 45-48. (in Chinese)
Identification and Biological Analysis ofCausing Leaf Blight Disease on
WANG Qian1,2, WU Weihuai2*, HE Chunping2, LIANG Yanqiong2, LU Ying2, YI Kexian2*
1. School of Plant Protection, Hainan University / Key Laboratory of Green Prevention and Control of Tropical Agricultural and Forestry Biological Disasters, Ministry of Education, Haikou, Hainan 570228, China; 2. Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Integrated Pest Management on Tropical Crops, Ministry of Agriculture and Rural Affairs, Haikou, Hainan 571101, China
An unknown disease onwhich caused the leaves to become brick-red and withered in a farm of Baisha County, Hainan Province was studied. Two pure cultures 21BS02-1 and 21BS02-2 were isolated. The isolates were inoculated into the leaves and the symptoms were observed. It was found that the symptoms of 21BS02-1 were similar to the field symptoms, and the re-isolate was also consistent with the original pathogen. Therefore, strain 21BS02-1 was determined to be the pathogen. The colony of strain 21BS02-1 was mainly white, felt, dense hyphae, and the color of the center colony was rose. Its mycelia were slender, and some mycelia were septate mycelium. The two ends of macroconidia were slightly curved and shaped like a sickle, with a size of (56.26-175.76)μm × (12.93-19.78)μm, and there were 3-7 partitions. There were few microconidium, which were mainly elliptical and with 0-1partition. According to the morphological characteristics, the pathogen was preliminarily identified assp. Then through internal transcribed spacer (),andgenes to identify the pathogen, BLAST indicated that the homology withof each gene sequence was 99.56% (MN686293), 100% (KJ00154), 99.68% (KF918550), respectivelyThe three single gene cluster trees based on,andgene sequence showed that 21BS02-1 belonged toThe determination of biological characteristics showed that the most suitable medium for 21BS02-1 was OMA and CMA medium. The most suitable carbon source was sucrose, and the utilization rate was the highest. Beef extract was the most suitable nitrogen source. The mycelia growth was the fastest under the condition of alternating light and dark for 12 h, and pH value 7-9.This is the first detailed report ofinfecting.
coffee; leaf blight disease; pathogen identification;
S435.712
A
10.3969/j.issn.1000-2561.2022.11.019
2022-02-15;
2022-05-20
中國熱帶農業科學院基本科研業務費專項資金項目(No. 1630042017021)。
王 倩(1996—),女,碩士研究生,研究方向:咖啡病害監測與防控。*通信作者(Corresponding author):吳偉懷(WU Weihuai),E-mail:weihuaiwu2002@163.com;易克賢(YI Kexian),E-mail:yikexian@126.com。

