MicroRNA-181b對2型糖尿病胰島素分泌調節的作用及其機制研究*
曾維新,云川,李曉燕,李大偉
(海南醫學院第一附屬醫院 內分泌科,海南 海口 570102)
糖尿病是一種常見的內分泌疾病,包括1 型和2 型糖尿病(type 2 diabetes mellitus,T2DM),其中T2DM 可發生于任何年齡,是最主要的糖尿病類型。隨著我國人民生活水平的提高和飲食方式的改變,T2DM 發病率逐年升高。目前約11.6%成年人患T2DM,預計到本世紀40 年代,國內糖尿病患者將會超過6億[1]。胰島β 細胞功能缺陷導致的胰島素缺乏和胰島素抵抗(insulin resistance,IR)是T2DM 患者發病的最主要原因[2]。MicroRNA(miRNA)是一種具有保守序列的微小RNA,可以通過抑制或促進RNA降解來調節后續基因的表達。有研究發現,肥胖與瘦人群的miRNA 表達有顯著差異[3],而肥胖引起的脂質超載與T2DM 發病關系密切。DEHGHANI等[4]發現,T2DM 患者血清miR-181b 水平異常。NDRG2是NDRG 家族成員,與miRNA 類似,具有高度保守性。近年來研究發現,NDRG2 在糖尿病小鼠的胰腺中異常表達,可能參與胰島素分泌[5];同時腫瘤相關研究發現,NDRG2 可能是miR-181b 的下游靶基因[6]。基于此,本研究觀察miR-181b 能否通過靶向調控下游基因NDRG2參與IR,探究其在T2DM 發病中的機制。
1 材料與方法
1.1 細胞株、主要試劑及儀器
細胞株選用小鼠胰島β 細胞(美國ATCC)。熒光素酶檢測試劑盒(美國Biovision 公司),miR-181b模擬物、miR181b inhibitor、陰性對照(上海吉滿生物科技有限公司),轉染試劑盒(賽默飛世爾科技中國有限公司),NDRG2 單克隆抗體、二抗(英國Abcam公司),辣根過氧化物酶(北京中杉金橋生物技術公司)。二氧化碳培養箱(常州恒隆儀器有限公司),酶標儀(賽默飛世爾科技中國有限公司),二級生物安全柜(BSC-1100IIA2-X,濟南歐萊博科學儀器有限公司)。
1.2 方法
1.2.1 細胞培養采用含10 μL/L β-巰基乙醇和10%胎牛血清的DMEM 高糖培養液培養小鼠胰島β細胞,培養條件為:37℃、5%二氧化碳培養箱恒溫培養,當細胞生長至融合度>80%開始進行細胞傳代。
1.2.2 轉染首先使用預測軟件Targetsca(http://www.targetscan.org)和miRanda(http://www.microrna.org/microrna/home.do)進行靶基因預測,利用Primer 5.0軟件進行引物設計,構建NDRG2 野生型(NDRG2WT-1uc)與突變型(NDRG2MUT-1uc)熒光素酶報告基因質粒。
1.2.3 熒光素酶報告基因實驗檢測相對熒光強度將培養后的小鼠胰島β 細胞接種于24 孔板,繼續培養過夜,待完全貼壁后采用脂質體轉染法轉染,分為Control 組(陰性對照)、NDRG2-WT 組(轉染NDRG2WT-luc)、NDRG2-MUT組(轉染NDRG2MUT-luc)、miR-181b mimics+NDRG2-WT 組(轉染miR-181b 模擬物和NDRG2WT-luc)、miR-181b mimics+NDRG2-MUT 組(轉染miR-181b 模擬物和NDRG2MUT-luc)、miR-181b inhibitor+NDRG2-WT 組(轉 染miR-181b inhibitor 和 NDRG2WT-luc)、miR-181 binhibitor+NDRG2-MUT 組(轉 染 miR-181b inhibitor 和NDRG2MUT-luc)。轉染48 h 的細胞將用于后續實驗。轉染結束后檢測海腎和螢火蟲熒光素酶的熒光強度,以兩者的比值來衡量相對活性,反映miR-181b與NDRG2 結合情況。
1.2.4 過表達和抑制 NDRG2根據LipofectamineTM2000 試劑盒說明書進行操作,所有質粒購自美國Addgene 公司。將pLenti6-NDRG2(過表達組)、pLenti6-Cherry(過表達對照組)、pLKONDRG2 shRNA(敲低組)、pLKO-Scramble(敲低對照組)分別與psPAX2 質粒、pMD2.G 質粒共同轉染至小鼠胰島β 細胞,轉染后48 h 取上清液,采用實時熒光定量聚合酶鏈反應(quantitative real-time polymerase chain reaction,qRT-PCR)檢測NDRG2 mRNA 的表達(按2-ΔΔCt法計算相對表達量);Western blotting 檢測NDRG2 蛋白的表達;葡萄糖刺激的胰島素釋放試驗檢測低濃度(5 mmol/L)和高濃度(20 mmol/L)葡萄糖條件下的胰島素分泌量。
1.2.5 qRT-PCR檢測 miR-181b 和 NDRG2 mRNA未轉染的小鼠胰島β 細胞培養48 h后,予以低濃度(5 mmol/L)和高濃度(20 mmol/L)葡萄糖刺激,收集上清液,以未加入葡萄糖為對照組,采用qRT-PCR 檢測5 mmol/L 葡萄糖組、20 mmol/L 葡萄糖組及對照組小鼠胰島β 細胞內源性miR-181b 和NDRG2 mRNA 表達。
1.2.6 葡萄糖刺激的胰島素釋放試驗檢測胰島素分泌量在低濃度(5 mmol/L)和高濃度(20 mmol/L)葡萄糖條件下,將miR-181b 模擬物(miR-181b mimics組)、miR-181b 抑制劑(miR-181b inhibitor 組)、陰性對照(Control 組)轉染至小鼠胰島β 細胞中,轉染48 h 后采用葡萄糖刺激的胰島素釋放試驗檢測胰島素分泌量。
1.3 統計學方法
數據分析采用SPSS 20.0 統計軟件。計量資料以均數±標準差()表示,多組比較用方差分析,進一步兩兩比較用t檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 各組相對熒光強度比較
Control 組相對熒光強度為(100.00±1.01)%、NDRG2-WT 組為(104.20±3.04)%、NDRG2-MUT 組為(98.00±2.12)%、miR-181b mimics+NDRG2-WT 組為(63.27±5.16)%、miR-181b mimics+NDRG2-MUT組 為(96.67±2.23)%、miR-181b inhibitor+NDRG2-WT組為(133.59±4.48)%、miR-181 binhibitor+NDRG2-MUT 組為(97.13±1.0)%。各組相對熒光強度比較,經方差分析,差異有統計學意義(F=46.325,P=0.000)。見圖1。

圖1 miR-181b與NDRG2靶基因結合位點示意圖
熒光素酶報告基因實驗檢測發現,miR-181b模擬物可以明顯抑制NDRG2WT-luc 的3'-端非翻譯區的表達,但對NDRG2-MUT 組和Control 組無明顯影響;miR-181b inhibitor 可以加強NDRG2WT-luc 的3'-端非翻譯區的表達,但對NDRG2-MUT 組和Control 組無明顯影響。說明miR-181b 可以通過與NDRG2 的3'-端非翻譯區結合來調控NDRG2 的表達。
2.2 NDRG2對胰島素分泌的影響
過表達組與過表達對照組NDRG2 mRNA 和蛋白相對表達量比較,經t檢驗,差異有統計學意義(P<0.05),過表達組均高于過表達對照組。在5 mmol/L 葡萄糖條件下,過表達組與過表達對照組胰島素分泌量比較,差異無統計學意義(P>0.05)。在20 mmol/L 葡萄糖條件下,過表達組與過表達對照組胰島素分泌量比較,差異有統計學意義(P<0.05),過表達對照組高于過表達組。見表1 和圖2。
表1 過表達組與過表達對照組NDRG2 mRNA和蛋白相對表達量、胰島素分泌量比較()
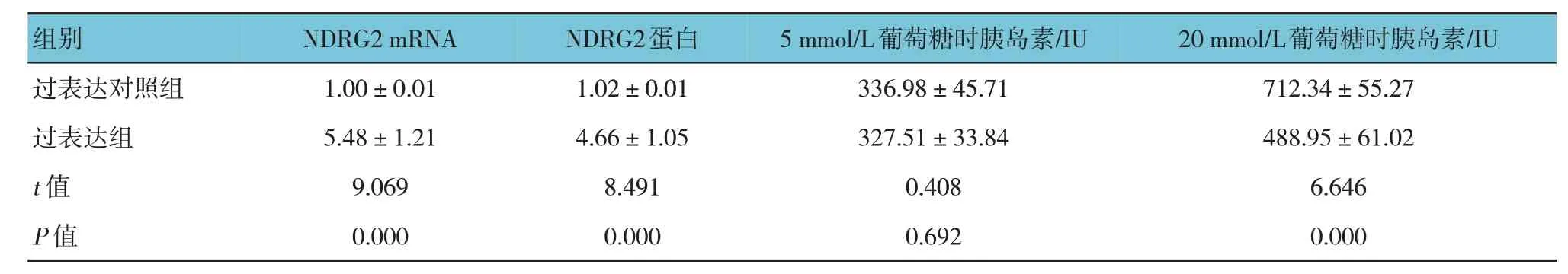
表1 過表達組與過表達對照組NDRG2 mRNA和蛋白相對表達量、胰島素分泌量比較()
敲低組與敲低對照組NDRG2 mRNA 和蛋白相對表達量比較,經t檢驗,差異有統計學意義(P<0.05),敲低組均低于敲低對照組。在5 mmol/L 葡萄糖條件下,敲低組與敲低對照組胰島素分泌量比較,差異無統計學意義(P>0.05)。在20 mmol/L 葡萄糖條件下,敲低組與敲低對照組胰島素分泌量比較,差異有統計學意義(P<0.05),敲低組高于敲低對照組。見表2 和圖2。
表2 敲低組與敲低對照組NDRG2 mRNA和蛋白相對表達量、胰島素分泌量比較()
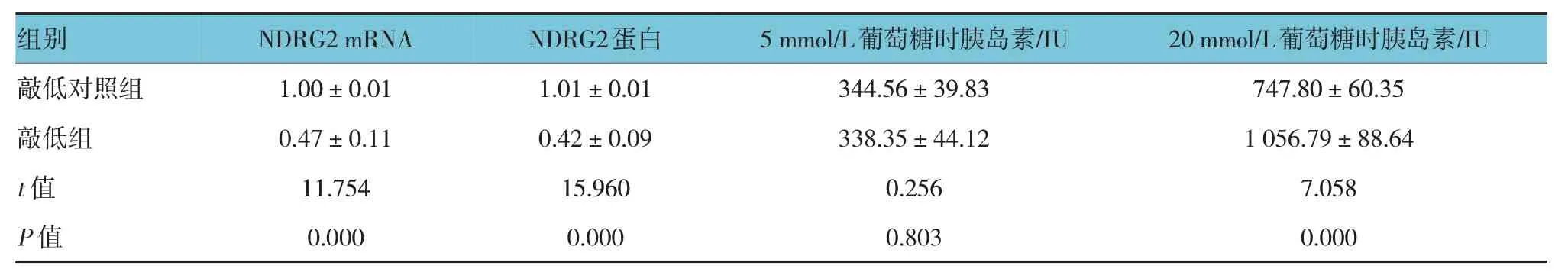
表2 敲低組與敲低對照組NDRG2 mRNA和蛋白相對表達量、胰島素分泌量比較()
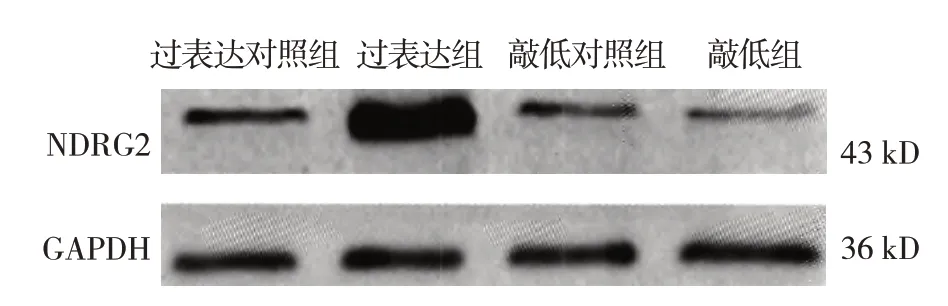
圖2 NDRG2蛋白的表達
2.3 高糖刺激對小鼠胰島β細胞內源性miR-181b和NDRG2 mRNA表達的影響
5 mmol/L 葡萄糖組、20 mmol/L 葡萄糖組及對照組小鼠胰島β 細胞內源性miR-181b 和NDRG2 mRNA 相對表達量比較,經方差分析,差異有統計學意義(P<0.05)。進一步兩兩比較結果:5 mmol/L葡萄糖組與對照組的miR-181b 和NDRG2 mRNA 相對表達量比較,差異無統計學意義(P>0.05);20 mmol/L 葡萄糖組miR-181b 相對表達量高于對照組和5 mmol/L 葡萄糖組(P<0.05),NDRG2 mRNA 相對表達量低于對照組和5 mmol/L 葡萄糖組(P<0.05)。見表3。
表3 3組小鼠胰島β細胞內源性miR-181b和NDRG2 mRNA相對表達量比較()

表3 3組小鼠胰島β細胞內源性miR-181b和NDRG2 mRNA相對表達量比較()
注:?與5 mmol/L葡萄糖組和對照組比較,P <0.05。
2.4 miR-181b對胰島素分泌的影響
5 mmol/L葡萄糖條件下,Control 組、miR-181b mimics 組、miR-181b inhibitor 組胰島素分泌量比較,經方差分析,差異無統計學意義(P>0.05)。在20 mmol/L 葡萄糖條件下,3 組胰島素分泌量比較,經方差分析,差異有統計學意義(P<0.05)。進一步兩兩比較結果:miR-181b mimics 組高于Control 組(P<0.05),miR-1b1 inhibitor 組低于Control組和miR-181b mimics 組(P<0.05)。見表4。
表4 不同濃度葡萄糖條件下各組胰島素分泌量比較(IU,)
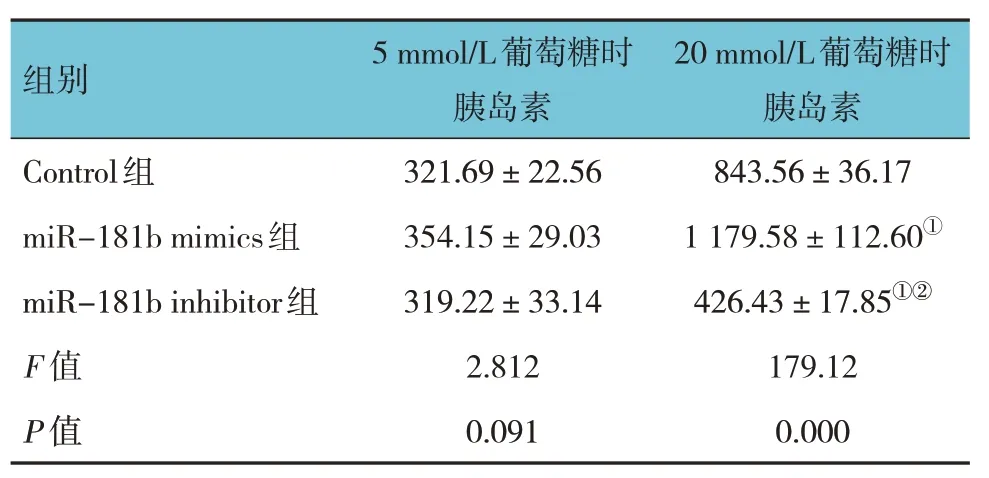
表4 不同濃度葡萄糖條件下各組胰島素分泌量比較(IU,)
注:①與Control 組比較,P <0.05;②與miR-181b mimics 組比較,P <0.05。
3 討論
T2DM 占總的糖尿病人群的90%以上,是主要的糖尿病類型,也是僅次于心血管疾病和惡性腫瘤的嚴重危害人類健康的慢性疾病,該病由基因和環境等多種因素導致,主要特征是胰島素相對或絕對不足導致高血糖狀態,胰島β 細胞分泌胰島素功能障礙導致骨骼肌、肝臟、脂肪等組織發生胰島素抵抗是T2DM 發病的主要原因。胰島素是由胰島β 細胞分泌的特異性激素,可以通過與肌肉、肝臟和脂肪等組織上的特異性受體結合,來調節葡萄糖代謝,維持血液葡萄糖穩定狀態。胰島素的分泌不僅受胰島素基因的調控,而且受外源性營養物質和內源性因子的影響。隨著分子生物學的飛躍發展,近年來研究發現糖尿病患者miRNA 譜表達異常[7],miRNA 異常表達可能與胰島β 細胞功能障礙、T2DM病情進展關系密切。
miRNA 是一類短鏈的非編碼RNA,可以通過與其他靶基因的3'-非編碼區結合,來調控其他RNA的轉錄和翻譯。有研究表明,miR-181b 在肥胖小鼠中低表達,外源性注射miR-181b 后其胰島素敏感性提高[8]。COPIER等[9]報道外周循環miR-181b 是糖尿病心肌病的生物標志物,可能是研究T2DM 的新靶點。本研究前期預實驗發現NDRG2 上可能存在miR-181b 的靶向結合位點,且兩者都與胰島素抵抗關系密切,故本研究以小鼠胰島β 細胞株為研究對象,觀察miR-181b 是否能夠通過靶向調控NDRG2參與T2DM 的發生、發展。熒光素酶報告基因實驗檢測結果發現,miR-181b mimics 和inhibitor 可以顯著影響野生型NDRG2WT-luc 的3'-端非翻譯區表達,但對突變型NDRG2MUT-1uc 和陰性對照無明顯影響,提示miR-181b 可以通過與NDRG2 的3'-端非翻譯區結合來調控NDRG2 的表達。高楠等[10]在胃癌細胞的培養過程中同樣發現miR-181b 能與NDRG2 的3'-UTR 結合,提示miR-181b 可以與NDRG2 的3'-UTR結合。
小鼠胰島β 細胞的胰島素分泌功能與人體胰腺有高度相似性,是研究胰島素分泌和糖尿病的理想細胞株之一。LI等[11]在腎癌細胞中發現,提高miR-181b 表達能抑制包括NDRG2 在內的多種基因表達。高楠等[10]在胃癌細胞中通過熒光素酶報告基因分析發現NDRG2 為miR-181b 的下游靶基因,提出通過抑制miR-181b 的表達來抑制NDRG2,進一步干擾細胞侵襲作用。NDRG2 屬于NDRG 家族一員,位于染色體14q11.1,其在進化上非常保守,提示該基因在人類生命過程中具有重要作用。NDRG2 高表達于人體骨骼肌中,不僅參與腫瘤、氧化應激、細胞分化、增殖、凋亡等眾多生理活動[12],而且可能通過蛋白激酶Akt 磷酸化調節胰島素分泌[12]。有學者通過Western blotting 檢測糖尿病小鼠胰島和骨骼肌NDRG2,發現胰腺NDRG2 表達增強[14]。本研究通過過表達和敲低NDRG2基因來驗證NDRG2 是否能直接影響胰島素分泌,結果發現在20 mmol/L 高糖刺激下,過表達組胰島素分泌量顯著降低,而敲低組則顯著升高,提示NDRG2 對胰島素分泌具有抑制作用。為了進一步探討miR-181b 對NDRG2 的靶向調控是否會影響小鼠胰島β 細胞分泌胰島素,本研究進一步檢測了胰島素分泌量,結果發現在20 mmol/L 葡萄糖刺激下,小鼠胰島β 細胞內源性miR-181b 相對表達量顯著升高,NDRG2 mRNA 相對表達量顯著降低,但是在5 mmol/L 葡萄糖刺激下無顯著變化,說明高糖刺激會影響小鼠胰島β 細胞內源性miR-181b 和NDRG2 mRNA 表達變化,這2 個基因可能直接參與胰島素分泌的調控。進一步添加miR-181b mimics 和 miR-181b inhinitor 并給予20 mmol/L 葡萄糖刺激后發現,miR-181b mimics 能顯著提高NDGR2 表達,同時胰島素分泌量顯著升高,而miR-181b inhibitor 能顯著下調NDGR2 表達,且胰島素分泌量隨之下降。這為miR-181b 能通過靶向調控NDRG2 介導胰島素分泌,并參與T2DM 的發病過程提供了直接證據。
綜上所述,miR-181b 不影響小鼠胰島β 細胞增殖,但可以通過靶向抑制NDRG2 的表達來提高胰島素分泌,可以為T2DM 的發病機制研究和治療提供新思路。

