hsa_circ_0000734吸附miR-16-5p抑制類風濕關節炎滑膜成纖維細胞的生長和遷移
彭子輝 王解 張正森 李晶晶
類風濕關節炎(rheumatoid arthritis,RA)是最常見的慢性自身免疫性疾病,其特征是滑膜組織炎癥、關節軟骨破壞和關節畸形,其確切原因尚不完全清楚[1]。滑膜成纖維細胞在軟骨破壞中起重要作用,越來越多的證據表明,活化的滑膜成纖維細胞可以表現出與腫瘤樣細胞相似的特性,例如過度增殖和遷移以及凋亡不足[2,3]。滑膜成纖維細胞不受控制的生長和遷移被認為是RA形成的原因[4]。因此,有效抑制滑膜成纖維細胞的增殖和遷移并促進細胞凋亡有助于RA癥狀的改善。環狀RNA(circRNA)是一類新近鑒定的非編碼RNA分子,其特征是沒有自由5’端帽子或3’poly(A)尾部的非規范反向剪接。在過去的十年中,高通量測序與生物信息學分析相結合的發展導致circRNA研究的極速增長[5]。盡管大多數circRNA的生物學功能仍然未知,但逐漸明確的是,circRNA充當競爭性內源RNA(ceRNA)與miRNA結合在人類疾病中具有調控功能[6,7]。以往研究顯示,在RA患者的外周血單個核細胞中hsa_circ_0000734的表達明顯降低[8]。然而,hsa_circ_0000734在RA中的作用尚不清楚。因此,本研究旨在確定hsa_circ_0000734對RA滑膜成纖維細胞生長和遷移的影響及潛在機制,以期為RA的治療提供新的方向。
1 材料與方法
1.1 實驗細胞 RA滑膜成纖維細胞系MH7A(美國ATCC)。
1.2 主要試劑與儀器 RPMI 1640培養基和胎牛血清(美國Gibco公司,批號:10567014、10099141);Lipofectamine 3000轉染試劑(賽默飛世爾,批號:20200216);hsa_circ_0000734過表達質粒和pcDNA3.1空載體質粒、miR-16-5p mimics和mimics control(上海吉瑪);Transwell小室(美國Corning,批號:356234);CCK-8試劑盒、SDS-PAGE凝膠配制試劑盒(碧云天研究所,批號:C0037、P0012A);RNA提取試劑盒、逆轉錄試劑盒和實時熒光定量PCR試劑盒(北京索萊寶,批號:20191203、20200422);AnnexinV-FITC/PI細胞凋亡檢測試劑盒(日本TaKaRa,批號:RR526A);PCNA、Cleaved Caspase-3、MMP-2和MMP-9兔抗單克隆抗體(美國CST公司,批號:34452、12655、40994、13667);山羊抗兔二抗(美國Abcam,批號:ab1670);雙熒光素酶報告系統檢測試劑盒(上海翊圣生物科技,批號:20191012);BCA蛋白定量檢測試劑盒和ECL化學發光檢測試劑盒(賽默飛世爾,批號:20191208、20180519);HF160W型二氧化碳培養箱(上海力申科學儀器);FR-200A凝膠分析系統(上海普諾森生物);CFX96 Touch型實時熒光定量PCR儀(美國Bio-Rad)。
1.3 細胞培養、轉染與分組 MH7A細胞采用RPMI 1640培養基(含10%胎牛血清、100 U/ml青霉素和鏈霉素雙抗)進行培養,將細胞放置在常規培養箱中,培養條件設為5%CO2、37℃、飽和濕度。對數期的MH7A細胞接種到6孔板中,過夜培養,待細胞生長密度達60%左右時進行轉染,具體轉染步驟嚴格參照Lipofectamine 3000轉染試劑說明書,將轉染hsa_circ_0000734過表達質粒的MH7A細胞命名為hsa_circ_0000734組,轉染pcDNA3.1空載體質粒的MH7A細胞命名為NC組,未行轉染處理的MH7A細胞命名為Mock組。轉染48 h后收集各組MH7A細胞,進行相關指標檢測。
1.4 qRT-PCR檢測hsa_circ_0000734和miR-16-5p的表達 使用RNA提取試劑盒提取轉染48 h后各組MH7A細胞中的RNA,以RNA為模板,使用逆轉錄試劑盒合成cDNA,使用實時熒光定量PCR檢測試劑盒,以cDNA為模板行PCR檢測。以GAPDH作為內參,檢測hsa_circ_0000734的相對表達水平,以U6作為內參,檢測miR-16-5p的相對表達水平。以2-ΔΔCt法計算hsa_circ_0000734和miR-16-5p的表達水平。QRT-PCR引物序列如下:hsa_circ_0000734 F 5’-CAGCTGAAGCAGTTGGAGTG-3’;R 5’-GATAACGCGGCGGACTATT-3’。GAPDH F 5’-GGAGCGAGATCCCTCCAAAAT-3’;R 5’-GGCTGTTGTCATACTTCTCATGG-3’。miR-16-5p F 5’-TAGCAGCACGTAAATATTGGCG-3’;R 5’-TGCGTGTCGTGGAGGAGTC-3’。U6 F 5’-CTCGCTTCGGCAGCACA-3’;R 5’-AACGCTTCACGAATTTGCGT-3’。
1.5 CCK-8法檢測細胞增殖活力 分組處理48 h后各組MH7A細胞接種至96孔板中,每組設3個復孔,另設只含培養液不含細胞的調零孔,于37℃培養箱過夜培養,除去培養液,向每孔細胞中加入CCK-8溶液10 μl,孵育2 h,使用酶標儀測定細胞的吸光度(A)值,波長設為490 nm,計算細胞存活率,細胞存活率(%)=[(實驗孔A值-調零孔A值)/(對照孔A值-調零孔A值)]×100%。
1.6 Annexin V-FITC/PI雙染色法檢測細胞凋亡水平 MH7A細胞轉染48 h后,以胰酶消化收集細胞6×105個細胞,使用預冷的PBS洗滌細胞3次,加入200 μl結合緩沖液重懸細胞,取100 μl細胞懸液,添加5 μl Annexin V-FITC和5 μl PI染液,混勻,避光反應15 min,添加400 μl細胞懸液,上流式細胞儀檢測細胞凋亡情況,采用Cell Quest軟件分析各組MH7A細胞凋亡率。
1.7 Transwell檢測 各組MH7A細胞轉染48 h后,加入胰酶進行消化,收集并計數約5×104個細胞,使用200 μl不含血清的培養液重懸細胞,將細胞懸液加到Transwell小室的上室,并于下室添加500 μl含10%胎牛血清的培養液,放置在5%CO2、37℃培養箱,繼續孵育24 h。PBS洗滌3次,添加4%多聚甲醛固定30 min,用棉簽擦去未穿膜的細胞,結晶紫染色,洗滌后晾干,顯微鏡觀察并統計穿過基底膜的細胞數,以穿膜細胞數的多少反映細胞遷移能力的大小。
1.8 Western blot檢測 轉染48 h后各組MH7A細胞采用RIPA裂解液裂解,抽提總蛋白,以BCA法測定蛋白濃度,將蛋白與上樣緩沖液混合,沸水浴致蛋白變性,取30 μg蛋白行SDS-PAGE電泳,電泳結束后轉移到PVDF膜上,隨后在封閉液中封阻2 h。洗膜后加入相應稀釋的單抗(PCNA 1∶800稀釋,Cleaved Caspase-3、MMP-2和MMP-9 1∶500稀釋),4℃孵育15 h,洗膜,再加入二抗(1∶3 000稀釋),孵育2 h,采用ECL顯色液,采用凝膠成像系統獲取圖像,GAPDH標定,以Imag J軟件分析各條帶灰度值,計算PCNA、Cleaved Caspase-3、MMP-2和MMP-9的相對表達水平。
1.9 雙熒光素酶報告基因實驗 根據生物信息學預測結果,擴增miR-16-5p結合位點的hsa_circ_0000734野生型(hsa_circ_0000734-Wt)和突變型(hsa_circ_0000734-Mut)熒光素酶報告載體,使用Lipofectamine 3000轉染試劑將重組載體質粒分別與miR-16-5p mimics或mimics control共轉染MH7A細胞,繼續培養48 h,分別收集各組細胞,使用雙熒光素酶報告系統檢測分析海腎熒光素酶活性和螢火蟲熒光素酶活性,計算MH7A細胞的相對熒光素酶活性。
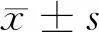
2 結果
2.1 hsa_circ_0000734和miR-16-5p在3組MH7A細胞中的表達 與Mock組和NC組比較,hsa_circ_0000734組細胞中hsa_circ_0000734的表達水平明顯升高(P<0.05),miR-16-5p的表達水平明顯降低(P<0.05);Mock組和NC組比較差異無統計學意義(P>0.05)。見表1。

表1 hsa_circ_0000734和miR-16-5p在3組細胞中的表達水平比較
2.2 過表達hsa_circ_0000734對MH7A細胞增殖能力的影響 與Mock組和NC組比較,hsa_circ_0000734組細胞增殖活力和PCNA的表達水平均明顯降低(P<0.05);Mock組和NC組比較差異均無統計學意義(P>0.05)。見圖1,表2。

圖1 Western blot檢測PCNA的表達水平

表2 3組MH7A細胞增殖活力和PCNA表達水平比較
2.3 過表達hsa_circ_0000734對MH7A細胞凋亡的影響 與Mock組和NC組比較,hsa_circ_0000734組細胞凋亡率和Cleaved Caspase-3的表達水平均明顯升高(P<0.05);Mock組和NC組比較差異均無統計學意義(P>0.05)。見表3,圖2。

表3 3組MH7A細胞凋亡率和Cleaved Caspase-3表達水平比較

圖2 過表達hsa_circ_0000734對MH7A細胞凋亡的影響;A Western blot檢測Cleaved Caspase-3的表達;B AnnexinV-FITC/PI雙染色法檢測MH7A細胞凋亡率
2.4 過表達hsa_circ_0000734對MH7A細胞遷移能力的影響 與Mock組和NC組比較,hsa_circ_0000734組遷移細胞數明顯減少,MMP-2和MMP-9的表達水平明顯降低,差異有統計學意義(P<0.05);Mock組和NC組比較差異無統計學意義(P>0.05)。見表4,圖3。

表4 3組遷移細胞數、MMP-2和MMP-9表達水平比較

圖3 過表達hsa_circ_0000734對MH7A細胞遷移能力的影響;A Western blot檢測各組MH7A細胞中MMP-2和MMP-9的表達;B Transwell遷移實驗檢測3組MH7A細胞遷移能力(結晶紫染色×100)
2.5 hsa_circ_0000734和miR-16-5p靶向關系驗證 生物信息學和雙熒光素酶報告基因實驗分析hsa_circ_0000734和miR-16-5p的靶向結合關系,在線數據庫Starbase預測發現,hsa_circ_0000734和miR-16-5p之間存在特異性結合位點。隨后雙熒光素酶報告基因實驗結果顯示,與miR-NC組比較,miR-16-5p組hsa_circ_0000734-Wt細胞的相對熒光素酶活性明顯降低(P<0.05),而hsa_circ_0000734-Mut細胞的相對熒光素酶活性變化差異無統計學意義(P>0.05)。見圖4,表5。

圖4 Starbase預測hsa_circ_0000734和miR-16-5p結合位點示意圖

表5 3組MH7A細胞的相對熒光素酶活性比較
2.6 過表達miR-16-5p對MH7A細胞增殖、凋亡和遷移能力的影響 采用共轉染同時過表達miR-16-5p和hsa_circ_0000734,與hsa_circ_0000734組比較,miR-16-5p+hsa_circ_0000734組MH7A細胞中miR-16-5p的表達和細胞增殖活力明顯升高,遷移細胞數明顯增加,細胞凋亡率明顯降低,差異均有統計學意義(P<0.05)。見表6。

表6 2組細胞miR-16-5p的表達、增殖活力、凋亡和遷移能力比較
3 討論
RA是一種病因不明的全身性自身免疫性疾病,其可導致關節損傷、殘疾。以往研究表明,位于滑膜內膜邊緣的成纖維樣滑膜細胞在RA的病理生理過程中起關鍵作用[9]。據報道,滑膜成纖維細胞與腫瘤細胞具有相似的特性,例如,它們可以經歷腫瘤樣增殖、侵襲、遷移和抗凋亡[10]。滑膜成纖維細胞可以遷移到未受影響的關節,附著在軟骨和骨上,并侵入細胞外基質。因此,滑膜成纖維細胞無疑是關節炎破壞向遠關節擴散的重要因素[11]。抑制滑膜成纖維細胞的增殖和遷移能夠抑制RA的發展。MH7A是滑膜成纖維細胞的一種,常用于RA發病機制的研究[12,13]。因此,本研究選擇了MH7A細胞作為材料。
在過去的幾十年里,人們對RA的分子機制進行了大量的探索,然而,以往的研究大多集中在編碼蛋白質的基因上。近年來的證據表明,盡管非編碼RNA不直接編碼蛋白質,但它們在蛋白質編碼基因的轉錄和翻譯中起著調節作用[14,15]。越來越多的證據表明,circRNA廣泛參與各種生理和病理過程,包括許多疾病的發生和發展,包括腫瘤和自身免疫性疾病等[16]。circRNA是真核生物中豐富的保守內源生物分子,具有組織特異性和細胞特異性表達模式。環狀RNA水平的調節可導致多種分子和生理變異,研究人員在RA方面開展了一些工作,例如識別新的生物標志物或探索特定circRNA的功能[17]。然而,關于RA中circRNA的機制的細節仍不清楚。最近的一些研究表明,外周血單個核細胞中的hsa_circ_0001200、hsa_circ_0001566、hsa_circ_0003972和hsa_circ_0008360等參與了RA的發病機制,可以通過微陣列分析作為RA的潛在生物標志物,并且hsa_circ_0000734的表達明顯下調[8]。然而,hsa_circ_0000734在RA中的作用尚不清楚。本研究發現,過表達hsa_circ_0000734能夠明顯抑制MH7A細胞增殖活力和遷移細胞數,并且提高細胞凋亡率。此外,過表達hsa_circ_0000734的MH7A細胞中與增殖相關蛋白PCNA的表達明顯降低,與凋亡相關蛋白Cleaved Caspase-3的表達明顯升高。同時,滑膜成纖維細胞還可以自發分泌大量基質金屬蛋白酶(包括MMP-2和MMP-9),在關節軟骨的進行性破壞中發揮重要作用[18]。本實驗結果顯示,過表達hsa_circ_0000734的MH7A細胞中MMP-2和MMP-9的表達明顯降低。以上結果提示,過表達hsa_circ_0000734能夠有效抑制MH7A細胞的增殖和遷移,并誘導細胞凋亡。
眾所周知,circRNA通過多種機制發揮重要的生物學作用,包括染色質修飾、剪接等。此外,越來越多的證據表明,circRNA可能通過共表達網絡在RA中發揮重要的調控作用[19]。越來越多的證據表明,miRNA在RA發病機制中起重要作用[20]。例如,miR-152通過靶向ADAM10抑制RA滑膜成纖維細胞增殖并誘導細胞凋亡[21]。miR-338-5p通過靶向ADAMTS-9抑制RA滑膜成纖維細胞增殖和侵襲[22]。RA患者血清miR-16-5p水平高于健康對照組,提示miR-16-5p不僅可以作為RA的生物標志物,而且可以為RA的病理生理學研究提供更多的線索[23]。本實驗前期通過生物信息學預測發現,hsa_circ_0000734和miR-16-5p存在靶向結合位點,提示二者可能存在靶向關系,后續實驗證實hsa_circ_0000734能夠靶向調控miR-16-5p的表達。因此,本研究構建了一個circRNA-miRNA調控網絡來探究circRNA在RA中的作用機制。本實驗結果還發現,miR-16-5p模擬物可以拯救hsa_circ_0000734的促進功能。從機制上講,hsa_circ_0000734通過充當miR-16-5p的海綿來促進滑膜成纖維細胞的增殖和遷移。這些結果表明,hsa_circ_0000734可能是RA進程中的關鍵circRNA。

