牛呼吸道疾病病原BVDV、IBRV、BPIV3和牛支原體的分離鑒定
吳志強,石悅萌,寇曌婷,王 鑫,黃素文,段躍強
(內蒙古華希生物科技有限公司,內蒙古 呼和浩特 010111)
近幾年,畜牧業發展進入新階段,牛繁育規模化程度顯著提高,加上牛不斷被調入轉出,牛病也更加復雜化。牛病流行原因在于多種病毒、細菌混合感染。呼吸道疾病綜合征(bovine respiratory disease complex,BRDC)是全球對養牛業損害最嚴重的疾病之一。該病的病原多數為牛病毒性腹瀉病毒(BVDV)、牛傳染性鼻氣管炎病毒(IBRV)及牛副流感3型病毒(BPIV3)等。除此之外,牛支原體(Mycoplasma bovis)也可以引起牛呼吸道感染。
BVDV可感染多種偶蹄目動物,如豬、牛等[1]。BVDV感染牛后可出現流產、腹瀉等癥狀和呼吸道相關疾病[2]。在歐洲,奶牛BVDV陽性抗體超過50%[3-4]。我國大多數省份都存在較高的發病率[1]。IBRV呈世界性流行,其主要臨床表現為呼吸困難、多量黏液性鼻漏、陰道炎、高熱、乳房炎和母畜流產等[5-7]。在全國范圍內對IBRV進行流行病學調查發現,我國奶牛平均陽性率為35.8%,個別省份為70%[8]。BPIV在自然狀態下只感染牛,且多見于集約化飼養的奶牛和肉牛[9]。BPIV3單一感染時不會引起嚴重的臨床癥狀,只是引起輕微的呼吸道癥狀,但是病牛如果混合感染或繼發感染IBRV、牛支原體等則會使病情急劇惡化。牛支原體能夠引起關節炎、犢牛肺炎及乳房炎等疾病,統稱為牛支原體相關疾病,并可協同其他病原體導致病情加重[10]。2008年,我國大規模暴發了牛支原體肺炎,發病率高于50%,病死率也在20%左右[11]。
本試驗通過從內蒙古自治區、山西省某肉牛場采集的疑似感染呼吸道疾病牛的血液、鼻拭子中分離得到BVDV、IBRV、BPIV3和牛支原體病原,并對其進行全面系統的鑒定,為研制牛呼吸道疾病綜合征疫苗提供數據支持。
1 材料與方法
1.1 試劑
病毒基因組DNA/RNA提取試劑盒,購于天根生化科技(北京)有限公司;cDNA反轉錄試劑盒,購于全式金;DMEM培養基,購于Gibco公司;其他試劑為常見試劑。
1.2 病料采集
內蒙古自治區、山西省某規模化牛場送檢感染呼吸道疾病的15份血液和32份鼻拭子樣本。
1.3 細胞
MDBK細胞,由本項目組制備并保存。
1.4 BVDV的分離鑒定
1.4.1 病毒分離與培養。將送檢的疑似BVDV血液樣本于37℃靜置1 h,4℃、5 000 r/min離心15 min分離血清,標上序號和采樣日期。待MDBK傳代細胞長成單層后,用PBS(0.01 mol/L,pH值為7.2)清洗1次,將牛血清樣品接種于MDBK細胞,每個樣品接種4孔,另設2孔作為陰性對照。每孔0.5 mL,在37℃培養箱內吸附1 h后棄上清液,用PBS清洗后加2 mL含2%胎牛血清的DMEM細胞維持液,置37℃、含5% CO2培養箱中培養,每日鏡檢觀察細胞病變(CPE),5 d 后收獲培養液。
1.4.2 BVDV的RT-PCR鑒定。依據BVDV標準毒株公開基因序列,在其最保守的5′端非編碼區序列設計合成1對特異性引物,引物序列見表1。提取病毒cDNA進行RT-PCR鑒定,PCR產物于1%瓊脂糖凝膠電泳檢測。

表1 BVDV引物序列
1.4.3 免疫熒光試驗。將病毒液接種于長滿單層的MDBK細胞,并設正常細胞對照和Oregon C24V病毒陽性對照,置37℃、含5% CO2培養箱中過夜,棄培養液,用PBS(0.01 mol/L,pH值為7.2)清洗 3次后,用80%丙酮和20%甲醇混合液-20℃固定30 min。PBS清洗后,分別加入工作濃度熒光標記的BVDV單克隆抗體0.1 mL,在37℃濕盒中作用40 min,PBS清洗后每孔再加50 μL PBS,置熒光顯微鏡下觀察。
1.5 IBRV的分離鑒定
1.5.1 病毒分離與培養。送檢的疑似感染IBRV的牛鼻拭子液經凍融3次后將棉簽擰干取出,4℃2 000 r/min 離心 10 min,取上清液,用 0.22 μm微孔濾膜過濾后,接種于24孔單層MDBK細胞的培養板,每孔接種0.5 mL,設細胞陰性孔,37℃吸附1 h。吸掉孔內液體,PBS清洗2~3次,加入1 mL含2%胎牛血清的DMEM細胞培養液,置37℃、含5% CO2培養箱中培養4日,收獲出現細胞病變的培養液并傳代。
1.5.2 IBRV的PCR鑒定。根據GenBank參考序列,利用Primer 5.0軟件設計針對gB基因的引物,引物序列見表2。提取病毒液DNA,進行PCR擴增,PCR產物用1%瓊脂糖凝膠電泳檢測。
表2 IBRV gB基因擴增引物序列引物名稱
1.5.3 病毒形態觀察。取第3代分離毒株細胞培養物送軍事醫學科學院微生物流行病研究所進行負染制樣,在透射電鏡下觀察病毒形態。
1.6 BPIV3的分離鑒定
1.6.1 病毒分離與培養。將疑似感染BPIV3的牛的鼻拭子液凍融3次后,按照1.5.1方法進行,收獲出現細胞病變的培養液并傳代。
1.6.2 BPIV3的RT-PCR鑒定。參考GenBank中登錄的BPIV3船運熱毒株全基因組序列(AF178655),設計并合成1對特異性引物進行RT-PCR擴增,于1%瓊脂糖凝膠電泳檢測,應擴增出425 bp目的片段。引物序列見表3。

表3 BPIV3引物序列
1.6.3 病毒形態觀察。取分離毒株細胞培養物送軍事醫學科學院微生物流行病研究所進行負染制樣,在透射電鏡下觀察病毒形態。
1.7 牛支原體的分離鑒定
1.7.1 分離與培養。將鼻拭子接種于Hayflick液體培養基,置于37℃恒溫培養箱中培養,當培養基顏色由紅色變為黃色時,將濾液接種到固體培養基內培養傳代,置于37℃培養4~5 d,觀察固體培養基上有無菌落生長,進行吉姆薩染色、Dienes染色,并觀察菌體形態。
1.7.2 PCR鑒定。提取純化得到的培養液菌液DNA進行PCR鑒定,擴增產物于1%瓊脂糖凝膠電泳檢測,引物序列見表4。

表4 牛支原體引物序列
1.7.3 生化鑒定。取分離菌株分別進行生化鑒定。鑒定項目包括:紅細胞吸附試驗、分解葡萄糖試驗、分解麥芽糖試驗、分解尿素試驗、分解精氨酸試驗、氯化四氮唑還原試驗、膽固醇需要試驗、亞甲藍著色試驗和溶血試驗。
2 結果與分析
2.1 BVDV分離鑒定
2.1.1 細胞試驗。經MDBK細胞盲傳至第2代,樣品接種后第2天可見有少量細胞聚堆的細胞病變(CPE),至第3天主要表現為細胞聚堆、拉網等。對照組細胞正常(圖1)。

圖1 樣品感染MDBK細胞產生的細胞病變(10×)
2.1.2 PCR試驗。經RT-PCR擴增可得到約288 bp的特異性目的片段,陰性對照無條帶(圖2)。
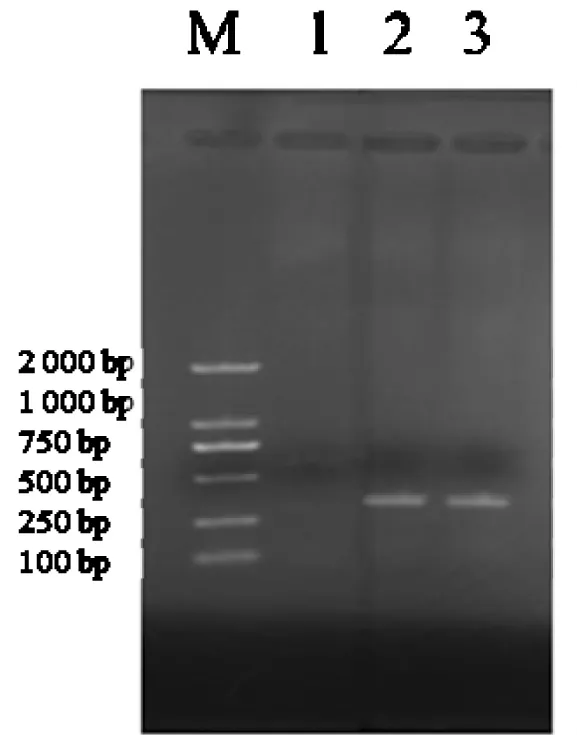
圖2 BVDV PCR擴增結果
2.1.3 免疫熒光試驗。在熒光顯微鏡下,將病毒液接種于MDBK細胞,加入BVDV特異性熒光抗體可見特異熒光。對照組細胞無可見熒光(圖3)。
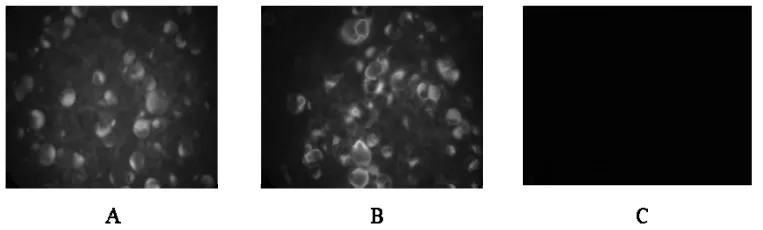
圖3 免疫熒光檢測
2.2 IBRV分離鑒定
2.2.1 病毒分離。將無菌處理后的鼻拭子液接種于MDBK細胞,第1代即出現細胞病變(CPE),表現為細胞圓縮、拉網、聚集成葡萄串樣。隨著培養時間的延長,細胞脫落、死亡。而對照孔無細胞病變(圖4)。

圖4 接種病料后的MDBK細胞(10×)
2.2.2 PCR試驗。經PCR反應,可擴增出一條大小為311 bp的特異性條帶,該條帶與預期片段大小相符合,如圖5所示。

圖5 IBRV PCR擴增結果
2.2.3 病毒形態。電鏡下觀察可見散在典型病毒顆粒及裸露的病毒粒子,見圖6。表面殼微體排列有序并呈放射狀,囊膜厚薄不勻稱,形態大小不一,且呈波浪狀,具有皰疹病毒獨有的形態特征即囊膜與衣殼間有一層不定形的物質。

圖6 分離毒株電鏡負染形態學觀察
2.3 BPIV3分離鑒定
2.3.1 病毒分離。將無菌處理后的鼻拭子液接種于MDBK細胞,第1代即出現細胞病變(CPE),表現為細胞圓縮、補丁狀病變。隨著培養時間的延長,細胞崩解,培養液中有大量細胞碎片,為牛副流感病毒3型特征性CPE。而對照孔無細胞病變,見圖7。

圖7 接種病料后的MDBK細胞(10×)
2.3.2 PCR試驗。經PCR反應,可擴增出一條大小為425 bp的特異性條帶,該條帶與預期片段大小相符合。陰性對照未擴增出目的片段,如圖8所示。

圖8 BPIV3 PCR擴增結果
2.3.3 病毒形態。對分離毒株進行電鏡觀察,結果觀察到有包膜的病毒離子,大小約為200 nm,與副黏病毒相符,結果見圖9。

圖9 分離毒株電鏡負染形態學觀察
2.4 牛支原體分離鑒定
2.4.1 形態特性。體視顯微鏡下觀察可見典型的“煎蛋狀”菌落,菌落中間厚且聚集、周邊為表面光滑的薄透明顆粒區,邊緣整齊,呈圓形,嵌入培養基中生長,可見β-溶血環(圖10A);采用吉姆薩染色法對菌株進行染色,100倍油鏡下觀察菌體形態,可見紫色球形顆粒,而且呈多種形態;采用Dienes染色法對菌株進行染色,顯微鏡下觀察菌體形態,牛支原體呈藍色,見圖10。

圖10 分離株形態特征
2.4.2 牛支原體PCR的鑒定。由圖11可見,在447 bp處出現了目的條帶,該條帶與預期片段大小相符合。陰性對照未擴增出目的片段。

圖11 牛支原體PCR結果
2.4.3 生化特征。鑒定結果見表5。由表5可見,分離菌株與牛支原體模式株PG45生化指標一致,分離株生化特性符合牛支原體的特性。

表5 分離牛支原體菌株的生化特征
3 結論
從內蒙古自治區、山西省某肉牛場分離得到BVDV、IBRV、BPIV3和牛支原體病原,經對其進行全面系統的鑒定,均符合質量要求。為了方便后續研究,筆者將其命名為 BVDV(HH03株)、IBRV(TY01株)、BPIV3(LH01 株)和牛支原體(CHF01 株)。
4 討論
BRDC俗稱運輸熱,是由于病原與自然界、動物相互作用導致的一種牛呼吸道疾病。BRDC嚴重威脅著牛群的健康,每年造成的經濟損失不可估量。近年來,隨著我國養牛規模的擴大和牛在不同省區來回調運,母牛、種公牛以及胚胎、精液等遺傳物質的大量引進,使得一些疫病隨著動物貿易而傳入我國,造成疫病流行,BRDC就是其中之一[12]。運輸應激造成的BRDC不斷遞增,死亡率呈上升趨勢,給養牛業帶來嚴重的危害。BRDC主要由包括支原體、牛皰疹病毒Ⅰ型等一種或數種病原單獨或混合感染引起[13]。臨床出現牛肺炎及支氣管炎等癥狀,與應激、環境改變、牧場管理和疫苗免疫有關[14-15]。
近年來,隨著內蒙古自治區、山西省養殖業結構調整和養牛業不斷發展,奶牛和黃牛的養殖數量呈擴大趨勢,牛傳染性疾病也在不斷增加,對內蒙古自治區、山西省養牛業的健康發展造成巨大威脅。本次調查發現,該二省區牧場均發生過由多種病因混合感染引起的疾病,近年也有一些相關報道。例如,2013年童欽等[16]報道,內蒙古自治區3個地區 BVDV 血清陽性率為58.35%。2011年,鄒世穎等[17]調查IBRV的血清陽性率,河北省為28%、河南省為86%、內蒙古自治區為58%。2022年,姜曉霞等[12]報道,BVDV、BRSV、IBRV和BPIV感染引起的牛呼吸道疾病的臨床癥狀相似,且有多種病毒共同感染現象。隨著細菌對自然環境的適應能力逐漸增強,耐藥性已經變得很普遍,不僅會降低藥效,而且會導致耐藥因子轉移到人的病原菌中,給人類相關疾病帶來“無藥可治”的嚴重局面。因此,給分離得到的病原進行藥敏試驗,對指導臨床規范用藥、降低耐藥菌株產生和傳播速度具有深遠意義。該試驗病例由不同種病原混合感染所引起,因此制定合理的牛場免疫程序,按期進行疫苗接種非常關鍵。建議在牛呼吸道疾病高發期適當使用可提高牛機體抵抗力的藥物,以降低牛呼吸道疾病綜合征的發生率[18]。同時,控制牛呼吸道疾病綜合征需要良好的環境作為基礎保障,不僅需要溫度適宜,還要保持通風。
由于病毒和支原體是導致BRDC最重要的因素,因此用于防治病毒和支原體感染的疫苗對BRDC發揮了重要的作用。活疫苗或滅活疫苗都能夠減少因BRDC造成的臨床感染,降低經濟損失,有效避免牛場呼吸道疾病的發生,對養牛業的健康發展具有重要意義。

