雙能X線骨密度儀檢查及數字化X線攝影術用于骨搬移術后
王凱君,譚新歡,譚桂萍,林明強,楊文江
(1.山東省文登整骨醫院放射科,2.骨手顯微外科,山東 威海 264400)
骨搬移術是治療外傷引起感染性骨不連和大面積骨缺損的主要方法[1-2],術后動態監測搬移區新生骨痂至關重要。數字化X線攝影術(digital X-ray radiography, DR)可有效顯示新生骨痂形態變化,但無法顯示早期新生骨,常由影像科醫師靠其經驗估測骨痂量[3]。雙能X線骨密度儀(dual-energy X-ray absorptiometry, DEXA)能較DR更早檢測新生骨痂骨密度(bone mineral density, BMD)、定量新生骨痂,檢測截骨上下端原骨質BMD及患者全身BMD變化。本研究觀察骨搬移術后應用DEXA及DR的價值。
1 資料與方法
1.1 一般資料 選取2017年6月—2021年12月山東省文登整骨醫院19例因脛骨外傷致感染性骨不連及大面積骨缺損而接受脛骨骨搬移術患者,男15例、女4例,年齡28~64歲、平均(49.2±11.8)歲;左側病變12例、右側7例,脛骨上段15例、下段4例;病程13~34個月、平均(22.47±5.93)個月;搬移區長度50.79~96.67 mm,平均(70.24±14.06)mm。納入標準:①脛骨骨搬移術成功后接受DEXA及DR檢查,且資料完整;②脛骨搬移區5~10 cm。排除存在影響骨代謝全身器質性疾病及搬移過程中二次感染者。本研究經院倫理委員會批準(編號:2022-42),檢查前患者均簽署知情同意書。
1.2 儀器與方法 分別于脛骨骨搬移術后2、4、6、8周,停止搬移即刻、停止搬移后4周、8周,去外固定架前4周及去外固定架即刻行DEXA及DR檢查。根據患者病情確定停止搬移及去外固定架時間。
1.2.1 DEXA檢查 采用Norland XR-800 DEXA儀行患側脛骨、腰椎及左髖部掃描。囑患者仰臥,先對脛骨搬移術后脛骨搬移區行預掃描,在預掃描圖像上避開鋼釘設定測量掃描范圍,掃描速度為90 mm/s、分辨率為1 mm×1 mm;參考文獻[4]標準分別于測量掃描圖像上患側脛骨截骨上下原骨質端(記為R1、R2)及脛骨搬移區(記為R3)設置ROI(圖1)。之后分別掃描腰椎及左髖部,速度均為180 mm/s、分辨率均為1.5 mm×1.5 mm,獲得截骨上下端原骨質(BMD截骨上下端,取R1、R2平均值)、搬移區新生骨痂(BMD新生骨痂)、腰椎(BMD腰椎,取L1~4 BMD均值)及左髖部(BMD左髖)BMD,計算脛骨搬移區新生骨痂與截骨上下原骨質端的BMD比率,即(BMD新生骨痂/BMD截骨上下端)×100%。以上操作均由1名具有10年以上工作經驗的影像科主治醫師完成,記錄各時間點骨定量參數。

圖1 于脛骨DEXA測量掃描圖上設置R1、R2、R3的模擬圖
1.2.2 DR檢查 采用銳柯DR攝影系統(型號:VX3739-SYS)獲取患側脛骨正側位DR圖像。由具有10年及20年以上影像學診斷經驗的主治及主任醫師各1名共同閱片,分析脛骨搬移區新生骨痂形態及填充量,意見分歧時經協商達成一致。參考Lane-Sandhu[5]X線評定標準評估脛骨搬移區新生骨痂填充量:①無填充量,DR未見明顯骨痂影;②填充量達25%,DR見新生骨小梁呈細長條形及短片狀,分布較均勻,骨痂量占缺損區25%;③填充量達50%,新生骨小梁呈長片狀及條帶狀,骨皮質初顯,骨痂量占缺損區50%;④填充量達75%,新生骨小梁排列緊密,分布均勻,骨皮質形成,骨痂量占缺損區75%;⑤填充量達100%,新生骨密度明顯增高,上下端連接良好,骨皮質清晰,缺損區完全被新生骨痂填充。
1.3 統計學分析 采用SPSS 26.0統計分析軟件。以±s表示符合正態分布計量資料,采用重復測量方差分析比較各不同時間點、以LSD-t法比較術后各時間點與前一時間點參數的差異。P<0.05為差異有統計學意義。
2 結果
2.1 DEXA參數 脛骨搬移術后各時間點BMD新生骨痂、BMD截骨上下端及BMD比率總體差異均有統計學意義(P均<0.05)。術后2周始,BMD新生骨痂及BMD比率隨時間延長而升高(P均<0.05);BMD截骨上下端隨時間延長而降低,至去外固定架前4周最低(P均<0.05)、去外固定架即刻有所升高,但差異無統計學意義(P>0.05)。脛骨搬移術后各時間點BMD腰椎及BMD左髖總體差異均無統計學意義(P均>0.05)。見表1。
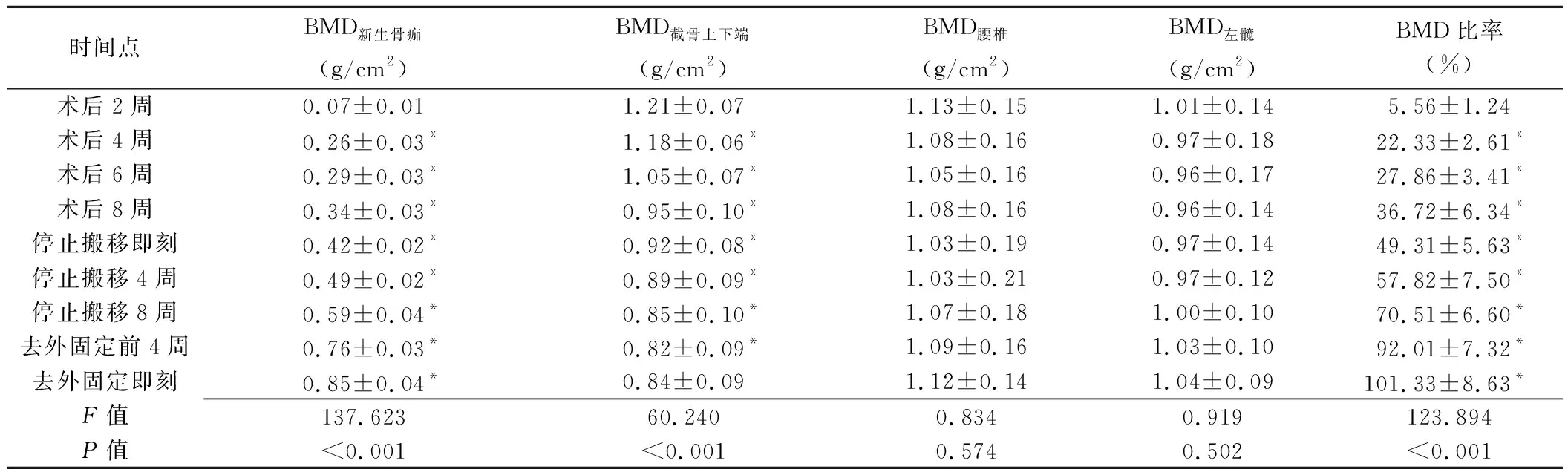
表1 19例脛骨搬移術后患者不同時間點骨定量參數比較
2.2 DR表現 DR于術后4周見脛骨搬移區新生骨痂呈云霧狀較淡密度影;術后6周見短條狀及點片狀高密度影;停止搬移即刻至停止搬移4周見骨小梁由模糊細長形逐漸變為條帶狀,截骨上下端骨痂逐漸連接;停止搬移8周見骨皮質形成,至去外固定架前4周新生骨礦化良好。術后2周脛骨搬移區未見新生骨痂填充,至停止搬移即刻及停止搬移4、8周新生骨填充量達25%、50%及75%,去外固定架前4周基本達100%。見圖2。
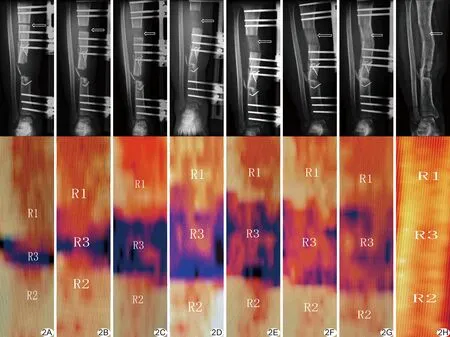
圖2 患者男,36歲,右脛骨下段感染性骨不連,清創后行脛骨上段骨搬移術 A~H.依次為術后2、4、6周、停止搬移即刻、4、8周、去外固定架前4周、去外固定架即刻右脛骨DR圖(上排)和DEXA測量掃描圖(下排),自停止搬移即刻至去外固定架前4周,搬移區新生骨痂填充量分別達25%、50%、75%及100%,BMD新生骨痂分別為0.05、0.25、0.31、0.44、0.49、0.61、0.77、0.89 g/cm2,BMD截骨上下端分別為1.25、1.19、1.07、0.88、0.86、0.85、0.83、0.86 g/cm2 (箭示右脛骨搬移區)
3 討論
DR是骨搬移術后監測新生骨痂的最常用方法,能顯示搬移區新生骨形態變化及畸形情況等,但無法檢測早期新生骨痂[6],僅在術后4周才能顯示新生骨痂[7]。搬移區新生骨痂、截骨端原骨質骨量丟失情況及二者BMD比率是判斷骨搬移術患者預后的重要指標。DEXA的原理是兩種不同能量X線穿過人體骨骼的衰減和吸收不同,經計算機處理得到骨骼礦物質含量,可排除周圍軟組織及金屬材料等的影響而更準確地監測骨組織BMD[8],且輻射劑量僅為5~10 μSv,掃描單個部位的輻射劑量僅為掃描同部位胸部DR攝片的1/30[9]。
本研究于不同時間點對19例脛骨搬移術后患者行DEXA檢查,動態監測其新生骨礦化情況;發現術后2周即能檢測到搬移區新生骨痂BMD,且BMD隨時間延長而增長,與既往研究[4,10]結果相符;BMD截骨上下端于去外固定前4周前呈下降改變,去外固定架即刻有所升高,但與前一時間點差異無統計學意義。截骨端原骨質BMD降低與術中損傷骨內血液循環及術后患肢活動受限所致失用性骨質疏松有關。BMD截骨上下端隨著搬移區新生骨痂不斷礦化、患肢血液循環重建及活動量增多而逐漸升高,但需要較長周期,且需患者按計劃進行功能鍛煉。活動量減低致失用性骨質疏松是外傷患者骨搬移術后骨量丟失的主要原因,但本研究發現術后各時間點全身BMD(BMD腰椎和BMD左髖)差異均無統計學意義,可能原因在于全身BMD變化需較長周期,而本組檢測全身BMD的周期較短,亦可能與患者術后積極進行全身鍛煉有關。
本組術后BMD比率隨時間延長而升高,與既往研究[4.10]結果一致。楊文江[11]以健側肢體相應部位為參考,采用DEXA檢測脛骨閉合性骨折愈合過程中骨痂的BMD比率。本研究發現,骨搬移術后搬移區新生骨重塑與骨折愈合存在差異,搬移區可隨肢體牽拉而逐漸延長,新生骨痂不斷增長,最終與截骨端緊密相連并形成一體,故以患肢BMD截骨上下端為其對照。搬移區新生骨痂BMD能否達到截骨端原骨質BMD水平是可否拆除外固定架的重要依據。胡新永[4]指出,以脛骨延長術治療先天性下肢縮短術后,BMD比率>120%為去除外固定架的最佳時機。本組去外固定即刻BMD比率為(101.33±8.63)%,或與手術方法、延長速度、樣本量及測量DEXA方法等不同有關。
DEXA及DR檢查各有優勢,二者聯合有助于評估骨搬移術后患者預后。通過DEXA精準定量新生骨痂可指導臨床制定治療方案和及時調整搬移速度:BMD增長較慢或降低提示需延緩搬移速度或以“手風琴”技術[12]刺激骨痂生成;BMD增高過快則應適當加快搬移速度,以防止過早愈合[13]。搬移后期監測BMD比率可指導臨床選擇拆除外固定架的最佳時機,且有助于動態監測鋼釘周圍骨質BMD的變化,以及時發現鋼釘松動;但DEXA 不能直觀顯示新生骨痂形態變化。DR空間分辨力高,有利于觀察新生骨痂形態,如骨小梁有無中斷、骨皮質是否連續、髓腔是否貫通及搬移區填充量等,且能測量搬移距離及顯示力線、金屬固定架情況。本組19例術后4周DR可見新生骨痂影,去外固定架前4周見新生骨礦化良好;停止搬移即刻搬移區新生骨填充量達25%,至去外固定架前4周基本達100%。
綜上所述,DEXA能動態監測骨搬移術后搬移區新生骨痂及截骨端原骨質BMD,DR可顯示新生骨痂形態變化;聯合應用二者有助于評估骨搬移術后患者預后。

