環境變化對水稻osfh1突變體成蛋白家族表達的影響
李 斌, 李明玉, 杜志燁, 汪開順, 肖 凱, 王 鑫, 石 楊, 姬紅麗, 陳 稷, 黃 進*
(1. 成都理工大學 生態環境學院, 成都 610059; 2.四川省農業科學院 植物保護研究所, 成都 610066; 3. 四川農業大學 農學院, 成都 611130 )
成蛋白(formin)是動植物細胞形態變化的關鍵調控因子(Shimada et al., 2004; Xu et al., 2004)。微生物和動物成蛋白的結構通常包括FH1(formin homology 1)、FH2(formin homology 2)、FH3(formin homology 3)、GBD(GTPase binding domain)、DID(diaphanous inhibitory domain)、DAD(diaphanous auto-regulatory domain)等(Janni et al., 1998; Peter & Magdalena, 2013)。其中,FH2蛋白結構域是成蛋白行使功能的關鍵結構域,也是確定蛋白是否為成蛋白的主要依據(Janni et al., 1998; Peter & Magdalena, 2013)。在動植物中的研究表明,成蛋白通過聚合肌動蛋白單體影響微絲微管、細胞骨架的動態調控,從而調控動細胞分裂以及細胞的極性生長(Shimada et al., 2004; Xu et al., 2004)。近年來的研究表明,當釀酒酵母Bnip1和Bud6基因共同突變時,酵母對高溫敏感;而當Bnip1單突變時,會降低酵母氮源利用率和對過氧化氫敏感性(Graziano et al., 2013; Juanes & Piatti, 2016)。這些結果表明成蛋白不僅參與細胞正常的生長發育以及其形態的變化,也有可能參與酵母抵抗外界環境脅迫。
成蛋白通過介導肌動蛋白調控細胞形態,如小立碗蘚Ⅱ類成蛋白突變后,細胞肌動蛋白結構以及細胞極性生長被破壞,導致其無法伸長生長(Luis & Magdalena, 2012)。擬南芥AtFH8的過表達促進根毛細胞的伸長生長,而其突變體卻則抑制了根毛的發育(Yi et al., 2005; Pei et al., 2012)。水稻OsFH5促使G-actin單體或Actin/Profilin配合物形成的肌動蛋白聚合成核,調控植物形態變化(Yang et al., 2011)。此外,OsFH15還參與調控水稻籽粒的生長發育(Sun et al., 2017)。植物的生長發育同時受到遺傳因素和外界環境的共同調控,如課題組前期研究中發現,水稻成蛋白基因OsFH1可能通過調控極性生長參與水稻根毛伸長調控。在不同的培養條件下(固體培養基表面或者水培),OsFH1的突變體有不同的表型,在固體培養基的表面,即使在OsFH1基因缺失的情況下,突變體也可長出正常的根毛 (Huang et al., 2013)。由此可知,某種未知的環境因素可能通過某個信號通路可彌補OsFH1的缺陷造成的根毛極性生長,即水稻成蛋白基因OsFH1與環境因素共同調控水稻根毛的極性生長。在這個過程中,外界環境是通過改變哪些基因或者信號通路補償OsFH1基因的缺失以實現水稻根毛的正常生長仍有待探索和驗證。結構相似的蛋白之間可能存在功能代償情況,一個基因功能喪失導致植物或動物生長發育出現的缺陷被其他基因彌補一部分,如萊氏野村菌過氧化氫酶超家族基因NrCat1和NrCat4,單獨敲除一個基因會引起另一個基因表達上調,代償其功能缺失,而當兩個基因同時突變則影響萊氏野村菌的抗逆性(蘇宇, 2018)。植物通過其肽配體 CLAVATA3 (CLV3) 及其受體蛋白激酶 CLAVATA1 (CLV1) 構成高度保守的負反饋信號通路維持其干細胞穩態(Cara et al., 2016)。在擬南芥中,當CLV1缺失后,其旁系同源物BARELY ANY MERISTEM (BAM)表達量增加以補償 CLV1 的丟失造成的表型缺陷(Diss et al., 2014; Nimchuk et al., 2015)。Fatima等(2004)以及課題組未發表數據表明,水稻成蛋白家族共有17個成員,并且大部分成員的結構保守性很高,即它們在功能上可能也具有較高的相似性。因此,為探究在固體培養條件下,osfh1突變體根毛生長的恢復是否有可能是由其他水稻成蛋白基因表達產生的代償作用來實現的,本研究在1/2 MS固體培養(固培)和1/2 MS液體培養基(液培)條件下,分別處理水稻osfh1突變體,并以野生型植株作為對照,對成蛋白家族成員的表達量進行分析。此外,通過對水稻成蛋白基因家族進行生物信息學分析,預測水稻成蛋白家族成員可能的功能,對潛在的代償基因功能進行進一步探索。
1 材料與方法
1.1 材料
所采用的植物材料為水稻T-DNA插入突變體osfh1(PFG-1A-08638)及對應的野生型水稻。
1.2 材料處理
首先,使用0.1%咪鮮胺浸泡消毒osfh1突變體和野生型水稻種子8 h,在無光條件下進行萌芽36 h(37 ℃);挑選萌芽成功種子培養5 d后取樣,條件為26 ℃恒溫,16 h光照8 h無光循環處理。然后,使用70%乙醇對去皮的osfh1突變體以及野生型種子進行消毒,每次消毒1 min,重復2次。最后,將消毒后的種子加入2%有效次氯酸鈉于搖床上消毒30 min(37 ℃,60 r·min-1)后進行清洗;將消毒完成后的種子置于1/2 MS (Murashige and Smoking culture medium)培養基中培養5 d后取樣,條件為26 ℃恒溫,16 h光照8 h無光循環處理。
1.3 根毛表型觀察
利用Nikon顯微鏡和Imaging View顯微成像系統拍攝,采用Image J測量根毛數據,利用Microsoft Office Excel進行數據計算和數理統計等。
1.4 生物信息分析
通過TAIR(https://www.arabidopsis.org/)獲取擬南芥AtFHs蛋白序列,使用EnsemblPlant數據庫(http://plants.ensembl.org/index.html)下載水稻蛋白組序列。以擬南芥AtFHs作為參考序列使用TBtools v1.089在水稻基因組中比對鑒定水稻成蛋白基因家族。通過MEGA.7的ClustalW算法比對氨基酸水平的保守性,并通過鄰接法構建系統進化樹,Bootstrap值設為1 000。成蛋白結構域以及其功能通過NCBI CDD進行分析(https://www.ncbi.nlm.nih.gov/Structure/ bwrpsb/bwrpsb.cgi)。成蛋白基序的保守性通過MEME-Suit進行分析(https://meme-suite.org/meme/)。通過Rice Genome Annotation Project (http://rice.plantbiology.msu.edu/index.shtml)獲得成蛋白基因家族上游序列,通過PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)網站分析啟動子順式作用元件。在MultiLoc2(http://abi.inf.uni-tuebingen.de/Services/MultiLoc2)網站上傳水稻成蛋白Loc number預測水稻成蛋白亞細胞表達;通過The Rice Annotation Project (RAP)(https://rapdb.dna.affrc.go.jp/)數據庫獲取水稻成蛋白染色體、氨基酸殘基分子量、蛋白分子量、等電點、蛋白親水性等相關信息;通過RiceXPro數據庫(https://ricexpro.dna.affrc.go.jp/)獲得水稻成蛋白組織表達(根、種子、葉、地上部分、花藥、穗、雌蕊、愈傷組織)數據;制圖均采用TBtools軟件。
1.5 基因表達分析
采用艾德萊生物技術有限公司EASYspin plus植物RNA提取試劑盒提取固培以及液培處理的野生型和osfh1突變體根系組織總RNA。分別取1 μg的根系組織的總RNA,通過Thermo 反轉錄試劑盒合成第1鏈cDNA,并稀釋20倍備用。本實驗室引物全部為自行設計并交由擎科生物科技有限公司進行引物合成(表1)。qRT-PCR 擴增在德國耶拿qTOWER3G上進行,以不同處理的根部組織逆轉錄的cDNA 為模板,利用水稻成蛋白的特異引物對成蛋白進行擴增;并以Ubiquitin作為內參基因,正向引物為5′-ATCACGCYGGAGGTGGAGT-3′,反向引物為5′-AGGCCTTCTGGTTGTAGACG-3′。擴增的總反應體系為10 μL,其中含有2×SYBR Green 5 μL、2.5 μmol·L-1正向引物1 μL、2.5 μmol·L-1反向引物1 μL、模板cDNA 3 μL,設3次重復。擴增基因的反應循環數為40個,PCR條件:95 ℃下預變性2 min,95 ℃下變性15 s,55 ℃下退火15 s,72 ℃下延伸20 s。通過qPCR soft 4.0軟件對數據進行分析。

表 1 水稻成蛋白家族qRT-PCR引物設計Table 1 qRT-PCR primer design of OsFHs in rice
2 結果與分析
2.1 水稻osfh1突變體表型
以水稻osfh1突變體以及野生型植株進行固培和液培處理觀察水稻主根根毛表型發現,osfh1突變體地上部分長度比野生型短,并且在固體培養處理后野生型和突變體都有一定伸長(圖1:A-B)。osfh1突變體主根較野生型長,且在固體培養處理后野生型和osfh1突變體主根根長都有一定增加(圖1:C-D)。osfh1突變體主根在1/2 MS液體培養條件下無根毛,當突變體在1/2 MS固體培養基上生長時,主根根毛表型得到一定恢復且差異顯著(圖1:E-F)。這表明OsFH1基因參與水稻生長發育的調控,在主根根毛的生長發育中具有關鍵作用,并且osfh1突變體在不同環境下表型發生改變表明環境因素通過與OsFH1基因的突變共同作用改變水稻主根根毛表型。此外,液培處理下的osfh1側根數量和長度均有增加。
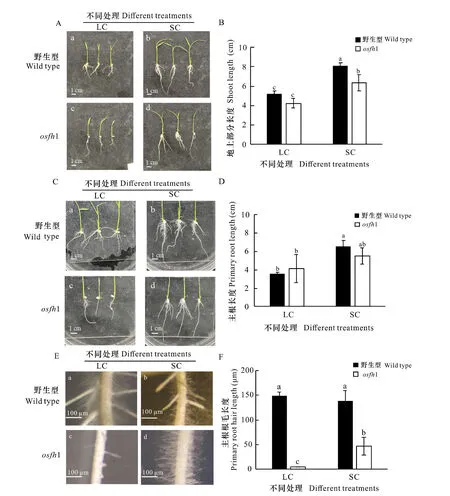
A. 野生型和osfh1突變體地上部分的表型; B. 野生型和osfh1突變體地上部分長度柱形圖; C. 野生型和 osfh1 突變體根部的表型; D. 野生型和osfh1突變體主根長度柱形圖; E. 野生型和osfh1突變體主根根毛的表型; F. 野生型和osfh1突變體主根根毛長度柱形圖。 LC. 1/2MS液體培養; SC. 1/2MS固體培養(P<0.05)。下同。A. Phenotypes of the aerial parts of wild type and osfh1 mutants; B. Length bar graphs of aerial parts of wild type and osfh1 mutants; C. Phenotypes of wild type and osfh1 mutant roots; D. Bar graph of wild type and osfh1 mutant taproot lengths; E. Phenotypes of taproot root-hairs of wild type and osfh1 mutants; F. Length bar graphs wild type and osfh1 mutant taproot root hair lengths; LC. 1/2MS liquid culture; SC. 1/2MS solid culture (P<0.05). The same below.圖 1 水稻野生型和osfh1突變體在不同處理下表型差異Fig. 1 Phenotypic difference of wild-type rice and osfh1 mutants under different treatments
2.2 qRT-PCR分析不同環境下野生型和osfh1突變體成蛋白家族基因成員表達量變化
研究認為,結構高度相似的蛋白可能行使類似的功能,而同一家族成員結構功能往往類似(蘇宇, 2018;Nimchuk et al., 2015)。因此,成蛋白家族其他成員很可能在不同環境因素處理下osfh1根毛表型恢復的過程中行使一定功能。鑒于此,本研究使用qRT-PCR技術對固培液培處理下的野生型以及osfh1突變體根部的成蛋白家族成員基因表達進行分析。
從圖2可以看出,當培養條件由液培到固培中時,osfh1突變體中的OsFH3、OsFH5、OsFH8、OsFH10、OsFH11、OsFH13、OsFH17表達量上調,OsFH1、OsFH2、OsFH4、OsFH12、OsFH14、OsFH16表達量下調,而OsFH6、OsFH7、OsFH9表達量無變化。其中,OsFH16在突變體中表達量大幅度下調,調,并且與野生型中OsFH16和OsFH17的表達趨勢相反,因此OsFH16 、OsFH17極有可能參與環境表明其可能受到OsFH1的調控;而OsFH17大幅度上與osfh1突變體互作改變根毛表型這一過程。
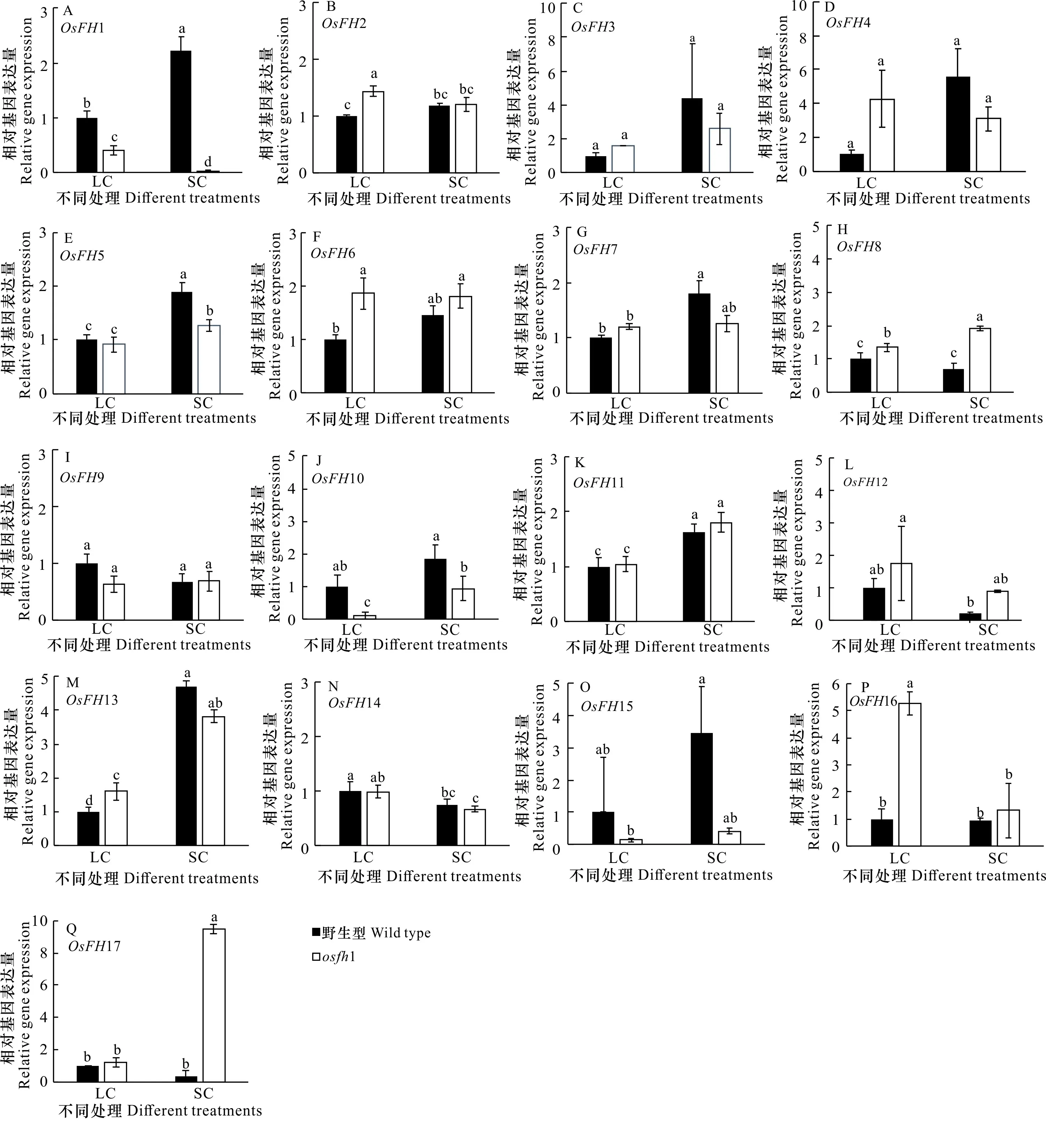
A-Q分別是野生型和osfh1根部OsFHs家族的表達量。小寫字母表示不同處理下野生型和osfh1之間差異顯著性(P<0.05)。下同。A-Q are the expression levels of wild-type and osfh1 root OsFHs respectively. lowercases indicate the significant differences between wild-type and osfh1 under different treatments (P< 0.05). The same below.圖 2 不同處理下osfh1突變體與野生型OsFHs基因家族表量變化Fig. 2 OsFHs expression changes between WT and osfh1 under different treatments
通過比較固培環境與液培環境處理下osfh1和野生型根部的OsFHs表達量,進一步分析了不同環境處理下OsFHs表達趨勢,結果見圖3。從圖3可以看出,從水培到固培中野生型以及osfh1體內OsFH3、OsFH5、OsFH7、OsFH10、OsFH11、OsFH13、OsFH15表達趨勢一致都呈上升趨勢,OsFH12、OsFH14、OsFH16都呈下降趨勢,而OsFH1、OsFH2、OsFH4、OsFH8、OsFH9、OsFH17表達趨勢相反。其中,osfh1突變體中OsFH10、OsFH15表達量雖然大幅度增加,但其表達量趨勢與野生型一致,并且表達量低于野生型。野生型中OsFH16表達量無變化,但在osfh1突變體中大幅度下降。野生型和突變體中OsFH17表達趨勢相反,osfh1中OsFH17表達急劇上升,并且差異顯著。
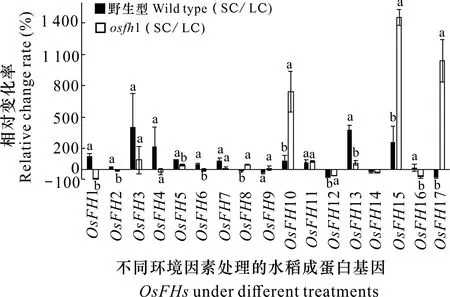
相對變化率為osfh1和野生型根部OsFHs家族在1/2 MS固體培養(SC)處理下的表達量比上1/2 MS液體培養(LC)處理下的表達量的比值。Relative change rate is the OsFHs expressions of the osfh1 mutant and wild-type root under 1/2 MS solid culture treatment (SC) compared to those under 1/2 MS liquid culture treatment (LC).圖 3 1/2 MS固培和1/2 MS液培處理下OsFHs 相對表達量分析(osfh1與野生型相比較)Fig. 3 Relative expression analysis of OsFHs under 1/2 MS solid and 1/2 MS liquid treatments (compared with the expression level in wild type)
2.3 水稻成蛋白生物信息分析
qRT-PCR分析表明不同環境處理osfh1突變體導致其體內成蛋白基因家族OsFH16、OsFH17表達量被改變。基于代償理論,我們認為OsFH16、OsFH17可能參與不同環境因素處理下osfh1表型恢復過程。通過生物信息學對水稻成蛋白的結構、功能可能受到的調控以及OsFH16和OsFH17是否可能參與根毛生長發育的調控和水稻成蛋白家族可能的功能進行了分析。
2.3.1 水稻成蛋白結構域預測、序列比對與進化分析 蛋白可能行使的功能與其蛋白的結構密切相關,因此基于課題組未發表數據鑒定的17個水稻成蛋白家族成員,分析其可能的功能,利用生物信息技術對水稻中成蛋白保守蛋白結構域以及基序進行了比較分析(圖4)。本研究結果表明,水稻成蛋白家族成員高度保守,且都具有FH2關鍵結構域,與Fatima等(2004)關于擬南芥以及早先水稻相關成蛋白的研究結果一致。水稻成蛋白可分為兩個亞家族,即第一類亞家族(OsFH1、OsFH2、OsFH4、OsFH8、OsFH9、OsFH10、OsFH11、OsFH13、OsFH14、OsFH15、OsFH16、OsFH17)和第二類亞家族(OsFH3、OsFH5、OsFH6、OsFH7、OsFH12)。在水稻第二類亞家族中,OsFH12還存在于植物領域中未闡明的結構域PTEN。此外,通過蛋白序列同源性分析也表明水稻成蛋白的FH2結構域在氨基酸水平上是保守的。與OsFH1親緣關系最近的是OsFH15,而OsFH17與OsFH16與OsFH1親緣關系較遠。但是,保守基序分析結果顯示,水稻成蛋白第一類亞家族基序保守性較高,表明第一類亞家族成員的功能可能類似,因此為了進一步分析水稻成蛋白可能存在的功能,本研究對其順式作用元件以及亞細胞定位進行分析。
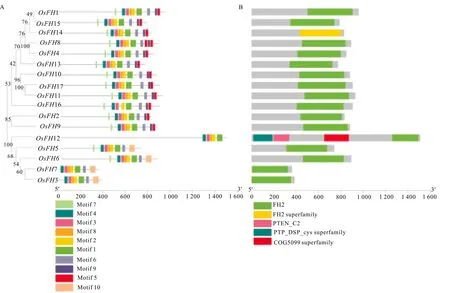
A. OsFHs家族系統進化樹和保守基序分析; B. OsFHs家族蛋白分析。A. OsFHs family phylogenetic tree and conservative motif analysis; B. OsFHs family conservative protein analysis.圖 4 水稻成蛋白進化樹、保守蛋白結構域以及保守基序分析Fig. 4 Phylogenetic, conserved motif and protein domains analysis of OsFHs in rice
2.3.2 水稻成蛋白順式作用元件以及亞細胞定位分析 順式作用元件分析表明成蛋白家族成員上游存在多個響應激素以及脅迫調控相關的元件(圖5)。這些成蛋白成員中除OsFH17以外,其他水稻成蛋白都可能受到茉莉酸調控,而除了OsFH3,OsFH5和OsFH6以外其他水稻成蛋白成員都有厭氧調控相關的順式作用元件。此外OsFH1、OsFH4、OsFH5、OsFH6、OsFH8、OsFH10、OsFH12、OsFH13、OsFH15都具有干旱響應元件。OsFH1、OsFH8、OsFH9、OsFH11、OsFH13、OsFH15、OsFH16、OsFH17都具有生長素調控相關原件,表明其可能參與生長素相關調控。
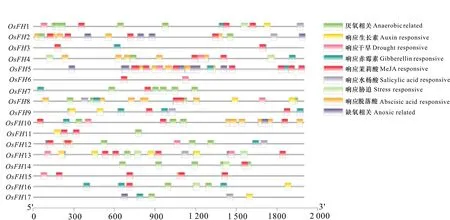
圖 5 水稻成蛋白順式作用元件預測Fig. 5 Cis-acting elements predicted in the promoter regions of OsFHs
其中,OsFH16、OsFH17、OsFH1都具有厭氧相關的順式作用元件、赤霉素調控相關順式作用元件以及生長素調控相關順式作用元件。而研究表明水稻根毛生長發育受到生長素以及赤霉素調控(Maekawa et al., 2009; Wang et al., 2017)。在本實驗中固培、水培環境變化也包括氧氣含量的變化,但當前并無相關研究。因此,環境變化改變根毛表型可能是通過生長素以及赤霉素相關信號通路調控,而養分含量也可能作為環境因素參與調控。
亞細胞定位表明OsFH1、OsFH4、OsFH6、OsFH7、OsFH9定位于細胞液中,OsFH2定位于胞外,而OsFH4、OsFH5、OsFH6定位于質體,并且OsFH4可能在細胞核內起著一定作用。此外,OsFH8、OsFH11、OsFH12、OsFH13、OsFH14、OsFH15、OsFH16、OsFH17都定位于質膜,表明大部分水稻成蛋白可能在質膜上行使功能。并且OsFH6定位于過氧化物酶體,OsFH13定位于液泡,OsFH3定位于線粒體表明這些水稻成蛋白可能參與這些細胞器的形成。OsFH10、OsFH13定位于高爾基體,OsFH14、OsFH15定位于內質網表明其可能參與蛋白的分泌與轉運(表2)。而OsFH1和OsFH16、OsFH17之間定位的差異,表明OsFH1功能可能和OsFH16、OsFH17存在一定差異。
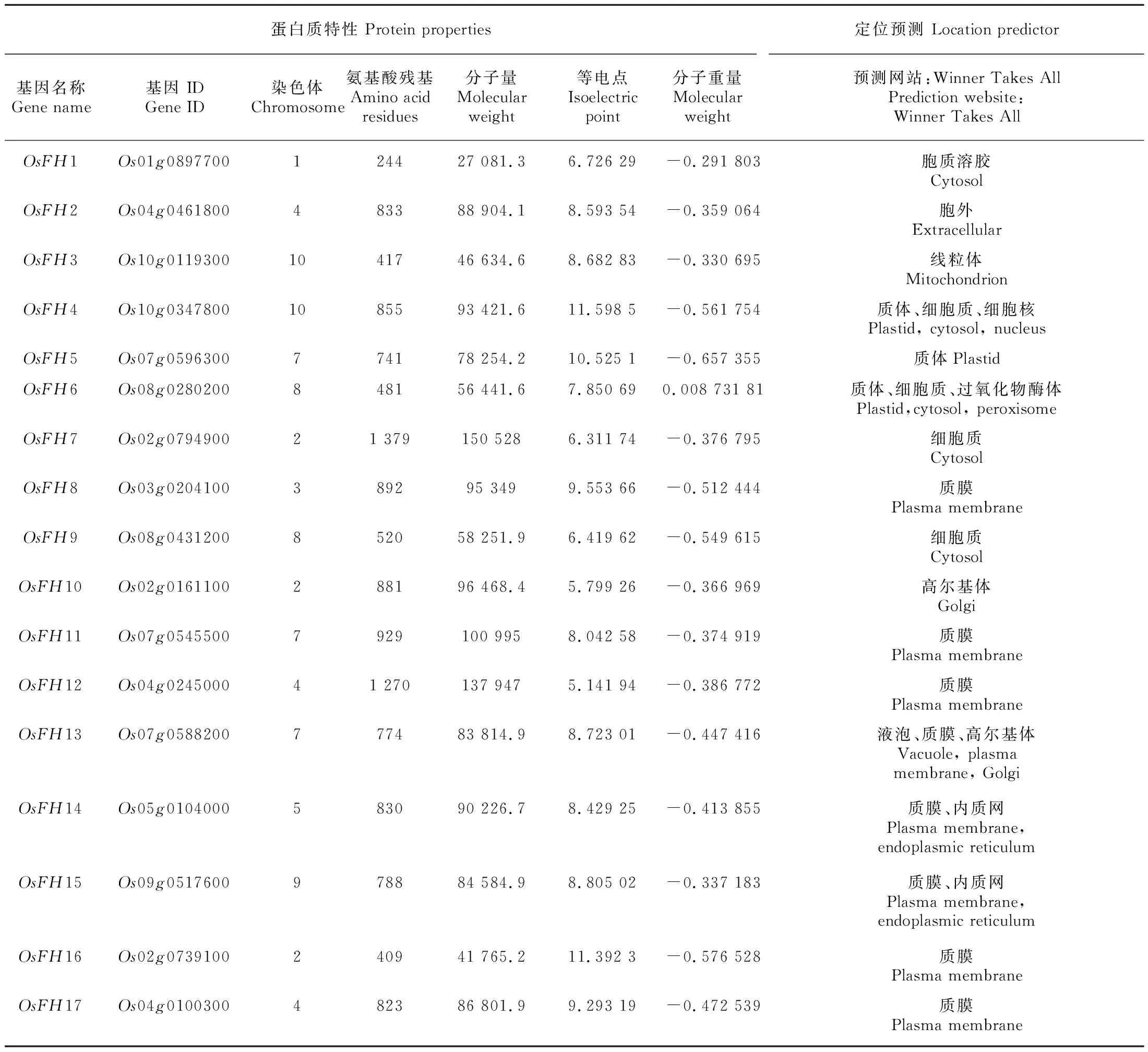
表 2 水稻成蛋白信息Table 2 Information of rice formin proteins
2.3.3 水稻組織成蛋白表達水平分析 基因在植物不同部位的表達差異可能決定了其參與的功能,通常在某個部位高表達的基因會參與特定部位的生長發育,以及對脅迫進行響應。通過RiceXPro數據庫(https://ricexpro.dna.affrc.go.jp/)獲取水稻成蛋白家族在不同部位表達量數據,進一步探索水稻成蛋白家族成員可能具有的功能。
水稻成蛋白組織表達分析表明,OsFH7在水稻根部高表達,OsFH13、OsFH10、OsFH2、OsFH4、OsFH8、OsFH11、OsFH16、OsFH1、OsFH5在水稻根部均有表達,而OsFH14、OsFH6、OsFH3在根部有表達,但表達量較低,表明這些成蛋白家族成員可能在根部具有一定作用。水稻OsFH1在根部的表達也與osfh1突變體表型相吻合,但根部OsFH17表達量較低(圖 6)。
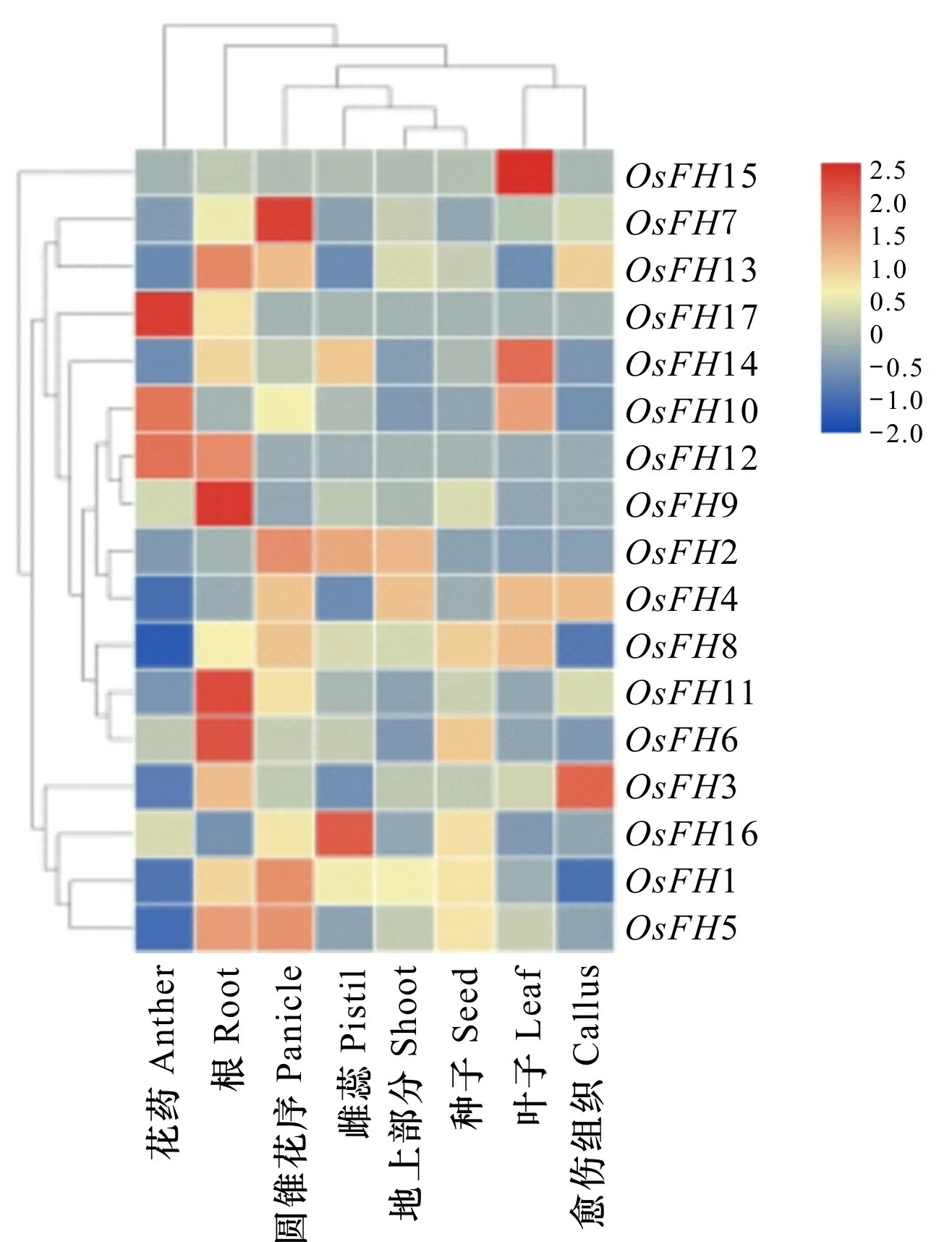
圖 6 水稻成蛋白在不同組織表達水平Fig. 6 Expression pattern of OsFHs in rice
3 討論與結論
水稻根毛作為一種根部表皮細胞的特異化結構,參與水稻獲取外界養分、微生物互作、土壤固定等關鍵生理過程(李斌等, 2020)。Salazar-Henao等(2016)研究認為水稻根毛的伸長是通過根部表皮細胞的極性生長往外延伸,但對于其如何進行極性生長過程尚不清楚。成蛋白作為細胞極性生長的關鍵蛋白,在動植物中都有一定研究,如AtFH3、AtFH5調控擬南芥花粉管極性生長(Liu et al., 2018; Lan et al., 2018)。擬南芥AtFH8介導植株根毛形態發育(Pei et al., 2012)。水稻相關研究表明,osfh1突變體根毛無法進行伸長,說明OsFH1參與根毛的極性過程(Huang et al., 2013)。此外,OsFH1突變體的根毛表型缺陷在不同環境的處理下得到一定程度恢復,表明環境因素參與了osfh1介導的根毛生長發育。基于這一結論結合相關研究中所得到的結構高度相似的基因之間可能存在代償作用的觀點,探究水稻成蛋白家族是否能夠在osfh1突變情況下取代其作用,從而促進根毛的生長(Diss et al., 2014; Nimchuk et al., 2015)。
qRT-PCR分析結果顯示水稻成蛋白中OsFH16、OsFH17在1/2 MS固培以及1/2 MS液培處理下中表達量差異顯著,表明OsFH16、OsFH17可能參與不同環境處理改變osfh1突變體根毛表型的調控。OsFH16、OsFH17都和OsFH1一樣屬于第一類成蛋白家族成員。亞細胞定位表明OsFH16、OsFH17都定位于細胞質膜,與相關研究一致,即酵母成蛋白定位于細胞極性生長位點,促進物質傳輸,并且通過聚合肌動蛋白促進細胞極性生長(Billault & Martin, 2019; Cifrova et al., 2020)。并且擬南芥研究也證實了這一點,如AtFH5通過定位在細胞膜極性生長點介導囊泡運輸物質(Liu et al., 2018)。在本研究中,OsFH16、OsFH17基因上游都具有植物激素、厭氧、缺氧相關順式作用元件,結合酵母研究表明成蛋白可能參與抵抗溫度脅迫,響應過氧化氫等結果,表明OsFH16、OsFH17極有可能可能受到環境的調控從而代償osfh1突變導致的水稻根毛無法伸長。此外,對OsFH16、OsFH17表達趨勢進行分析發現OsFH17從液培到固培表達量急劇增加,表明其可能在環境處理改變osfh1突變體根毛表型的調控中具有更重要的作用,但對于其具體功能還需進一步探索。
在對水稻成蛋白的結構分析時發現水稻第二類成蛋白OsFH12與其他成員不同,只有一個PTEN結構域。PTEN是在人類癌癥調控的關鍵基因,PTEN主要通過去磷酸化參與細胞調控,并且通過結合膜磷脂定位于細胞質膜(van Gpac et al., 2012)。OsFH12蛋白具有的PTEN結構域表明其可能通過該結構定位在細胞膜行使功能,并且該結果與亞細胞分析結果一致。因此,OsFH12極有可能在細胞質膜上行使功能。結合OsFH12的組織表達數據,OsFH12極有可能參與花藥的生長發育。此外,本研究發現1/2 MS液培處理下的osfh1突變體中側根數量以及長度多于野生型,表明OsFH1可能參與側根的起始。擬南芥研究也表明其側根的起始依賴于細胞骨架以及肌動蛋白介導的中柱鞘細胞不對稱細胞分裂,從而形成側根原基促使側根生長(Barro et al., 2019; Fernandez et al., 2020)。成蛋白主要功能是調控肌動蛋白以及細胞骨架,因此水稻OsFH1也可能通過調控細胞骨架和肌動蛋白促進水稻側根起始。
目前,關于水稻成蛋白在水稻根毛發育過程中行使功能的研究較少,并且對于不同環境通過調控哪些基因促進osfh1突變體恢復表型也尚未闡明。本研究通過分析不同環境處理下osfh1突變體成蛋白基因家族的表達量、利用生物信息手段對水稻成蛋白基因家族成員進行系統性分析,結果表明在固體表面培養時,環境變化可能通過OsFH16、OsFH17等基因的改變以補償OsFH1基因的缺陷,進而確保植物可產生正常的根毛。但是,該論斷仍需要利用突變體,過表達體及遺傳學方法的進一步驗證。

