胎盤臍帶和絨毛來源的間充質干細胞改善大鼠肝纖維化
郝廣曙,周慶云,潘志鳳,魯平,趙潔
(甘肅省婦幼保健院病理科,甘肅 蘭州 730050)
肝纖維化是由各種致病因子所導致的肝臟內結締組織異常增生的病理生理性過程[1-2]。間充質干細胞(mesenchymal stem cells,MSCs)來源于中胚層,具有多向分化和自我更新潛能的成體干細胞[3-5],具有免疫原性低、免疫調節及抗炎等作用[6-8],廣泛存在于骨髓、脂肪、胎盤、臍帶等組織和器官中。與骨髓來源的間充質干細胞具有相似生物學特性的人臍帶和胎盤絨毛來源的間充質干細胞(UC-MSCs和 hPMSCs)具有豐富來源、獲取容易、低免疫原性、無倫理安全問題等優點,應用價值較高[9]。MSCs對肝纖維化和肝硬化動物模型具有有效的治療作用,孫慧聰等[10]研究報道,UC-MSCs和hPMSCs移植可減弱大鼠肝纖維化程度;高琳琳等[11]則指出,臍帶和脂肪來源的間充質干細胞能夠改善大鼠肝硬化。本研究擬探討UC-MSCs和hPMSCs治療四氯化碳(carbon tetrachloride,CCL4)誘發的肝纖維化鼠模型的療效。
1 材料與方法
1.1 材料
UC-MSCs和hPMSCs均取自課題組已建立的細胞庫[12],選取凍存的第二代細胞,快速復溫后傳代培養至細胞呈現穩定狀態。
1.2 方法
1.2.1 構建大鼠模型 6 周齡SPF(specific pathogen free,SPF)級健康雄性SD(Sprague Dawley,SD)大鼠,體重180 ~ 200 g,由具有標準飼養條件的浙江省醫學科學院實驗動物中心提供,飼養過程遵循GB/T 35892-2018實驗動物福利倫理審查指南[13]。將50% CCl4橄欖油溶液,按照5 mL/kg皮下注射,每周兩次,持續8周[1]。
1.2.2 實驗分組 48只大鼠隨機分為4組。正常組:造模時注射生理鹽水;UC-MSCs移植組:模型構建完成后通過尾靜脈注射生理鹽水制備的3~6代UC-MSCs懸浮液1 mL,每只大鼠注射2.0×106個細胞;hPMSCs移植組:模型構建完成后通過尾靜脈注射生理鹽水制備的3~6代hPMSCs懸浮液 1 mL,每只大鼠注射2.0×106個細胞;肝纖維化模型組:模型構建完成后尾靜脈注射生理鹽水1 mL/只。每組各12只大鼠[1]。
1.2.3 肝功能檢測 移植細胞12周后處死大鼠,收集血清,取肝臟。用全自動生化分析儀(Abbott)檢測白蛋白(ALB)、丙氨酸氨基轉移酶(ALT)、堿性磷酸酶(ALP)、天冬氨酸氨基轉移酶(AST)的濃度。
1.2.4 肝臟病理組織學檢測 大鼠肝臟組織,經過4%中性緩沖甲醛固定過夜,按照常規病理組織處理流程處理,進行蘇木精/伊紅染色(HE染色)、天狼星紅染色、馬松(MTC)染色,按照Jain-Garcia評分系統,對大鼠肝臟纖維化程度進行評分。
1.2.5 肝臟免疫組織化學染色 石蠟包埋的大鼠肝臟組織4~5 μm連續切片,脫蠟,利用鏈霉菌抗生物素蛋白- 過氧化物酶連結法(SP)進行免疫組織化學檢測,二氨基聯苯胺(DAB)顯色,蘇木精復染。光學顯微觀察,免疫組化陽性表達部位呈現棕褐色。
1.3 統計學分析

2 結果
2.1 UC-MSCs和hPMSCs的培養
UC-MSCs貼壁生長呈良好的纖維細胞生長狀態,培養至細胞融合度達70%~80%時,進行傳代培養,傳代頻率3~4 d/次;hPMSCs貼壁生長,單層,纖維狀,培養至細胞融合度達70%~80%時,進行傳代培養,傳代頻率3~4 d/次。見圖1。

2.2 各組肝臟病理學特征比較
HE和MTC染色結果顯示,正常組大鼠的肝臟小葉結構正常,界限清晰,結構完整;模型組大鼠,正常肝小葉出現結構破壞,假小葉,且肝板排列呈紊亂狀態,纖維組織增生嚴重;UC-MSCs和hPMSCs移植組,肝臟組織的纖維增生具有明顯的改善。通過HE和MTC染色后依據Jain-Garcia評分系統進行評分,UC-MSCs和hPMSCs移植組較對照組纖維化程度有所改善,差異均具有統計學意義(P<0.05);UC-MSCs組與hPMSCs組的肝組織評分差異無統計學意義(P>0.05)。天狼猩紅染色表明,正常組大鼠,肝小葉中央靜脈管壁呈現紅色纖維組織染色,少量的染色出現在小葉間隔及匯管區;而大量纖維組織沉積染色出現在模型組大鼠肝臟中,且包繞肝細胞形成假小葉,大鼠肝纖維化模型構建較成功。UC-MSCs和hPMSCs移植組纖維組織的沉積量明顯少于肝纖維化模型組。見圖2及表1。


表1 UC-MSCs組與hPMSCs組的肝組織評分
2.3 各組肝臟功能比較
與肝纖維化模型組比較,UC-MSCs和hPMSCs移植組的肝功能指標(ALB、ALT、ALP、AST)均改善,差異均有統計學意義(P<0.05),UC-MSCs和hPMSCs移植能夠提高肝功能;UC-MSCs和hPMSCs組大鼠的肝功能指標相比,差異無統計學意義(P> 0.05)。見表2。
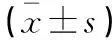
表2 移植后大鼠肝功能指標檢測結果
2.4 各組免疫組織化學比較
免疫組織化學結果顯示,與肝纖維化模型組相比,UC-MSCs和hPMSCs移植組的α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)、轉化生長因子-β1(transforming growth factor-β1,TGF-β1)表達水平降低,表明UC-MSCs和hPMSCs移植可抑制肝星狀細胞(hepatic stellate cell,HSC)活性和防止HSC分化。見圖3。

3 討論
肝硬化是由多種原因引起的肝臟慢性進行性病變,其主要特點是肝臟結構破壞,纖維狀隔膜圍繞再生或再生的實質結節,肝纖維化是肝硬化發展的中間階段。目前,肝移植仍是臨床治療肝硬化的最有效方法,但礙于各種復雜因素,其臨床應用受限[1-2]。近年來,隨著干細胞移植治療疾病的發展,干細胞移植治療肝病逐漸成為研究熱點,由于兼備移植細胞來源豐富、低免疫原性且創傷性小等優勢,有望于成為改善終末期肝病的一種有前途的替代方法,使肝病治療進入一個劃時代再生治療階段[14]。Ryu等[4]指出,移植的MSC治療效果可通過抗纖維化機制和促進肝細胞再生衡量,且其治療肝纖維化的療效較顯著 。MSC可能通過分泌保護細胞免受損傷的有機營養因子,或通過激活內源性修復機制促進纖維基質降解,恢復受損肝臟[8,15]。本研究中, UC-MSCs和hPMSCs移植組纖維化程度的改善效應均強于肝纖維化模型組,纖維組織的沉積量也減少。既往研究[16]采用Laennec fibrosis scoring system對肝纖維化進行評分分類,但由于缺少確切的隔膜和結節大小,易誤診。本研究運用Jain-Garcia評分系統對肝硬化進行了更加確切和詳細的分類,評分結果與H&E 、MTC和天狼星紅染色結果一致,均表明移植治療組能夠改善肝纖維化。細胞外基質(extracellularmatrix,ECM)降解不足和HSC活化是肝纖維化發生的關鍵因素,激活的HSC可通過轉化為鼠心肌成纖維細胞(mouse cardiac fibroblasts,MFC)促進ECM合成增多、降解減少或代償不足,誘發肝臟細胞外基質異常沉積,進而引起肝纖維化[5,15]。α-SMA則是HSC激活標志,肝纖維化的發生和發展均與HSC過表達α-SMA密切相關[1,17]。TGF-β1具有調控細胞外基質的沉積和降解作用,不僅能夠激活HSC、誘導肝細胞凋亡、抑制肝細胞增殖,促進ECM生成,還能夠減少膠原酶和蛋白酶產生,增加組織抑制因子的生成,使ECM降解減少[1,18]。本研究顯示,移植治療組α-SMA和TGF-β1表達下調,表明UC-MSCs和hPMSCs的移植可抑制HSC活性并阻礙其分化。
綜上,UC-MSCs和hPMSCs移植組對大鼠肝臟纖維化程度的改善程度明顯優于對照組,一定程度上恢復大鼠肝臟功能。

