無細胞蛋白合成系統中細胞提取物和模板DNA的研究進展
許博楠 馮佳 周見庭 蔣建蘭
(天津大學化工學院 天津大學系統生物工程教育部重點實驗室,天津 300072)
近幾十年來,微生物已經發展成為了生產蛋白質藥物、酶制劑和生物能源等產品的有效底盤[1]。然而,由于活細胞的復雜性和細胞膜的屏障,目標產物的有效生物合成和釋放受到了限制[2],為了解決這一問題,無細胞蛋白合成系統(cell-free protein synthesis,CFPS)被廣泛應用起來。CFPS 系統與體內蛋白表達系統相比沒有細胞生長和維持的限制,易于觀察和操作,且設計構建速度快、產物產量高、對有毒底物或產物具有高耐受性[3]。隨著合成生物學領域的快速發展,CFPS 系統在近幾年來取得了巨大的進步[4-6],已經從單純的研究性工具發展成為替代傳統生物系統的有效平臺。
20世紀50年代以來,無細胞系統一直被用于探索基本的生物學機制[7-8]。1958年,Zamecnik 實驗室首次證明了不依賴完整的細胞結構而從細胞中提取翻譯相關物質就可以調節體外蛋白質的合成[9]。1961年,Nirenberg 和Matthaei[10]利用大腸桿菌細胞提取物系統成功破譯了20 種氨基酸的遺傳密碼子,取得了CFPS 領域的開創性進展。1962年,Nathans 等[11]利用大腸桿菌細胞提取物體外合成了第一個完整的蛋白質——噬菌體f2 的衣殼蛋白,之后許多病毒RNA 被用作信使RNA 來啟動完整蛋白質的體外合成。1967年,Lederman 和Zubay[12]開發了一種耦合轉錄-翻譯系統,可將DNA 作為模板用于蛋白質的合成,這一發現是現代無細胞轉錄和翻譯應用的先驅。1973年,Zubay[13]開發了一種以大腸桿菌S30 提取物為基礎的CFPS 系統,該系統由于較高的蛋白質產量而得到了廣泛發展。1988年,Spirin 等[14]通過連續交換反應物及反應產物和副產品以延長轉錄和翻譯,使CFPS 系統運行長達數十小時,大大提高了蛋白質的產量。2000年之后,一場關于CFPS 系統的技術復興逐漸展開,一些限制系統發展的瓶頸問題例如較低且不可控的蛋白質產量、較高的試劑成本、反應規模小、無法正確折疊復雜的蛋白質等逐漸被攻克[15-18],使CFPS 系統在合成生物學領域的廣泛應用成為可能。
CFPS 系統是一個體外蛋白質轉錄和翻譯平臺,其原理是以質粒DNA 或線性PCR 產物為模板,在RNA 聚合酶及轉錄因子等組分的作用下進行轉錄,利用體系中的核糖體、調控因子、氨基酸底物、tRNA、能源物質等進行翻譯[19]。CFPS 系統可以分為兩類,一類是“PURE”系統,其由轉錄和翻譯的必要元素組成,所有添加物成分已知、濃度可控,可以減少蛋白酶與核酸酶的污染[20]。另一類是基于細胞提取物的CFPS 系統,通過裂解細胞在保留轉錄和翻譯機制的同時去除細胞碎片和染色體DNA,它相比“PURE”系統成本更低且更通用,尤其在大規模生產中顯示出更高的性價比[20],所以本文主要討論基于細胞提取物的CFPS 系統。最近已有幾篇優秀的綜述總結了CFPS 系統中反應混合物的制備、優化蛋白表達量方面的研究進展[5,21],本文主要總結了CFPS 系統中另外兩個關鍵因素——細胞提取物和模板DNA 方面的研究進展。本文將介紹細胞提取物制備方法的發展歷程,重點討論了近幾年來新開發的原核細胞提取物系統的特點及應用前景。同時,詳細總結了質粒DNA 模板和線性DNA 模板的研究進展,這些研究進展為構建更加高效可控的CFPS 系統奠定了基礎。
1 細胞提取物的研究進展
1.1 細胞提取物的制備
在無細胞蛋白合成過程中,細胞提取物的制備是建立高效、可重復的工作流程的關鍵步驟。隨著工業化大規模生產和對生產率的高要求,細胞提取物的制備方法也隨之不斷發展[22]。最初的細胞提取物制備流程為:首先使用發酵罐培養細胞至指數中期,再使用高壓均質器裂解細胞,之后通過30 000×g 離心去除細胞碎片和基因組DNA,最后經過徑流反應和透析等步驟獲得符合標準的細胞提取物。制備好的細胞提取物再加入模板DNA、氨基酸、三磷酸腺苷(ATP)、能量分子、鹽和緩沖液的混合物以啟動CFPS 反應[13]。傳統的細胞提取物制備流程步驟復雜且試劑成本較高,之后不同的研究團隊對細胞提取物的制備工藝進行了幾點改進。Kigawa等[23]報道了搖瓶發酵簡化細胞生長的方法,該方法與發酵罐獲得的產率相當。Liu 等[24]簡化了制備過程中的幾個步驟如提高均質化速度使制備時間縮短了近50%,同時通過優化徑流培養使總試劑成本降低了70%。Kim 等[25]用較低的離心率(12 000×g)替代高速離心并省去了透析步驟,發現提取物仍保留完整的轉錄翻譯活性,但總成本和處理時間分別減少了80%和60%。除此之外,為了進一步降低提取物制備的成本,研究者們也探索了能夠替代高壓均質器裂解細胞的方法,包括使用凍融循環[26-27]、超聲[28-29]、珠渦混合[28]、溶菌酶[30]來裂解細胞。細胞提取物制備工藝的簡化與優化大大節省了CFPS反應的時間和成本,有助于推動CFPS 的工業化發展及其在合成生物學領域的廣泛應用。
除了對細胞提取物制備過程的簡化和優化,在源細胞中刪除或過表達某些基因,還可以獲得更加滿足需求的無細胞提取物。Michel-Reydellet 等[31]先刪除了大腸桿菌菌株中編碼影響氨基酸穩定性的酶的基因,再獲取細胞提取物,最終使蛋白質產量大大提高。Kim 等[25]在細胞提取物制備過程中使用商業BL21(DE3)菌株過表達T7 RNA 聚合酶,從而不需要再添加獨立純化的T7 RNA 聚合酶。Jewett團隊利用缺乏釋放因子(release factor 1,RF1)且過表達T7 RNA 聚合酶的大腸桿菌提取物系統建立了一個高產量一鍋式CFPS 平臺,該平臺可合成包含40 種非天然氨基酸的產品[32]。該團隊還將多個提取物組合在一起,每個提取物都含有一種過表達酶,構建了一個完整的生物合成途徑[33-34]。這些進展表明,提取物的制備流程可以根據最終目標進行修改。
1.2 新開發的細胞提取物系統
理論上從任何生物中都可以獲取細胞提取物,提取物的選擇要考慮原料的可獲得性和提取物制備的便利性,還需考慮目標蛋白質的生化特性及下游應用。細胞提取物系統根據來源可分為真核系統和原核系統[35](表1)。真核系統具有翻譯后修飾功能,可被用來生產具有藥用價值的復雜蛋白質。目前已被開發的真核細胞提取物種類很多,包括小麥胚芽提取物(wheat germ extract)[58]、兔網織紅細胞提取物(rabbit reticulocyte lysate)[59]、昆蟲細胞提取物(insect cell extract)[60]、倉鼠卵巢細胞提取物(Chinese hamster ovary/CHO cells)[61]、酵母提取物(yeast extract)[62]、煙草細胞提取物(tobacco extract)[63]、人類細胞系提取物(human cell lines)[64]。基于小麥胚芽的CFPS 系統具有高效的翻譯機制,合成真核蛋白范圍廣、產量高,但在翻譯后修飾方面存在局限性[65]。基于酵母、昆蟲細胞、倉鼠卵巢細胞、煙草細胞和人類細胞系的CFPS 系統含有內源性微粒體,能夠實現蛋白質的共翻譯易位和基于內質網的翻譯后修飾,如糖基化和脂化修飾[66]。然而,真核細胞普遍培養成本較高,提取物制備過程復雜,且批量反應蛋白質產量低。與此相比,原核系統提取物制備更方便、蛋白質產量更高、下游加工要求和成本更低。目前應用最廣泛的原核細胞提取物是大腸桿菌提取物(Escherichia coliextract)[67],它是CFPS 系統的首選宿主,已被廣泛用于商業化生產各種蛋白質。與真核系統相比,原核細胞提取物種類偏少,以往的研究主要集中于大腸桿菌系統。為了探索更多原核細胞在CFPS 系統中的應用潛力,新的原核細胞提取物系統不斷被開發出來。本文詳細介紹4 種新開發的原核細胞提取物系統。
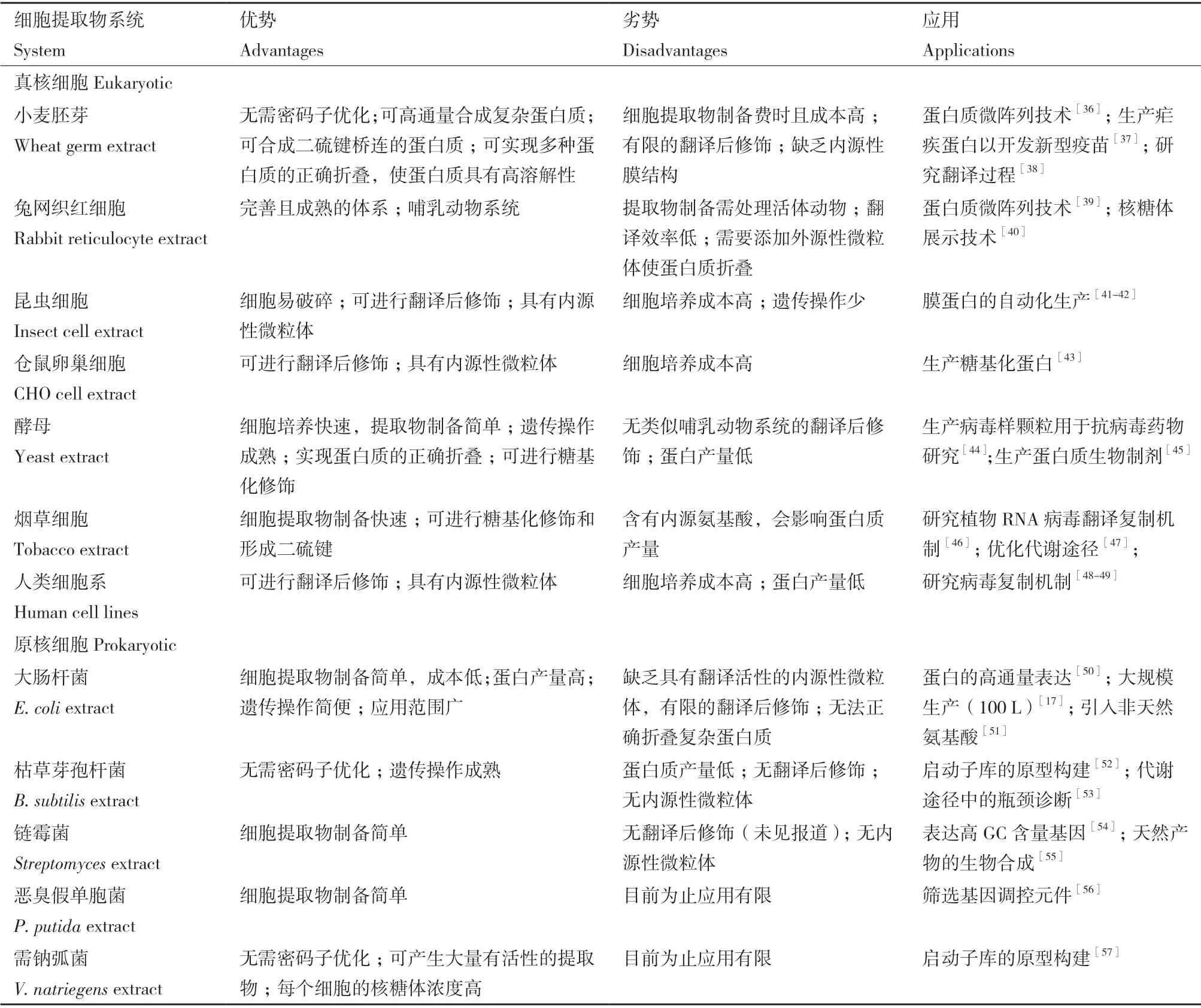
表1 不同細胞提取物系統的特點Table 1 Features of different cell extract systems
1.2.1 基于枯草芽孢桿菌(Bacillus subtilis)的CFPS系統 枯草芽孢桿菌是一種桿狀的革蘭氏陽性土壤細菌,作為工業模式微生物在重組蛋白的生產和化學物質的合成方面表現出很大潛力[68]。基于枯草芽孢桿菌的CFPS 系統在很早就開始了研究,但由于需要外源添加mRNA、DNAse 處理、能源系統效率低等因素限制了其發展[69-71]。近幾年,研究者們努力克服這些限制開發了更加高效的枯草芽孢桿菌細胞提取物系統。Freemont 團隊開發并改良了基于枯草芽孢桿菌WB800N 的CFPS 系統,該系統通過使用蛋白酶缺陷的菌株能夠持續幾個小時進行高效的無細胞轉錄-翻譯反應,該系統還可以用于枯草芽孢桿菌啟動子庫的原型構建[52]。Tian 等[53]通過優化細胞裂解條件、添加蛋白酶抑制劑和調整緩沖液組成,構建了基于枯草芽孢桿菌的無細胞N-乙酰神經氨酸(NeuAc)生物合成體系,該系統的合成效率比體內高305 倍。由此可見,基于枯草芽孢桿菌的CFPS 系統在基因調控元件的原型構建、代謝工程的研究方面具有一定的發展前景。
1.2.2 基于鏈霉菌(Streptomyces)的CFPS 系統 鏈霉菌是一類革蘭氏陽性細菌,其基因組GC 含量高(>70%),含有許多復雜的天然產物生物合成基因簇[72-73],開發基于鏈霉菌的CFPS 系統對于研究天然產物的生物合成具有諸多優勢。最初,Li 等[74]開發了一種適用于多種變鉛青鏈霉菌(Streptomyces lividans)和天藍色鏈霉菌(Streptomyces coelicolor)的CFPS 系統,該系統以密碼子優化的綠色熒光增強蛋白(enhanced green fluorescent protein,eGFP,62% GC)為報告基因,批次反應的蛋白產量大于50 μg/mL。用濃縮細胞提取物進行CFPS 反應后,eGFP的產量提高到近120 μg/mL[54]。利用該系統還成功表達了4 種鏈霉菌來源的高GC 含量基因,與大腸桿菌CFPS 系統相比蛋白在鏈霉菌CFPS 系統中的溶解度更高。雖然該系統有助于提高表達蛋白的溶解度,但該平臺的蛋白質產量與大腸桿菌CFPS 系統仍有一定差距。Xu 等[75-76]為了進一步提高鏈霉菌CFPS 系統的生產力,在反應中添加了蛋白質翻譯相關因子,獲得了約400 μg/mL 的蛋白產量,這也是迄今為止報道的最高產率。與此同時,Moore等[55,77]開發了基于委內瑞拉鏈霉菌(Streptomyces venezuelae)的CFPS 系統,蛋白產量達266 μg/mL,該系統還揭示了通過鏈霉菌的土霉素合成途徑合成多種酶的能力。總之,基于鏈霉菌的CFPS 系統將成為表達高GC 含量基因和復雜天然產物基因簇的重要工具,也為天然產物生物合成途徑的獲取和研究提供了新的思路。
1.2.3 基于惡臭假單胞菌(Pseudomonas putida)的CFPS 系統 惡臭假單胞菌是一種革蘭陰性桿菌,已具有成熟的培養技術和遺傳操作手段,被廣泛用于天然產物的生物合成[78],是實驗室研究和工業生產的強大功能底盤[79-80]。早在2004年,Nakashima 等[81]就開發了基于熒光假單胞菌的CFPS 系統,但該系統中細胞提取物制備方法復雜且蛋白產量低,具有很大的改進空間。直到2018年,Jewett 團隊參照大腸桿菌CFPS 系統開發了基于惡臭假單胞菌的CFPS系統,通過降低反應溫度、提高提取物濃度、提高質粒濃度和優化鎂離子濃度成功對該系統進行了優化,優化后的sfGFP(superfolder green fluorescent protein)產量與未優化的系統相比提高了10 倍以上,可達198 μg/mL[56]。研究團隊還利用該系統對15 個核糖體結合位點(ribosome binding site,RBS)序列的表達效率進行表征,證明了該平臺快速評估和篩選基因調控元件的能力。2019年,Yim 和Johns[82]構建、測試和優化了10 種不同細菌來源的細胞提取物并對其轉錄翻譯能力進行了測試,其中惡臭假單胞菌細胞提取物系統表現出了穩定持續的轉錄翻譯能力。由此可見,基于惡臭假單胞菌的CFPS 系統不僅為體外蛋白合成提供了新的可能性,還將為基因調控元件的篩選和原型構建提供平臺。
1.2.4 基于需鈉弧菌(Vibrio natriegens)的CFPS 系統 需鈉弧菌是迄今為止發現的增長最快的非致病性微生物,其在分子生物學、蛋白表達和代謝工程方面具有廣泛的應用前景,有可能取代大腸桿菌成為實驗室的常用底盤[83-85]。快速分裂的需鈉弧菌細胞擁有高度活躍的蛋白質翻譯機制,研究表明指數增長的需鈉弧菌每細胞含有約115 000 個核糖體,顯著高于大腸桿菌中觀察到的每細胞約70 000 個核糖體[86],這些特性顯示出了需鈉弧菌可以被開發為CFPS 平臺的潛力。Failmezger 等[57]利用需鈉弧菌細胞提取物可以在小批量反應中成功合成高達0.4 g/L 的eGFP,并利用該系統進行了啟動子庫的篩選,展現了該系統作為CFPS 平臺的適用性和篩選潛在遺傳調控元件的能力。與此同時,研究者們也在探索需鈉弧菌細胞提取物的簡易制備工藝,Wiegand團隊[87]設計了一種不需要專門設備和冗長純化步驟的簡化提取物制備方案,該方案在3 h 的小批量反應中可以獲得>260 μg/mL 的sfGFP。Des Soye等[88]使用標準超聲設備來代替昂貴的高壓均質機制備了需鈉弧菌細胞提取物,之后通過優化提取物制備工藝和無細胞反應條件使該系統的sfGFP 產量達(1.6±0.05)g/L。利用該系統還成功地進行了抗菌肽的合成,并證明該系統在凍干后仍可以保持生物合成能力。以上研究成果可以看出,基于需鈉弧菌開發的CFPS 平臺作為大腸桿菌細胞提取物系統的有力替補,具有高度的靈活性和廣闊的發展空間,可能會使蛋白表達和基因元件篩選向著更快速的方向發展。
基于更多底盤生物的CFPS 平臺的開發不僅給體外蛋白質生產提供了更多選擇,而且有望更好地模擬宿主細胞的原型應用過程,開辟新的研究領域。以上新開發的原核細胞提取物系統與大腸桿菌CFPS系統相比有不同的特點與優勢,比如枯草芽孢桿菌和需鈉弧菌細胞提取物系統不需要密碼子優化,且細胞提取物中細菌內毒素含量遠低于大腸桿菌,可減輕生物制藥行業的下游加工負擔,在設計和生產未來蛋白藥物方面具有更大的潛力。然而,這些CFPS 系統的蛋白合成水平仍低于大腸桿菌,一些需要更高蛋白質產量的應用如需要更強輸出信號的無細胞生物傳感器仍然最適用于大腸桿菌系統[89],所以還需對新開發的CFPS 系統有針對性的優化以提高系統的效率和表達水平,將在大腸桿菌CFPS系統中的應用在其他CFPS 系統中進行嘗試,擴大CFPS 系統的應用范圍。
2 模板DNA 的研究進展
DNA 模板的合理設計是提高CFPS 效率的關鍵之一,隨著CFPS 系統的快速發展,模板DNA 在制備和應用方面也取得了一定的進步,如何降低制備成本、提高利用效率是研究者們重點關注的問題,本文將分別討論質粒DNA 模板和線性DNA 模板在CFPS 系統中的研究進展。
2.1 質粒DNA模板
2.1.1 制備大量高純度DNA 在大多數情況下,含有目的基因的超螺旋質粒DNA 由于其良好的穩定性被廣泛用于無細胞系統。質粒DNA 模板是決定CFPS 系統吞吐量的重要因素,當目標是生產大量蛋白質時,質粒DNA 模板是首選。近年來,隨著細胞提取物制備方法的進步以及能量底物成本的降低,大量高純度DNA 變成了CFPS 反應中最昂貴的底物之一,為了解決這一問題,DNA 體外擴增技術被用于生產CFPS 系統中的模板DNA(圖1-a)。滾環擴增(rolling circle amplification,RCA)是一種恒溫核酸擴增方法,該技術以環狀DNA 為模板,利用φ29 高保真DNA 聚合酶和耐外切酶的隨機引物,可以方便地等溫擴增表達質粒[90]。Nojima 等[91]將利用滾環擴增制備的重復DNA 序列用于無細胞轉錄-翻譯偶聯系統,反應效率高于質粒模板和PCR擴增的線性DNA。Kumar 等[92]利用φ29DNA 聚合酶多重引物RCA 從100 ng 的起始材料中擴增出了5 μg 的環狀DNA,擴增出的DNA 生成的轉錄本在體外轉錄-翻譯系統中具有與純化質粒獲得的轉錄本幾乎相同的效率,可以作為蛋白質合成的高質量模板。Su’etsugu 等[93]在體外用14 種純化的酶重構了基于oriC 的大腸桿菌基因組復制循環(圖1-a),并證明了這種復制周期反應(replication-cycle reaction,RCR)可以選擇性地擴增由多片段組裝反應構建的環狀分子。OriCiro Genomics 基于此開發了一種無細胞克隆系統,該系統通過多個重疊DNA 片段的無縫組裝和RCR 擴增,在一天內可以得到與從大腸桿菌中分離的質粒DNA 相同的超螺旋DNA(表2)。

圖1 質粒DNA 模板在CFPS 系統中的研究進展Fig.1 Research progress of plasmid DNA template in CFPS system
2.1.2 質粒DNA 模板的高效克隆 質粒DNA 模板制備的另一個研究進展是快速高效克隆(表2)。質粒DNA 模板制備需要設計、構建、轉化與提取等步驟,這個過程往往耗時又耗力,如何縮短質粒DNA模板的制備周期以加速其在CFPS 系統中的應用逐漸成為了研究者們關注的焦點。由Invitrogen 開發的Gateway 克隆系統可以利用整合酶一步插入所需基因到載體中(圖1-b),為實現高通量的基因功能分析和快速的蛋白質表達提供了平臺[99]。Goshima 等[50]利用該平臺高通量生產了33 275 個入門克隆(entry clone),這些克隆隨后用于人類蛋白的無細胞表達,進行體外蛋白質組學研究。除此之外,GoldenGate克隆系統也被證明可以用于CFPS 中,GoldenGate克隆系統采用IIS 型限制性內切酶在識別序列外部切割DNA,可以做到高效無痕組裝[100](圖1-b)。Freemont 團隊基于GoldenGate 克隆系統開發了一種試劑盒EcoFlex,該試劑盒包含一個簡化的DNA 模塊化包(啟動子、RBS、終止子等),可以用于以大腸桿菌細胞為底盤的CFPS 中[94]。Dudley 等[95]也基于GoldenGate 克隆系統開發了一種適用于植物蛋白表達的DNA 組裝工具包,該工具包含有用于大腸桿菌或小麥胚芽CFPS 系統的質粒受體和用于純化、檢測和提高可溶性蛋白產量的標簽,研究者們利用該工具包優化了一系列植物蛋白的表達。這些基于GoldenGate 克隆系統開發的試劑盒/工具包將DNA部件的自動化組裝和無細胞反應結合,顯著加速了蛋白功能的表征以及組合路徑的優化。

表2 質粒DNA 模板在CFPS 系統中的制備策略Table 2 Plasmid DNA template preparation strategies in CFPS system
2.1.3 質粒DNA 模板與水凝膠結合 將質粒DNA模板與水凝膠材料結合構建更高效可控的CFPS 平臺是質粒DNA 模板制備的又一個新的研究進展。水凝膠是一種很有前途的生物相容性材料,近年來已被證明可以用于CFPS 系統中為蛋白質合成提供一個高通量表達、可循環使用的腔室微環境[101]。已有研究將模板DNA 與水凝膠結合使其固定在一個區域化和局部化的空間中來進行無細胞蛋白表達,Luo團隊通過線性化質粒的共價連接制備了DNA 水凝膠[102-103];Thiele 等[104]制備了透明質酸水凝膠微球作為原始細胞的“細胞核”,線性化的質粒通過共價鍵附著在微球上。然而,由于質粒的線性化或共價連接,這些系統在轉錄和翻譯方面效率較低,為了避免這種情況,一些不需要質粒線性化且制備簡單的水凝膠系統不斷被開發出來(表2)。Yang 團隊開發了一種黏土水凝膠系統作為CFPS 的有效平臺(圖1-c)[96],該系統中黏土微凝膠的制備以及質粒與黏土微凝膠的結合都只涉及簡單的靜電相互作用,由于質粒集中在微凝膠內具有較高的局部濃度且黏土微凝膠保護了質粒不被裂解液中的脫氧核糖核酸酶消化[105],該系統顯著提高了蛋白質生產水平。該團隊在此基礎上構建的基因/黏土/磁性納米顆粒(magnetic nanoparticle,MNP)微凝膠系統也為回收再利用微凝膠、實現重復生產蛋白質提供了可能[96]。Lu 團隊也利用納米黏土的凝膠荷電特性將質粒固定在了納米黏土表面,通過增加無細胞體系中的局部基因濃度使蛋白質產量增加1.75 倍[97]。該團隊還開發了聚N-異丙基丙烯酰胺(pNIPAM)水凝膠系統來攜帶質粒DNA[98](圖1-c),pNIPAM 隨著溫度升高會發生體積相變(volume phase transition,VPT),利用這一特性質粒可以固定在水凝膠表面形成聚集態。當包被質粒濃度為10-20 ng/μL 時,無細胞蛋白產量比液相體系提高了兩倍,蛋白質合成的有效時間也翻了一番。將質粒DNA 模板與水凝膠結合不僅可以增加蛋白質產量和實現蛋白的重復生產,還能為研究者們提供功能或結構上的好處(例如生物相容性或黏接特性),為構建高效可控的CFPS 平臺用于功能性蛋白的表達和檢測提供了新的思路。
2.1.4 質粒DNA 模板的來源 除了質粒DNA 模板的制備方法會影響CFPS 系統的蛋白質生產,已有研究發現質粒的來源也會影響無細胞蛋白表達水平(圖1-d)。質粒的轉錄受宿主背景的影響和宿主因子的調控[106],因此來自不同宿主背景的表達質粒在進行無細胞蛋白表達時會出現一定的差異(表2)。Zhang 等[89]選擇了大腸桿菌常見的7 個感受態細胞來檢測不同質粒來源對基于大腸桿菌、枯草芽孢桿菌、谷氨酸棒狀桿菌細胞提取物系統蛋白表達水平的影響,結果顯示不同感受態細胞的蛋白產量相差近兩倍。Failmezger 等[57]從需鈉弧菌和大腸桿菌中均純化了質粒用于基于需鈉弧菌細胞提取物系統的無細胞蛋白表達,結果表明當質粒來源于需鈉弧菌時的蛋白表達量比來源于大腸桿菌要好40%,由此可以推測,兩種物種之間限制修飾系統的差異會影響質粒的穩定性,進而影響轉錄和翻譯性能,所以在進行無細胞蛋白表達時最好選擇與它所應用的CFPS 系統具有相同細胞來源的表達質粒。
2.2 線性DNA模板
CFPS 系統與體內系統相比的一個獨特優勢是它能夠直接利用線性DNA 模板來實現蛋白的表達,線性DNA 模板省去了質粒構建、驗證和提取步驟,可以通過PCR 在體外數小時內高效合成,大大加快了遺傳電路原型制作周期[107],也使有毒蛋白的表達和分析成為可能。然而,細胞中的內源性核酸酶會降解線性DNA 模板,使蛋白表達量大大降低。由于使用線性DNA 模板替代質粒DNA 模板具有顯著的優勢,許多提高線性DNA 模板在CFPS 系統中穩定性的方法已經被開發出來[108-109](表3),主要包括基因組改造、添加核酸酶抑制劑、對線性DNA 模板進行修飾和設計以及添加DNA 結合蛋白4 個方面(圖2)。

表3 CFPS 系統中穩定線性DNA 模板的策略比較Table 3 Comparison of different linear DNA template protection strategies in CFPS system
2.2.1 基因組改造 早期的工作主要集中于對大腸桿菌的基因組改造上(圖2-a),大腸桿菌的內源性外切酶復合物RecBCD 對線性DNA 具有很高的降解率[119-120],Michel-Reydellet 等[110]通過λ-Red 重組系統替換了大腸桿菌基因組中的recBCD基因,基于此突變菌株的提取物系統與野生型提取物相比,線性DNA 模板的蛋白質產量超過3 倍。Ahn 等[113]制備了一個RNase 缺陷的大腸桿菌菌株的細胞提取物,通過減少mRNA 的降解提高了蛋白質產量。但這些突變菌株的生長缺陷使制備提取物的周期變長,其蛋白質合成活性也明顯降低[122]。
2.2.2 添加核酸酶抑制劑 與基因組改造相比,抑制提取物中的核酸酶往往更易于操作和推廣(圖2-b)。應用最廣泛的核酸酶抑制劑為噬菌體λ 蛋白GamS,在大腸桿菌提取物中加入純化的GamS 蛋白,可以使PCR 模板達到與質粒DNA 模板相當的蛋白質合成水平[122]。雖然此種方法效果較好,但需要重組表達和蛋白純化步驟,開發更為簡易有效的核酸酶抑制劑仍是研究者們關注的焦點。已有研究發現RecBCD 的活性可以被有機小分子所抑制[111],Shrestha 等[123]選擇了兩種最具抑制性的分子(CID 697851 和CID 1517823)添加到無細胞反應中,與沒有RecBCD 抑制劑的反應相比,線性DNA 模板的表達提高了200%。Marshall 等[112]證明了一個包含多個Chi 位點的短dsDNA 序列可以穩定線性DNA模板,并大大提高不同蛋白質產物的生物合成,盡管線性DNA 模板的蛋白質產量仍然小于質粒模板,但生成Chi DNA 成本低廉,使用簡單,可以作為標準成分納入CFPS 反應。
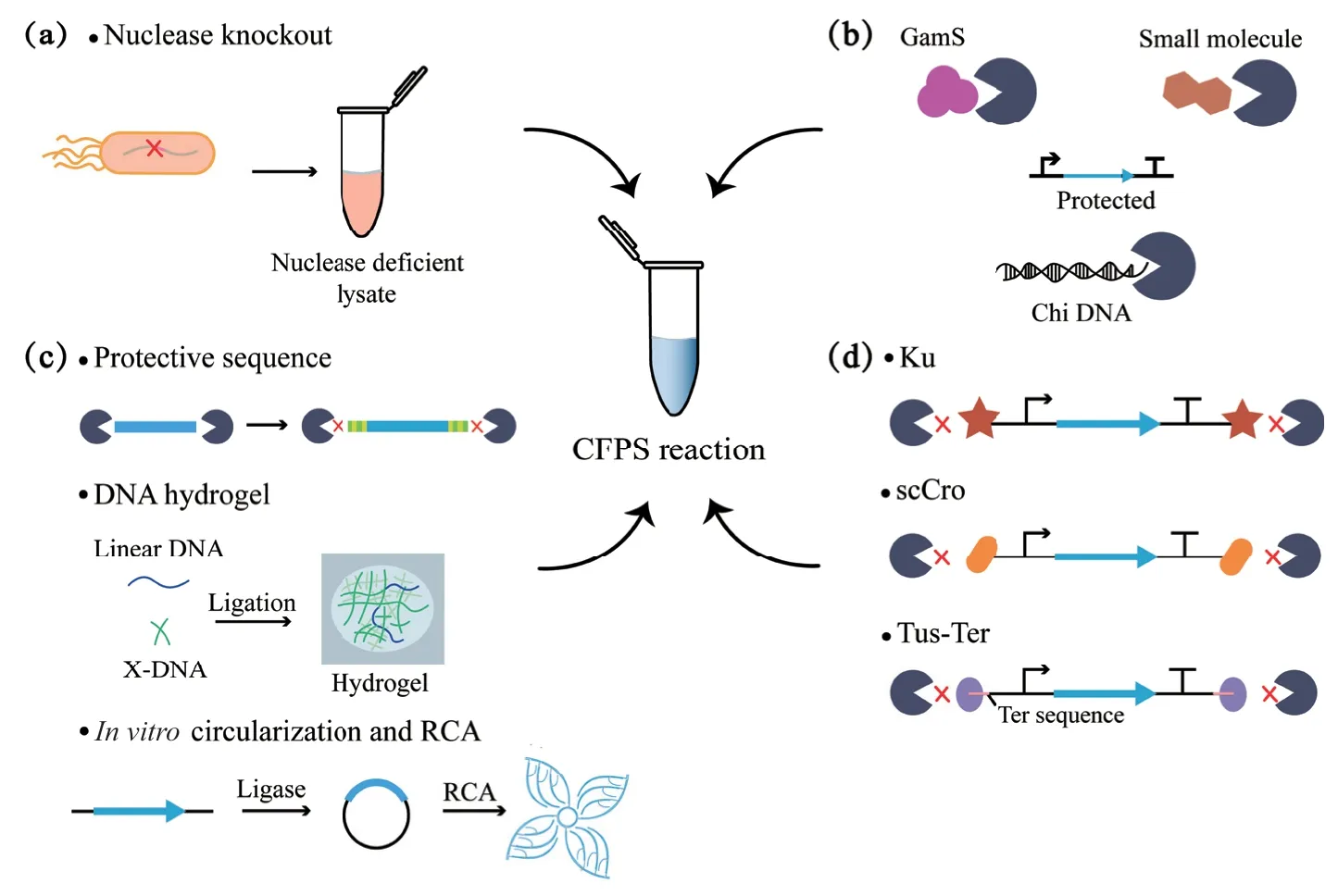
圖2 CFPS 系統中保護線性DNA 模板的研究進展Fig.2 Research progress of protecting linear DNA template in CFPS system
2.2.3 對線性DNA 模板進行修飾和設計 對線性DNA 模板進行修飾和設計可以降低其對核酸酶降解的敏感性,從而提高線性DNA 模板在CFPS 反應中的穩定性(圖2-c)。通過對線性DNA 模板進行合理設計可以延長mRNA 的半衰期從而提高蛋白質產量,Ahn 等[113]發現T7 終止序列和Poly(G)序列的加入可以增強mRNA 的穩定性,分別使蛋白產量提高近2 倍和3 倍。核酸酶與線性DNA 的結合位點往往位于線性DNA 的末端,因此在線性DNA 末端合理設計保護序列也是一種保護線性DNA 不受核酸酶侵害的有效方法。Chen 等[114]運用電腦模擬和實驗驗證相結合的方法合理設計了線性DNA 末端的保護序列,包括GC 含量、GC 排列、GC 分布和莖環結構,該序列設計策略可將線性DNA 模板的蛋白表達量提高到質粒的75%。該團隊在篩選影響位點特異性非天然氨基酸嵌入效率的因素時,也利用了添加保護序列的線性DNA 作為模板[124],進一步證實了該方法的可行性和有效性。Luo團隊將線性DNA與X-DNA交聯成水凝膠進行無細胞蛋白表達,解決了線性DNA 模板的溶解度限制和對核酸酶降解的脆弱性,結果蛋白質產量增加了近300 倍[102],之后開發的黏土水凝膠[105]和混合水凝膠[125]也被證明可以作為批量或連續蛋白表達的可循環基因載體。除此之外,已有研究發現將線性DNA 連接成環、滾環擴增(RCA)后用于CFPS 反應中,可解決線性DNA 模板被核酸酶降解的問題,并可以在省去質粒克隆步驟的同時達到和質粒模板相當的水平[115,126]。
2.2.4 添加DNA 結合蛋白 DNA 結合蛋白通過結合在線性DNA 模板的兩端,可以使其免受核酸酶的降解(圖2-d)。隨著新的細胞提取物系統不斷被開發出來,DNA 結合蛋白對線性DNA 模板的保護不再僅局限于大腸桿菌CFPS 系統[56,87]。一種DNA結合蛋白Ku 已被證明可以保護dsDNA 末端不受分枝桿菌解旋酶/核酸酶AdnAB 的降解[127],Yim等[116]基于此發現評估了Ku 在CFPS 反應中對線性DNA 模板的保護能力,結果發現雖然Ku 在大腸桿菌CFPS 中不如GamS 和Chi DNA 有效,但其在多種細菌的CFPS 中都展現了一定程度的線性DNA保護能力,特別是在革蘭氏陽性菌株枯草芽孢桿菌和谷氨酸棒狀桿菌的CFPS 反應中,與不加DNA 結合蛋白的對照組相比,Ku 保護的線性DNA 模板的基因表達水平分別提高了4.43 倍和1.58 倍。Zhu等[117]鑒定了一種DNA 結合蛋白——單鏈Cro 蛋白(scCro),該蛋白除了在大腸桿菌CFPS 系統中展現了優秀的線性DNA 模板保護能力,在需鈉弧菌CFPS 系統中也展現了很好的適用性,使sfGFP 的表達量增加了18 倍。Norouzi 等[118]基于“Tus-Ter”大腸桿菌DNA 復制終止系統開發了一種在CFPS 中保護線性DNA 的方法,通過將Ter 序列附加到線性DNA 模板的末端,并與Tus 蛋白結合,可以保護線性DNA 模板不被外切酶降解。該Tus-Ter 線性DNA模板保護策略在大腸桿菌和需鈉弧菌的CFPS 中都很有效,可以達到與質粒模板相似或更高的蛋白表達。
3 總結與展望
過去的十年里,CFPS 系統取得了的巨大技術進步,逐漸向著更大規模、更短時間、更低成本的方向發展。其應用領域也不斷擴大,從合成重要蛋白質、蛋白質高通量篩選以及生產蛋白類藥物,到如今在人造細胞、遺傳網絡、生物傳感、生物制造,甚至是合成生物學教育方面的應用[4],都體現出了CFPS系統替代傳統生物系統的無限潛力。
CFPS 系統在取得巨大進展的同時也面臨著許多挑戰。為了生產更多更復雜的蛋白質、探索更豐富的生物合成路徑,許多新的細胞提取物系統被開發出來,但這些新的細胞提取物系統的蛋白產量與大腸桿菌系統仍有差距,大腸桿菌作為目前唯一能夠達到與活細胞蛋白產量相當的無細胞底盤,依然是蛋白表達的最優選擇。目前研究者們對其他細胞提取物系統的探索還處于起步階段,如何進一步將它們的活細胞功能重現在無細胞體系中還需要做更多的工作,比如細胞提取物制備方案要根據不同的底盤細胞進行修改、對提高蛋白產量的輔助因子進行探索等。同時,為了進一步加快CFPS 系統的反應周期和降低CFPS 系統的成本,模板DNA 的制備步驟也逐漸簡便化,并且可以根據不同的細胞提取物系統進行調整。但這也意味著模板DNA 的制備不再遵循統一的原則,使得制備策略還不能標準化的納入CFPS 反應。此外,目前CFPS 系統主要致力于研究單個基因的表達,使制備策略也局限于單個基因的模塊化構建,后續可以對一些基因組DNA 和大片段DNA 的制備策略進行研究,將有助于擴大CFPS系統在噬菌體人工合成和多基因功能性表達方面的應用。
總之,CFPS 系統已經成為了體外蛋白表達的有效平臺,并且正在向著更廣闊的領域繼續發展。合成生物學領域新技術的不斷涌現使CFPS 系統的各個環節都取得了一定的技術進展,CFPS 系統的進步也將給合成生物學領域帶來新的機遇。

