黃褐土玉米秸稈腐解菌株篩選及其促腐能力研究
張倩 徐春燕 張鐸 王亞會 梁新盈 李慧
(河南農業大學資源與環境學院,鄭州 450002)
我國是傳統的農業大國,糧食年產量位居世界首位,秸稈年產量超過9 億t,作物秸稈含有豐富的氮磷鉀養分,養分含量相當于全國化肥養分總量的25%[1]。作為農業生產中重要的生物資源,在提高土壤肥力、改善土壤結構、激發土壤微生物活力等方面發揮著重要作用[2],但是,研究表明自然狀態下粉碎秸稈還田300 d,其碳氮釋放率僅約80%[3],影響耕作和下茬作物萌發,作物生長與秸稈腐解同期進行還易造成微生物與作物生長爭氮,減緩秸稈養分在土壤中的轉化速率,當前,秸稈如何高效原位腐解是制約其資源化利用的瓶頸問題。
秸稈腐熟菌劑通過多條生物化學途徑實現對秸稈纖維素、半纖維素和木質素等物質的分解,是目前加速秸稈腐解及養分釋放的最便捷、有效的途徑。從自然界篩選到的秸稈腐熟菌種包括細菌芽孢桿菌屬、假單胞菌屬、纖維單胞菌屬、瘤胃球菌屬等,以及真菌青霉菌屬、木霉屬、曲霉屬、枝頂孢霉屬等[4-6]。然而,我國幅員遼闊,土壤環境差異巨大,不同菌株的適宜生長條件各不相同,在目標地分離的菌株對原有環境的適應性更強,不僅易于存活還可避免對土著微生物群落的擾動,可有效解決外源菌株應用效果不佳的問題。李正風等[7]從煙草秸稈自然發酵物中篩選到高效產纖維素酶細菌Luteibactersp.L43 用于煙草秸稈腐熟。胡佳俊[8]從海水及其沉積物中分離馴化獲得了非光合CO2同化的高效固碳微生物菌群,發現其對混合無機碳源的同化效率顯著高于單一碳源。李娜等[9]基于小興安嶺山區土壤分離到1 株在低溫下具有較強纖維素降解能力的真菌,對秸稈的降解能力達55.6%。顧文杰等[10]通過拮抗實驗篩選構建了能夠適應南方酸性土壤的高效復合半纖維素降解菌系。青格爾等[11]將篩選到的玉米秸稈低溫降解復合菌系進行室內土培接種實驗,發現其可有效加快秸稈分解,提高土壤微生物群落多樣性。
黃褐土是黃淮海糧食主產區的典型土壤類型之一,占地約380 萬hm2,第二次土壤普查以來,黃褐土已經出現了酸化態勢,pH < 5.5 的占地面積達7.08 萬hm2[12],黃褐土土壤黏粒和粉砂較多,保肥性較強,但土壤易板結[13],并且光熱資源不足造成了玉米-小麥輪作茬口緊、還田玉米秸稈腐解速率慢等問題,導致了小麥出苗困難、越冬受阻,目前商品用秸稈腐熟菌株在黏板酸化土壤上的定殖效果不佳,無明顯促腐效果[14-15]。因此,本文基于連續8年秸稈還田的黃褐土,結合選擇性平板、濾紙和秸稈崩解定性分析、酶活性定量測定、種屬鑒定等方法篩選優勢玉米秸稈腐解菌株,通過土培試驗驗證其實際促腐效果,彌補外源腐解菌土壤定殖能力弱、促腐效果差及作物生長不良等缺點,為障礙黃褐土麥玉輪作區秸稈腐熟菌劑開發和應用提供理論基礎,促進秸稈類農田廢棄物資源化利用。
1 材料與方法
1.1 材料
1.1.1 土壤樣品采集 土壤采自黃褐土小麥-玉米輪作長期定位試驗,試驗地點位于河南省方城縣趙河鎮現代農業示范園區(33°08′N,112°58′E),處于亞熱帶大陸性氣候帶,年平均日照時數為2 092 h,年均氣溫14.4℃,年均降雨量803.9 mm 左右,無霜期220 d。小麥季,化肥氮(N)、磷(P)、鉀(K)用量為每年施用N 117 kg/hm2,P2O590 kg/hm2,K2O 75 kg/hm2,玉米秸稈(切碎成3-5 cm)全量還田,折合總氮投入為180 kg/hm2,氮肥基追比5∶5,拔節期開溝條施追肥。玉米季,肥料用量為每年施用N 210 kg/hm2,P2O575 kg/hm2,K2O 90 kg/hm2,其中磷肥、鉀肥于五葉期一次性溝施,氮肥分別在玉米五葉期和抽雄期條施(5∶5),氮磷鉀肥料分別為尿素、過磷酸鈣和氯化鉀。2019年小麥收獲季采集土壤樣品用于土著高效玉米秸稈腐解菌株篩選,供試土壤pH 5.81,有機質22.04 g/kg,全氮1.43 g/kg,堿解氮127.31 mg/kg,速效磷28.00 mg/kg,速效鉀285.14 mg/kg。
1.1.2 培養基 主要培養基配置方法如下:(1)LB培養基:蛋白胨10 g、酵母膏5 g、NaCl 10 g、蒸餾水1 000 mL(若用固體培養基則增加20g 瓊脂),pH 自然。(2)羧甲基纖維素鈉(CMC-Na)液體培養基:CMC-Na 15.0 g、K2HPO41.0 g、MgSO4·7H2O 0.5 g、NaNO33.0 g、KCl 0.5 g、FeSO40.01 g、蒸餾水1 000 mL。(3)CMC-Na 分離培養基:CMC-Na 15.0 g、K2HPO41.0 g、MgSO4·7H2O 0.5 g、NaNO33.0 g、KCl 0.5 g、FeSO40.01 g、瓊脂15.0 g、蒸餾水1 000 mL。(4)玉米秸稈粉培養基[16]:KH2PO41.0 g、MgSO4·7H2O 0.4 g、CaCl20.1 g、FeCl30.01 g、NaCl 0.2 g、(NH4)2SO43.0 g、玉米秸稈粉20.0 g、瓊脂18.0 g、蒸餾水1 000 mL。(5)剛果紅固體培養基:(NH4)2SO42.0 g、MgSO4·7H2O 0.5 g、K2HPO41.0 g、NaCl 0.5 g、CMC-Na 2.0 g、剛果紅0.2 g、瓊脂20.0 g,蒸餾水1 000 mL,pH 自然。(6)濾紙崩解液體培養基:(NH4)2SO41.0 g、MgSO4·7H2O 0.5 g、KH2PO41.0 g、酵母膏0.1 g、蒸餾水1 000 mL,pH 自然。(7)秸稈崩解液體培養基:玉米秸稈0.5 g、KH2PO41.0 g、MgSO4·7H2O 0.5 g、NaNO33.0 g、KCl 0.5 g、FeCl3·6H2O 0.01 g,蒸餾水1 000 mL[17]。以上培養基均于121℃高壓滅菌30 min 后備用。
1.2 方法
1.2.1 纖維素降解菌株分離與純化 稱取新鮮土壤樣品10 g 于250 mL 錐形瓶(裝有90 mL 無菌水和幾粒玻璃珠),200 r/min 震蕩1 h,靜置2 h。取1 mL 上清液加入裝有9 mL 無菌水的試管中,成10-1倍稀釋液。混勻后,再取1 mL 加入裝有9 mL 無菌水的試管中,即成10-2倍稀釋液,按上述方法稀釋到10-9倍。
菌株篩選方案1:取10-1、10-3、10-5、10-7、10-9稀釋液涂布于CMC-Na 固體分離培養基上,每個稀釋度重復3 次,28℃下黑暗培養5-7 d。長出菌落后,根據菌落形態特征挑取單個菌落接種在LB純化培養基,反復劃線分離至長出單一菌落。方案2:取8 g 土樣,加3 g 玉米秸稈段及100 mL 蒸餾水,160 r/min 震蕩富集10 d,將土樣溶液稀釋成10-3、10-4、10-5和10-6共4 個梯度,再依次取100 μL 涂布于玉米秸稈粉培養基上,37℃條件下培養2 d,將長勢較好的單菌落反復劃線分離至長出單一菌落[18]。方案3 取10-5-10-7的土壤溶液稀釋液,涂布于秸稈粉培養基上,置于30℃恒溫培養箱中培養4 d,挑選出生長旺盛的菌株接種至秸稈粉培養基平板上,多次平板劃線分離純化。最后將篩選獲得的純細菌菌落保存至LB 培養基(含20%甘油)中,-80℃冷凍保藏。
1.2.2 秸稈腐解菌株的初篩 將純化后的菌株點接在剛果紅固體培養基,每個菌株3 次重復,28℃倒置培養3-5 d 后,觀察菌落周圍是否產生水解圈,記錄透明圈直徑(D)與菌落直徑(d)比值的大小,初步篩選出纖維素降解能力強的菌株。
1.2.3 濾紙條和玉米秸稈崩解復篩 挑取單菌落接種于LB 培養基中,37℃、160 r/min 培養24 h 后,制備菌懸液。按10%的接種量將菌懸液接種于90 mL 濾紙條崩解培養基/秸稈崩解液體培養基中,并放入6 條濾紙條(1 cm×6 cm)/0.5 g 玉米秸稈(約0.5 cm×3.0 cm 的條狀),于28℃、120 r/min 條件下恒溫振蕩培養,每個菌株3 次重復,以接入10 mL 滅菌水為對照,定期觀察濾紙條/玉米秸稈崩解情況。
1.2.4 秸稈高效腐解菌酶活性測定 將所篩菌株的菌懸液吸取5 mL 于液體產酶培養基培養3-4 d 后,于8 000 r/min 離心15 min,所得上清液即為粗酶液。基于DNS 顯色法[19],結合不同的底物,分別測定所篩菌株的濾紙酶、內切酶、外切葡聚糖酶、β-葡萄糖苷酶和木聚糖酶活性。
向25 mL 具刻度試管中分別添加0.05 g 新華1號濾紙和2 mL 醋酸-醋酸鈉緩沖液(0.05 mol/L,pH4.8)、1% CMC-Na 溶液、0.05 g 脫脂棉和2 mL 檸檬酸緩沖液(0.05 mol/L,pH4.5)、2 mL 水楊苷溶液(1%)、1 mL 木聚糖溶液(1%)作為上述5 種酶活性的底物和緩沖液,添加0.5 mL 粗酶液后,超聲震蕩30 s,將試管50℃水浴0.5 h,加入3 mL DNS 試劑,沸水浴10 min 后置冷水中冷卻,蒸餾水定容至25 mL。另取等量底物加入刻度管,并向管中加入3 mL DNS 后再加入等量粗酶液混勻以終止酶反應,與試驗組在同等條件下進行反應。試驗組和對照組均于波長為540 nm 下測定吸光度值。同樣利用DNS 方法,制作葡萄糖和木聚糖溶液的標準曲線。酶活力單位用U,定義為在50℃條件下,1 mL 粗酶液1 min 內催化底物水解生成1 μg 葡萄糖/木聚糖的粗酶量。
酶活力(U)= m·n·1 000/(t·v);式中m為葡萄糖或木聚糖質量,n 為分取倍數,t 為反應時間30 min,v 為粗酶液量0.5 mL。
1.2.5 菌株實際秸稈促腐能力 取烘干玉米秸稈12.0 g(長度1-2 cm)裝在250 目尼龍網袋中,將網袋平鋪放置于裝有6.0 kg 土壤的盆中,每個處理加入秸稈崩解液體培養基(去除CMC-Na)30 mL 和相應菌液10 mL,腐解菌株終濃度1.0×108CFU/g 秸稈,覆土3 cm(新鮮土壤提前調節為田間持水量的60%),對照組用等量蒸餾水代替菌液,25℃培養,每2 d 稱重調節土壤含水量,分別在7、14、21、28 d 后取出,洗凈烘干至恒重,測定秸稈包內玉米秸稈質量變化動態,計算秸稈腐解速率。
1.2.6 菌株的鑒定 將純化后的秸稈腐解菌株活化,在LB 培養基平板上劃線法接種菌株,在28℃的培養箱中培養2-3 d,直至在平板上生長出清晰的單菌落,觀察菌落的性狀、大小、隆起性狀、表明透明度、邊緣及菌落顏色等形態特征。所篩菌株的革蘭氏染色、過氧化氫酶反應、甲基紅、乙酰甲基甲醇、淀粉水解、明膠水解、硝酸鹽還原、檸檬酸鹽利用試驗分析參照文獻[19]進行,表征菌株的形態學與生理生化特性。
將初篩所得菌株接種至LB 培養基,28℃、180 r/min 震蕩培養至OD = 0.8,分別取1 mL 菌液,12 000 r/min 離心2 min,棄上清液,用天根細菌基因組提取試劑盒提取總DNA,用NanoDrop 檢測DNA 濃度和純度,-20℃保存備用。分別以菌株基因組總DNA 為模板,用細菌16S rRNA 基因通用引物27F/1492R 擴增,電泳檢測合格后測序。將序列在Ribosomal Database Project(RDP)中對比以獲取同源序列,使用MEGA X 軟件,基于Neighbour-Joining法構建系統發育樹(bootstrap consensus tree),并根據系統關系確定分類地位。
1.2.7 數據分析與處理 文中利用Excel 2016、SPSS、Origin 9.0 進行統計、分析和作圖。
2 結果
2.1 玉米秸稈纖維素高效降解菌初篩
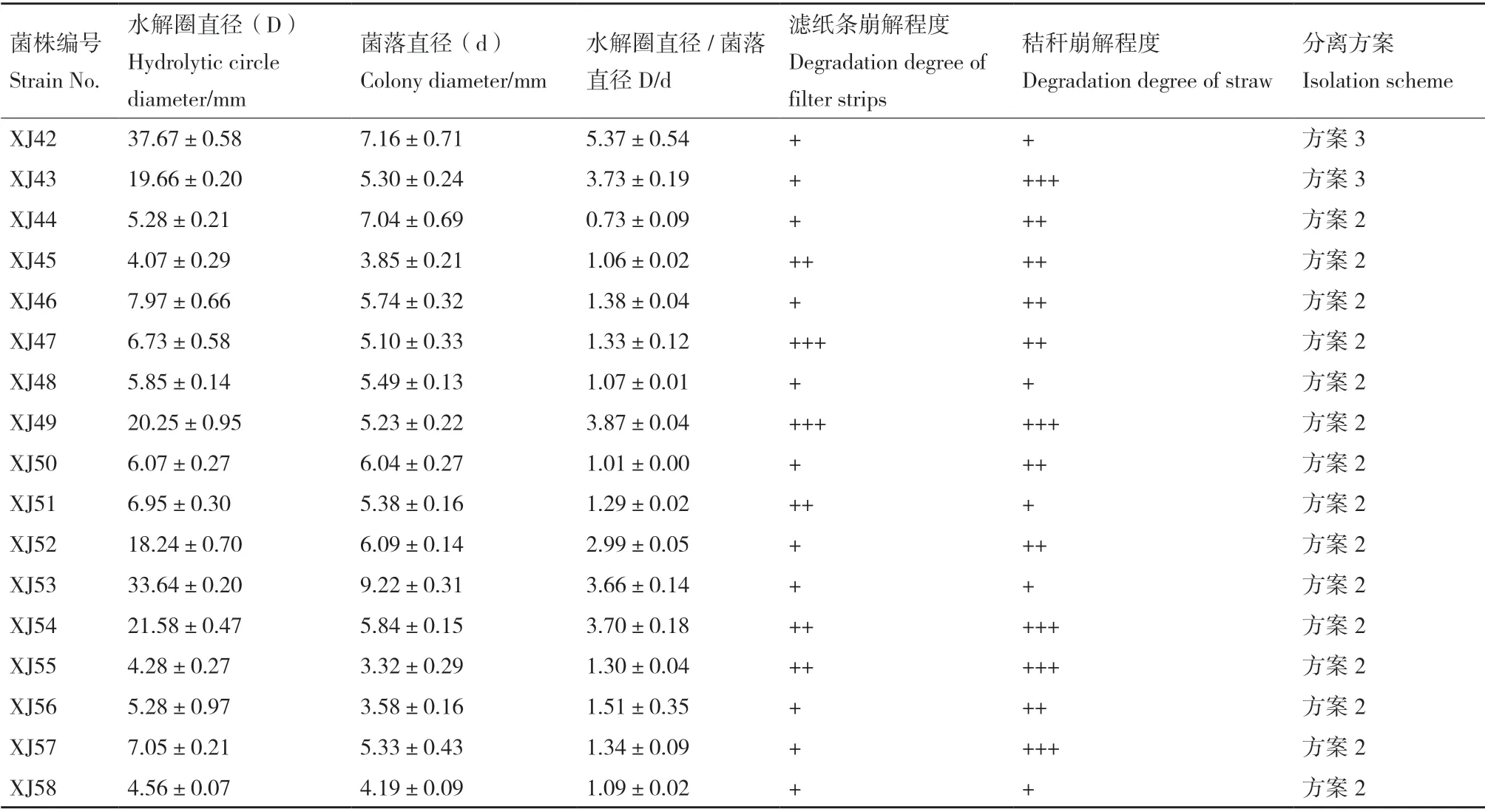
基于長期還田的黃褐土土壤樣品,通過不同方案分離并純化獲得生長能力強的單一菌株58 株,依次編號為XJ1-XJ58。利用剛果紅染色法初步將所得具纖維素降解能力的細菌進行初篩,以菌株培養4 d 后透明圈直徑/菌落直徑(D/d)> 1 為判定界限,發現57 株菌株具有纖維素降解能力,其中D/d 值大于2.0 的菌株36 株,大于3.0 的菌株29 株(表1),如圖1所示,菌株XJ9、XJ12、XJ13、XJ37 的D/d值大于8.0。

圖1 部分優勢菌株在纖維素剛果紅培養基上產生的水解圈Fig.1 Hydrolysis circles of dominant strains on cellulose Congo red medium
2.2 玉米秸稈纖維素降解菌復篩
對初篩得到的58 株纖維素降解菌進行濾紙條和秸稈崩解能力復篩,記錄培養7 d 后的濾紙條崩解程度和培養10 d 后的秸稈崩解程度(表1),發現約一半菌株對濾紙條有一定的降解能力,其中以XJ9、XJ12、XJ14、XJ16、XJ31、XJ34、XJ36、XJ37、XJ39、XJ49 等15 株菌株的濾紙條崩解能力更強,培養7 d 后濾紙條整體膨脹并已下彎,部分濾紙條破碎,瓶底出現紙屑。此外,XJ1、XJ2、XJ5、XJ8、XJ13、XJ14、XJ15、XJ16、XJ21、XJ22、XJ27、XJ28、XJ43、XJ49、XJ54、XJ55、XJ57 共17 株菌株的玉米秸稈崩解能力更強,三角瓶中玉米秸稈出現明顯的秸稈碎屑,培養基液體明顯渾濁,部分優勢菌株接種下玉米秸稈的崩解效果如圖2所示。

表1 各菌株接種下剛果紅水解圈、濾紙條和玉米秸稈崩解情況Table 1 Hydrolytic circle diameter of strains on Congo red medium,and degradation degrees of filter strips and maize straw with different strains inoculated
續表Continued

圖2 優勢菌株接種下玉米秸稈降解效果Fig.2 Degradation results of maize straw with domi-nant strains inoculated
2.3 玉米秸稈纖維素高效降解菌的產酶能力
對比58 株菌株的5 種纖維素降解相關酶活性發現(圖3),整體上,各菌株的內切葡聚糖酶和β-葡糖苷酶活性差異不大,大多數的菌株具有較高的濾紙酶活性,XJ3、XJ13、XJ27 和XJ37 菌株的纖維素降解酶活性均較高,其中,XJ13 菌株的濾紙酶、內切葡聚糖酶、外切酶、β-葡糖苷酶和木聚糖酶活性分別為315.62、222.70、278.86、275.33 和5 252.64 U,XJ37 菌株的各酶活性則為291.47、263.10、211.93、287.27 和17 109.91 U,這與其較高的D/d 比值、濾紙和秸稈崩解程度相一致。菌株XJ6、XJ12 和XJ34的濾紙酶、內切葡聚糖酶、外切酶和β-葡糖苷酶活性均較高,其中XJ6 的濾紙酶、外切酶、β-葡糖苷酶活性均為各菌株中最高,達1 031.33、457.42和571.14 U,XJ34 的內切葡聚糖酶活性最高,達648.34 U。菌株XJ9 和XJ38 的內切葡聚糖酶、外切酶、β-葡糖苷酶和木聚糖酶活性較高,但是濾紙酶活性較低。此外,各菌株木聚糖酶活性差異很大,XJ1、XJ23、XJ29、XJ31、XJ53 和XJ58 菌株表現出較強的木聚糖酶活性,達6203.97 U 以上,但有相當一部分菌株的木聚糖酶活性僅為1 000 U 左右,XJ16-18、XJ20-21、XJ49 菌株僅表現出較高的濾紙酶活性和外切酶活性。綜上,篩選得到的58 株菌株中,XJ6、XJ9、XJ13、XJ27、XJ34、XJ37 菌株產纖維素降解酶能力較強。
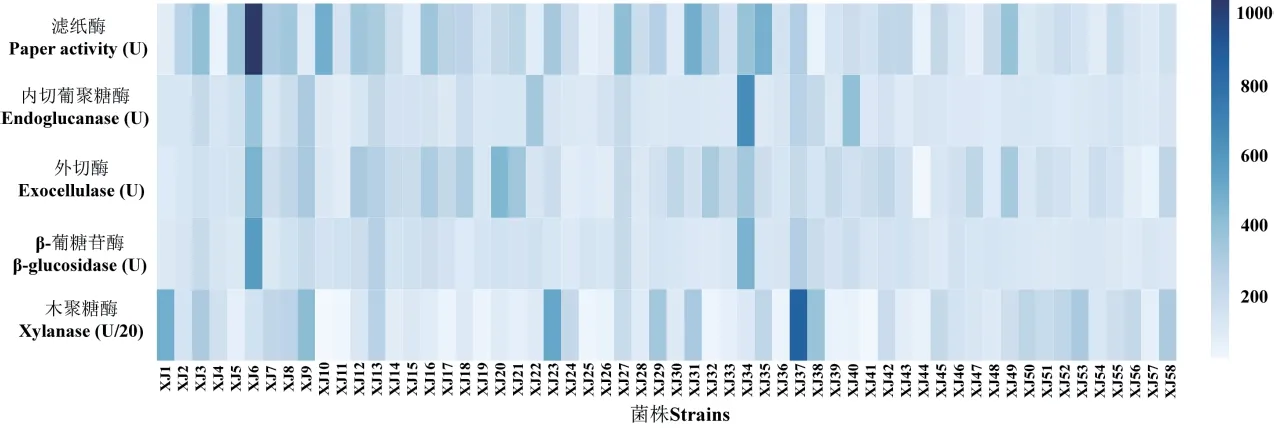
圖3 各菌株的纖維素降解相關酶活性Fig.3 Cellulose-degrading related enzyme activities of different strains
2.4 玉米秸稈高效腐解菌株的鑒定
結合平板初篩、以及各菌株的產酶能力,依據選擇性平板、濾紙和秸稈崩解程度、產酶活性的結果共篩選出高效秸稈腐解菌株22 株(XJ9、XJ12、XJ13、XJ16、XJ31、XJ34、XJ37、XJ3、XJ6、XJ49、XJ27、XJ14、XJ15、XJ18、XJ21、XJ17、XJ1、XJ54、XJ29、XJ2、XJ8、XJ53,排序按照能力由強至弱排列),構建系統發育樹和相似性分析發現(圖4),7 個菌株與Klebsiella variicolaF2R9T相似性極強,結合以上指標結果,選取XJ9、XJ12、XJ34 作為代表菌株;菌株XJ37 與PseudomonasazotoformansIAM1603T相似性強,XJ14、XJ18、XJ21、XJ31 菌株雖與Stenotrophomonas同源,但相似性不夠緊密,因而全部保留用于下一步秸稈腐解土培試驗。菌株XJ29 與Stenotrophomonas rhizophilae-p10T相似性強,菌株XJ27 與Enterococcus italicusTP1.5T相似性高于99%,XJ16 與XJ17 菌株均與Staphylococcus epidermidisATCC 14990T相似性強,選擇XJ16 用于下一步試驗;菌株XJ1 與Staphylococcus capraeATCC 35538T相似性強,XJ3、XJ15、XJ8分別歸屬于芽孢桿菌屬的Bacillus tequilensis10bT、Bacillus aryabhattaiB8W22T和Bacillus cereusATCC 14579T,后續進行土培試驗研究高效秸稈腐解菌株的實際促腐能力。
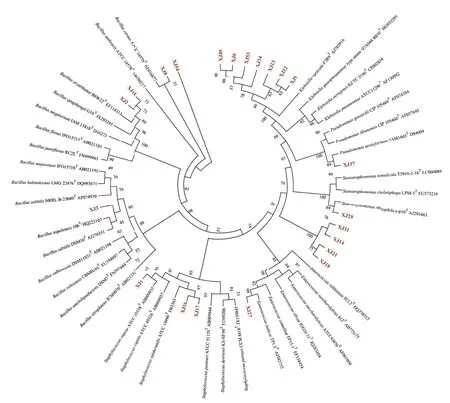
圖4 根據16S rRNA 構建的優勢玉米秸稈腐解菌株的系統發育樹Fig.4 Neighbor-joining phylogenetic tree based on 16S rRNA gene sequences of dominant maize straw-decomposing bacteria
2.5 高效秸稈腐解菌株的實際促腐能力
將上述篩選出的14 株菌株接種入黃褐土中進行秸稈包填埋試驗發現,玉米秸稈在土壤腐解過程中,秸稈由土黃色變成黑褐色,由長條狀變成短狀或碎末狀,同時秸稈硬度逐漸下降并且松散易斷。圖5表明,菌株XJ8(Bacillus cereus)、XJ3(Bacillus subtilis)接種下秸稈的腐解速率較高,較不接種處理分別提高7.58%和6.33%,培養28 d 后,玉米秸稈腐解率達45.58%和44.33%,效果優于其他菌株,2 株細菌的形態學及生理生化特性見表2,菌株XJ3和XJ8 在中國農業微生物菌種保藏管理中心進行保藏,編號分別為ACCC 62095 和ACCC 62096。
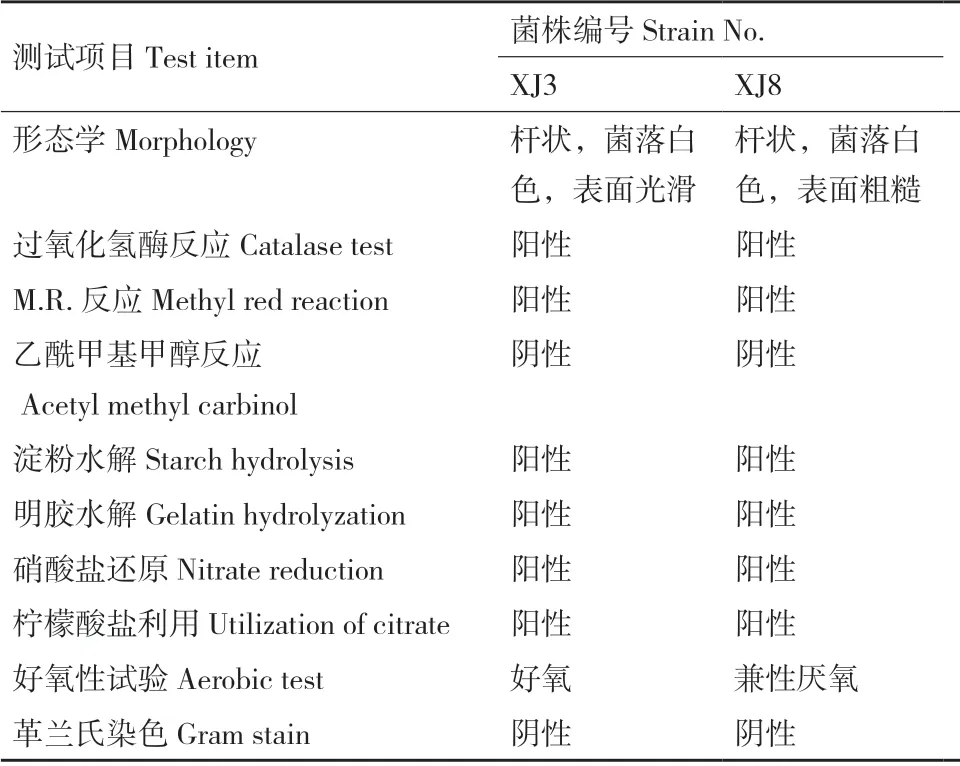
表2 優勢秸稈腐解菌株的形態及生理生化特性Table 2 Morphology and physiological-biochemical characteristics of maize straw-decomposing strains

圖5 不同菌株接種下玉米秸稈腐解速率Fig.5 Maize straw decomposition rates under different strains inoculated
3 討論
直接還田是秸稈資源化利用的有效方式之一,加速還田秸稈的原位微生物腐解過程是其養分高效利用的關鍵,已成為理論研究和應用開發的熱點。商品秸稈腐熟菌劑的菌種單一,田間施用效果參差不齊,如姚云柯等[20]發現施用厚壁菌門芽孢桿菌(Bacillus subtilis、Bacillus licheniformis)以及佛山金葵子牌腐稈劑(菌種包括Bacillus subtilis、Paenibacillus polymyxa和Bacillus brevis),未能顯著提高酸性紅壤的稻秸腐解速率。從障礙性土壤中篩選土著腐解菌株更具有針對性,實踐效果更佳。本文通過將定性/定量分析、現象/機理多手段聯合篩選到XJ8、XJ3 共2 株在障礙黃褐土中具有高效促腐能力的細菌菌株,經鑒定為蠟樣芽孢桿菌(Bacillus cereus)和枯草芽孢桿菌(Bacillus subtilis),28 d 秸稈促腐率為最高為45.58%,相同培養時間下,較韋中等[21]篩選的擬康寧木霉(Trichoderma koningiopsis)和解淀粉芽孢桿菌(Bacillus amyloliquefaciens)的秸稈促腐率高出約12%。除被廣泛應用于秸稈腐熟菌劑和微生物肥料的生產外,枯草芽孢桿菌還可受水楊酸刺激,增強煙草抗青枯病能力[22]。根際蠟樣芽孢桿菌不僅具有促腐秸稈的作用,還可通過植物激素茉莉酸、乙烯、水楊酸途徑誘導植物的根系防御反應,是典型的根際益生菌[23-26]。菌株的促腐效果主要取決于其與土著菌競爭后的存活能力,前期對供試土壤細菌群落進行高通量測序發現,芽孢桿菌(Bacillus)的相對豐度為1.21%,是黃褐土細菌群落的土著優勢屬,這可能提高了其與土著菌群的競爭能力,有利于其在土壤中的定殖。
土壤環境復雜、氣候條件差異巨大,不同微生物類群間存在協作、拮抗、捕食等關系,僅依靠剛果紅、酶活性以及液體培養崩解評價菌株的實際促腐能力有一定的局限性[27-30],存在與土培秸稈促腐效果不一致的情況。本研究中,XJ6、XJ34 菌株的產酶能力較強,但XJ6 的剛果紅水解能力以及液體培養濾紙/秸稈的崩解效果較差,XJ34 菌株的剛果紅水解能力以及液體培養濾紙/秸稈的崩解效果雖表現良好,其秸稈腐解速率卻僅提高了約2%,這可能與高度專一性的誘導型糖苷水解酶類β-葡萄糖苷酶有關,β-葡萄糖苷酶可水解纖維二糖和短鏈纖維寡糖釋放出葡萄糖,但其酶活性一方面受代謝產物的阻遏效應,另一方面也對內切及外切葡聚糖酶具有抑制作用[31-32],XJ6 和XJ34 菌株的β-葡萄糖苷酶活性高達459 U,明顯優于其他菌株,可能導致其土培促腐能力較弱。秸稈成分復雜,木聚糖是秸稈半纖維素中最具代表性的組分之一,降解該物質的木聚糖酶也是半纖維素酶系中含量最多的酶,本文所篩秸稈高效腐解菌株XJ8 和XJ3 表現出了較高的濾紙酶活性和木聚糖酶活性,表明這兩種酶活性可能對促進黃褐土玉米秸稈腐解的貢獻更大。
復合菌系處理秸稈被認為是一種穩定高效的降解手段,顧文杰等[10]構建了互不拮抗的哥斯達黎加鏈霉菌(Streptomyces costaricanus)、亮白曲霉(Aspergillus candidus)和黃藍狀菌(Tarlaromyces flavus)纖維素降解復合菌劑,顯著提高了半纖維素酶活性。另有研究表明,固氮螺菌屬(Azospirillum)和腸球菌屬(Enterococcus)復合菌系的低溫降解玉米秸稈能力較強,更適應于北方高寒區秸稈原位腐解[33]。王新光等[34]構建了枯草芽孢桿菌(Bacillus subtilis)、地衣芽孢桿菌(Bacillus lincheniformis)、蠟樣芽孢桿菌(Bacillus cereus)和黑胡桃鏈霉菌(Streptomyces nogalater)的復合菌系,發現其固體發酵條件下玉米秸稈降解率達63.6%,顯著高于單菌處理,部分驗證了我們所篩菌株的秸稈促腐能力。供試黃褐土酸板黏的環境條件一定程度限制了土壤微生物生長和活動,下一步,將所篩秸稈高效腐解菌株構建復合菌系,探索其最佳功能條件,定量評價復合菌系在黃褐土中的定殖情況,分析在玉米秸稈腐解過程中,微生物群落組成及演替規律,開展其促腐兼具抗性機制研究,將是未來研究的重點。
4 結論
本研究從長期秸稈還田的黃褐土中篩選出兩株玉米秸稈高效腐解菌株XJ8(Bacillus cereus)和XJ3(Bacillus subtilis),XJ8 的28 d 土培秸稈腐解率最高為45.58%,較不加菌土壤,可提高黃褐土土壤中秸稈腐解效率達19.96%,補充了現行商品秸稈腐熟菌種資源庫,對酸性、黏、板黃褐土等障礙土壤中秸稈腐解菌劑的創制和應用提供參考。

