一種水溶性原卟啉聚合物的合成及其在光動力滅活耐藥菌以及癌細胞方面的研究*
施佳皓,路正楠,盛 揚,孫一新,Mark Bradley, 張 嶸
(1. 常州大學 材料科學與工程學院, 江蘇 常州 213100;2. School of Chemistry, University of Edinburgh,Edinburgh EH9 3JJ, UK)
0 引 言
細菌感染一直是困擾人類的難題,特別是近年來,由于抗生素的濫用,多重耐藥菌的數量正在以顯著的速度增加,使這個問題變得更加困難。這些多重耐藥細菌增加了相關疾病的發病率和死亡率。因此需要開發更有效的方法來對抗多重耐藥細菌[1]。光動力療法是一種新興的癌癥治療方法[2]。光動力療法的機理是利用光敏劑通過光照射將周圍的氧分子激發為單線態氧(1O2)等高能物質。1O2極高的細胞毒性對癌細胞造成損傷,導致細胞凋亡,從而達到治療癌癥的效果[3]。同樣的方法也可以用于解決多重耐藥菌的問題,與抗生素相比,產生耐藥菌株的風險更小。近年來,利用各種光敏劑及相關材料進行抗菌光動力治療的研究越來越多,包括共軛化合物[4]、金屬化合物[5]和復合納米材料[6-7]。例如,由仿生多異氰化物 (PIC) 水凝膠和嵌入共軛低聚電解質 (COE)組成的雙組分水凝膠的光動力抗菌膜[8],由于 COE 的引入,水凝膠表現出更高的1O2生成率和更高的殺菌效率。Wen[9]制備了一種硫化鉍銀量子點,它可以在近紅外光下通過光動力和光熱活動滅活細菌。
光敏劑是光動力療法的重要組成部分,其生物毒性是臨床應用的重要考慮因素。作為血紅素和葉綠素的前體,原卟啉 (PPIX)是一種天然高效的光敏劑,具有良好的生物相容性和理想的熒光量子產率。因此,PPIX被廣泛應用于生物醫學領域[10-11]。例如,化合物5-氨基酮戊酸(5-ALA)已在臨床上廣泛用于皮膚病的光動力治療[12]。作為在細胞中形成 PPIX 的起始化合物,注射的 5-ALA 會與體內的物質反應產生額外的 PPIX,其在暴露于光時會產生1O2導致細胞凋亡。此外,董[13]制備了以PPIX為共價鍵核的PEG-co-PCL共聚物水凝膠,實現了體內熒光成像。
但PPIX具有超疏水的表面結構,帶有兩個可電離的羧酸基團,使其不溶于水,在水溶液中易形成面對面的聚集體。卟啉環之間 π-π 相互作用的排列使得聚集的 PPIX 的結構高度穩定[14-15]。然而,PPIX的這種π-π積累導致熒光猝滅,大大降低了熒光強度,限制了其應用。使用水溶性或水分散性載體攜帶PPIX進行體內釋放是阻止PPIX分子間相互作用的方法之一。楊[16]以碳量子點為載體結合PPIX,研究其人體內的光動力活動。用納米顆粒封裝 PPIX 也是一種常用方法[17]。但是,這些方法需要考慮PPIX加載和釋放效率等問題。PPIX通過水溶性基團改性以提高其水溶性也是一種有效的方法。已研究合成的水溶性PPIX化合物[18-19]仍保持了PPIX優異的熒光特性,在光動力治療和熒光成像研究中發揮了良好的效果。因此,水溶性PPIX衍生物的合成將對PPIX的臨床應用具有重要意義。
卟啉聚合物[20-21]具有較高的共軛度、高比表面積、高孔隙率等特點,被廣泛應用于儲能材料。受此啟發,我們設計并合成了一種PPIX聚合物,該聚合物能有效提高親水性并減弱π-π堆積效應以阻止團聚。本文通過PPIX與PEG酯化反應生成親水性預聚物二醇,再與二異氰酸酯聚合得到聚氨酯,合成水溶性PPIX聚合物。由于PU等聚合物鏈段阻礙了PPIX單元的π-π積累,提高了PPIX聚氨酯的光動力活性。研究了對細菌和癌細胞的1O2生成速率和光動力滅活效果。結果表明水溶性PPIX-PEG多元醇及其PPIX-PEG-PU具有臨床應用的可能性。
1 實 驗
1.1 實驗試劑與儀器
1.1.1 實驗試劑
原卟啉IX (PPIX)、2-肟氰乙酸乙酯、N,N-二異丙基碳二亞胺(DIC)、六亞甲基二異氰酸酯(HDI)、10-蒽基-雙(亞甲基)二丙二酸(ADMA),阿拉丁公司;聚乙二醇400,N,N-二甲基甲酰胺 (DMF),上海凌峰化學試劑有限公司,胰蛋白胨、瓊脂,滬試公司。實驗菌種:大腸桿菌(E.coli)、金黃色葡萄球菌(S.aureus)和耐甲氧西林金黃色葡萄球菌(MRSA),魯威科技公司。脂肪干細胞 (hASCs),實驗室培養,肝癌細胞(HepG2)由常州大學生物醫學工程與健康科學研究所提供。
1.1.2 實驗儀器
生化培養箱(SPX-250B型),天津泰斯特儀器有限公司;激光燈(635 nm,0.5 W/cm2),珠海邁致激光公司;酶標儀(Epcoch),美國Bio Tek公司。
1.2 合成PPIX-PEG預聚物
稱取200 mg PEG400加入單頸圓底燒瓶中,在油浴中加熱至110 ℃,抽真空2 h以除去水分后備用。稱取PPIX 40 mg放入玻璃小瓶(10 mL),然后加入2-肟氰基乙酸乙酯21 mg、N,N-二異丙基碳二亞胺(DIC)18 mg和3 mL干燥的 N,N-二甲基甲酰胺 (DMF),將玻璃小瓶置于恒溫振蕩器中振蕩1 h(250 r/min,37 ℃)。然后將PPIX溶液加入干燥的PEG中并在40 ℃下攪拌24 h。反應結束后將產物滴加到過量的正己烷中,沉淀離心(8 000 r/min,5 min)后得到粗產物(PPIX-PEG)。在去離子水中透析2天(每2 h換水一次)以除去未反應的化合物。透析袋的截留分子量分別為1 000 Da。透析后的產物冷凍干燥,儲存在2~8 ℃的冰箱中備用。
1.3 原卟啉聚氨酯(PPIX-PEG-PU)的合成
稱取PPIX-PEG(50 mg)并加入50 mL三頸圓底燒瓶中,在真空油浴中加熱至110 ℃×2 h以除去水分。冷卻至70 ℃后,分別加入六亞甲基二異氰酸酯(10 mg)、催化劑辛酸亞錫(0.3%(質量分數))和3 mL干燥的DMF。將混合物在N2氣氛中磁力攪拌6 h,然后加入 100 μL三亞乙基四胺的DMF溶液并繼續反應6 h。反應混合物中的大部分DMF在100 ℃下通過旋轉蒸發除去。然后將濃縮的產物滴加到過量的正己烷中沉淀,然后離心(8 000 r/min,5 min)。沉淀產物在截留分子量為8 000~12 000 Da的透析袋中以與上述相同的方式通過透析純化。將透析產物冷凍干燥并在室溫下避光儲存。
1.4 合成產物的結構與性能表征
1.4.1 紅外分析(FTIR)
美國Nicolet公司的傅立葉變換紅外光譜儀(Nicolet Avatar 370)用于表征PPIX-PEG與PPIX-PEG-PU的官能團,掃描范圍400~4 000 cm-1, 分辨率4 cm-1,掃描次數256。
1.4.2 共振氫譜表征(1H-NMR)
德國Bruker公司的核磁共振儀(AVANCEⅢ-400),對PPIX-PEG與PPIX-PEG-PU的化學成分和結構進行表征,以氘代氯仿為溶劑。
1.4.3 凝膠滲透色譜分析(GPC)
美國Water公司的WATERS 515型凝膠滲透色譜測試PPIX-PEG以及PPIX-PEG-PU的分子量和分子量分布,標準聚苯乙烯作為參照物,THF為流動相溶劑,淋洗速率為1 mL/min。
1.4.4 紫外可見光分光光度計(UV-vis)分析
日本島津公司的UV-1800型分光光度計用于測試。PPIX、PPIX-PEG與PPIX-PEG-PU的水溶液的測試濃度為0.18 mmol/L
1.4.5 單線態氧的測定
ADMA用作檢測1O2生成的指示劑。2 mL PPIX-PEG與PPIX-PEG-PU溶液(0.18 mmol/L)與 1 mL ADMA 溶液 (0.5 mmol/L) 混合,用紅色激光(635 nm,0.5 W/cm2)照射不同時間(0~20 min),測定260 nm左右ADMA的吸收值。
1.4.6 光動力抑菌分析
采用瓊脂平板法評估PPIX-PEG與PPIX-PEG-PU的光動力抑菌效果,實驗菌種為革蘭氏陰性菌E.coli、革蘭氏陽性菌S.aureus和多重耐藥菌MRSA。取100 μL/孔的菌液(1×105CFU/mL)加至96孔板中,然后加入100 μL/孔不同濃度的PPIX-PEG400 與PPIX-PEG-PU水溶液,空白對照組中加入PBS溶液,共培養2 h后,用波長405 nm,功率為0.5 W/cm2的激光照射5 min,然后取50 μL混合菌液涂布于瓊脂培養基表面,在37 ℃的生化培養箱中培養過夜,由培養基表面生長的細菌群落數計算得到抑菌率,每個實驗3個重復樣。
1.4.7 生物相容性
CCK-8法分析PPIX-PEG與PPIX-PEG-PU對脂肪干細胞 (hASC)和肝癌細胞(HepG2)的細胞毒性,所有實驗均在黑暗條件下進行。取100 μL/孔 的細胞溶液(1×105cells/mL)接種于96孔板中,待細胞貼壁生長后,每孔加入含有原卟啉衍生物的培養基溶液100 μL(培養基是補加了10%胎牛血清,5%青霉素-鏈霉素的DMEM),于37 ℃含5% CO2的培養箱中培養24 h。培養結束后吸出培養基,用PBS溶液洗滌1次,每孔加入100 μL CCK-8溶液(n(VCCK-8)∶n(VL-DMEM)=1∶9),置于37 ℃含5% CO2的細胞培養箱中培養3 h。孵育結束后,使用Epcoch酶標儀測量樣品的吸光度(波長為450和620 nm),每個實驗5個重復樣。
1.4.8 細胞對PPIX衍生物的吸收
通過UV/Vis光譜測量細胞對PPIX衍生物的定量攝取。因此,PPIX衍生物的PBS溶液(1 mg/mL)與HepG2細胞(1×105個細胞/mL)在37 ℃、5% CO2下共培養不同時間。除去并收集培養基。將細胞用 PBS 洗滌至少 3 次,并將收集的 PBS 和培養基合并用于 UV/Vis 分析以確定留在混合物中的 PPIX 衍生物的量。
共聚焦激光顯微鏡用于觀察細胞中的 PPIX 衍生物。將細胞(1×105個細胞/mL)接種到共聚焦培養皿上,并在37 ℃含5% CO2的培養箱中培養12 h。添加含PPIX 衍生物的 PBS (1 mg/mL)溶液于孔中的,并在37 ℃含5% CO2的培養箱中孵育30 min。然后除去PPIX衍生物溶液并用PBS洗滌細胞3次。每孔加入800 μL Calcein-AM (10 μg/mL) 并在37 ℃含5% CO2的培養箱中孵育 30 min以進行活細胞染色。然后去除上清液并將細胞洗滌3次。每孔加入800 μL DAPI溶液(10 μg/mL),室溫避光孵育 10 min。孵育后,去除上清液,用PBS洗滌細胞(3次),然后加入4%多聚甲醛溶液在室溫下固定細胞。固定的細胞用PBS洗滌3次,然后用激光共聚焦顯微鏡成像。
1.4.9 光動力治療后細胞的活力
將每孔100 μL HepG2細胞(1×105個細胞/mL)加入96 孔板中,在37 ℃和5% CO2的培養箱中培養24 h。然后以各種濃度添加每孔100 μL PPIX-PEG 或聚氨酯的 PBS溶液。將細胞在37 ℃含5% CO2的培養箱中孵育 20 min。用正常補充的 DMEM 刷新后,將細胞暴露于激光(405 nm,0.5 W/cm2或635 nm,0.5 W/cm2)下 5 min。然后每孔加入 100 μL CCK-8溶液,將細胞在37 ℃和5% CO2的培養箱中孵育3 h。Epcoch酶標儀用于測量每個樣品的吸光度,波長為 450和620 nm (n=5)。
1.4.10 細胞染色
用5 mL PBS稀釋5 μL Calcein-AM溶液和15 μL碘化丙啶溶液,用于活細胞和死細胞染色。將每孔100 μL HepG2 細胞(1×105細胞/mL)接種到96孔板上,并在37 ℃和5% CO2的培養箱中培養 24 h。每孔加入100 μL PPIX衍生物溶液,培養20 min。除去培養基后,細胞用 PBS 洗滌 3 次,然后用補充的 DMEM 更新。本實驗分為幾組,包括在正常補充 DMEM 中培養細胞的孔、在黑暗中用含有 PPIX 的補充 DMEM 培養的細胞、在黑暗中用 PPIX 衍生物培養的細胞、用含有 PPIX衍生物的補充DMEM培養然后暴露于405和635 nm 激光分別照射5 min。激光照射后去除培養基,用PBS洗滌細胞3次,然后向每個孔中加入100 μL染料溶液,并在37 ℃和5% CO2的培養箱中孵育30 min。在室溫下將細胞固定在100 μL多聚甲醛溶液(4%)中20 min,然后用PBS洗滌3次,然后進行熒光成像。
1.4.11 掃描電鏡
采用掃描電鏡觀察細菌與細胞形態,評價光動力殺菌效果。200 μL耐甲氧西林金黃色葡萄球菌溶液(1×109CFU/mL),分別與200 μL PPIX、PEG-PPIX-PEG400、聚氨酯溶液混合,置于暗處或用405 nm激光和635 nm激光照射5 min。離心收集處理過的細菌,用PBS洗滌3次,用戊二醛(2.5%)固定(4 h,5 ℃)過夜。固定菌分別用30%、50%、70%、80%、90%乙醇脫水,100%乙醇脫水兩次,60 ℃烘箱干燥,得到菌粉。將細菌粉末固定在導電膠上,噴金后用SEM觀察其形貌。同樣的方法制備肝癌細胞的樣品用于掃描電鏡觀察。
2 結果與討論
2.1 水溶性原卟啉聚合物的表征
圖1為合成水溶性原卟啉聚合物的反應示意圖。首先將原卟啉(PPIX)兩端的羧基引入聚乙二醇(PEG)形成共聚物二醇(PPIX-PEG),再通過與六亞甲基二異氰酸酯(HDI)聚合形成聚氨酯,PEG鏈段的引入改善PPIX的水溶性,聚氨酯鏈段可以有效阻止PPIX之間發生π-π堆積作用,通過紅外光譜、核磁共振氫譜、GPC和紫外可見光譜對聚合物進行表征。由圖2的紅外譜圖可知,曲線(a)PPIX-PEG在1 722和1 103 cm-1處出現的2個吸收峰,主要歸因于酯鍵CO和醚鍵C—O—C的振動伸縮峰,相較于PPIX(c)明顯出現了來自于聚乙二醇中的C—O—C的醚鍵。曲線(b)PPIX-PEG-PU在1 731和1 106 cm-1處出現的2個吸收峰,同樣歸因于酯鍵CO和醚鍵C—O—C的振動伸縮峰,相較于曲線(a)PPIX-PEG,PPIX-PEG-PU明顯出現了3 434 cm-1處的吸收峰,主要歸因于二異氰酸酯中的N-H的振動收縮峰。通過以上結果表明成功合成了PPIX-PEG及其PPIX-PEG-PU聚合物。

圖1 水溶性原卟啉聚合物的合成示意圖Fig.1 The synthesis ofthe water-soluble PPIX polymers

圖2 (a) PPIX-PEG, (b) PPIX-PEG-PU和(c) PPIX的紅外譜圖Fig.2 FT-IR spectra of (a) PPIX-PEG, (b) PPIX-PEG-PU and (c) PPIX
核磁共振氫譜用來表征 PPIX-PEG 以及PPIX-PEG-PU的結構(圖3)。對于PPIX-PEG,σ3.6 處的化學位移來自于 PEG 鏈段的—CH2CH2—上的質子吸收峰。此外,還有其他來自PPIX結構的吸收峰,包括σ4.3(卟啉環旁邊的丙酸酯基團上的—CH2—)、σ6.3和σ8.1(—CH=CH2,PPIX上的側基團)、σ10. 5(卟啉環上的—CH=C<)。對于PPIX-PEG-PU,σ1.6處的化學位移來自于HDI鏈段—NHCH2CH2—上的質子吸收峰,σ1.3 來自于 HDI 亞甲基 (—NHCH2CH2CH2—) 的質子吸收峰。其他質子吸收峰可以歸于聚氨酯的PPIX-PEG鏈段上的質子(圖3(b)),其化學位移與圖3(a)觀測到的核磁共振氫譜相似。通過表1的分子量及其分布也說明成功合成了原卟啉聚氨酯聚合物。
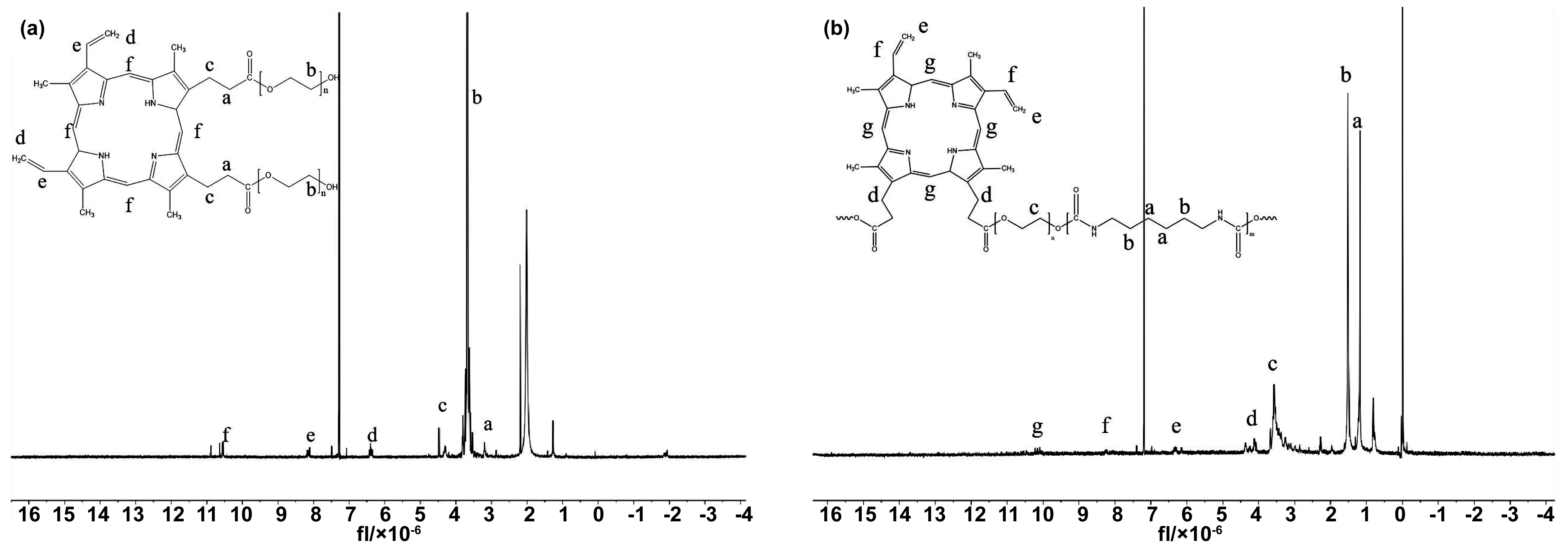
圖3 (a) PPIX-PEG和(b)PPIX-PEG-PU的核磁共振氫譜圖Fig.3 1H-NMR spectra of (a)PPIX-PEG and (b)PPIX-PEG-PU

表1 PPIX-PEG和PPIX-PEG-PU的分子量及其分布
PPIX、PPIX-PEG和PPIX-PEG-PU的水溶液的紫外光譜如圖4所示。圖中600 nm附近的峰是 PPIX 的特征吸收峰,從三者的紫外圖中我們都可觀察到這個峰,另外在PPIX-PEG400和PPIX-PEG-PU水溶液的紫外光譜中我們可以觀察到在400 nm左右有一個明顯的吸收峰,這個峰主要來自于卟啉的 π-π* 電子躍遷。由于PPIX的高疏水性且在水溶液中PPIX形成π-π堆積,所以并未出現π-π*電子躍遷產生的吸收峰。然而PPIX-PEG400以及PPIX-PEG-PU是水溶性的,在400 nm處出現一個峰值,具有高吸光度,表明π-π*電子躍遷比PPIX溶液強得多。此外,PPIX-PEG400與二異氰酸酯的聚合導致單位面積PPIX密度增加,這有利于卟啉環之間的電子躍遷,因此在PPIX-PEG-PU 400 nm處的峰會出現紅移。

圖4 PPIX, PPIX-PEG和PPIX-PEG-PU水溶液的紫外光譜圖Fig.4 UV spectra of PPIX, PPIX-PEG and PPIX-PEG-PU water solutions
2.2 PPIX及其衍生物的光致單線態氧(1O2)分析
使用 ADMA 作為單線態氧指示劑分析了PPIX及其衍生物的1O2生成效率(圖 5)。結果表明,PPIX與ADMA的混合溶液隨著光照時間的增加,ADMA 在 250 nm 處的吸收峰幾乎沒有變化(圖5a),這可能是因為PPIX的疏水性以及在水中的 π-π 積累導致1O2生成效率極低。而可溶性PPIX-PEG和PPIX-PEG-PU與ADMA的混合溶液的吸收峰值會隨著光照時間的增加而降低(圖5(b)、(c)),PPIX-PEG-PU比PPIX-PEG產生的1O2更多,這是由于聚合物鏈段阻礙PPIX單元之間發生π-π堆積,從而提升了單線態氧產率。

圖5 (a) PPIX, (b) PPIX-PEG和(c) PPIX-PEG-PU的光致單線態氧生成(635nm激光,0.5 W/cm2)Fig.5 Photo-induced singlet oxygen generation of (a) PPIX, (b) PPIX-PEG and (c) PPIX-PEG-PU (635 nm laser,0.5 W/cm2)
2.3 PPIX及其衍生物的光動力滅菌分析
采用瓊脂平板計數法評估PPIX及其衍生物的光動力抗菌性能。將PPIX、PPIX-PEG 和PPIX-PEG-PU(使用相同濃度的 PPIX 單元)與細菌共培養并進行光照以研究滅菌效果。結果表明,PPIX-PEG和PPIX-PEG-PU的光動力抗菌效果顯著高于PPIX(圖6),對于大腸桿菌,PPIX-PEG和PPIX-PEG-PU均表現出非常高的抗菌率,在濃度為40 μmol/L時達到100%(圖6(a))。兩者對金黃色葡萄球菌表現出差異,PPIX-PEG-PU的抗菌率明顯優于PPIX-PEG,但當濃度>100 μmol/L時,PPIX-PEG的抗菌率也可以達到100% (圖6(b)),但即使濃度增加到180 μmol/L,PPIX-PEG 對 MRSA 的抗菌率也僅達到60%左右(圖6(c)),而PPIX-PEG-PU在40 μmol/L時,激光照射5 min后幾乎達到100%。延長光照時間可以增加對 MRSA 的光動力抗菌作用(圖6(d)),通過SEM對受損細菌進行成像來進一步驗證其光動力抗菌效果(圖7),結果表明當與PPIX-PEG和PPIX-PEG-PU溶液孵育的MRSA在405 nm照射下有明顯的損傷,在黑暗條件下沒有明顯影響。

圖6 不同濃度的PPIX,PPIX-PEG和PPIX-PEG-PU與(a) 大腸桿菌; (b) 金黃色葡萄球菌和 (c)耐甲氧西林金黃色葡萄球菌混合后在405 nm激光照射5 min后的抗菌效果(*:p<0.05)Fig.6 Antibacterial effects of PPIX, PPIX-PEG and PPIX-PEG-PU at various concentrations after mixing with (a)E. coli; (b) S. aureus and (c) MRSA and irradiating at 405 nm for 5 min (*:p<0.05)

圖7 耐甲氧西林金黃色葡萄球菌經過不同處理后的SEM圖:(a)與 PPIX-PEG400孵育的細菌,未照射;(b)與 PPIX-PEG-PU孵育的細菌,未照射;(c)與PPIX-PEG400 孵育的細菌,然后用 405nm激光照射;(d)與 PPIX-PEG-PU孵育的細菌,然后用 405 nm 激光照射,圖中標尺為5 μmFig.7 SEM images of Methicillin-resistant Staphylococcus aureus with various treatments: (a) bacteria incubated with PPIX-PEG400, not irradiated; (b) bacteria incubated with PPIX-PEG-PU, not irradiated; (c) bacteria incubated with PPIX-PEG400 and then irradiated with 405 nm laser; (d) bacteria incubated with PPIX-PEG-PU Bacteria incubated with PEG-PU and then irradiated with 405 nm laser. Scale bars: 5 μm
2.4 PPIX-PEG與PPIX-PEG-PU的生物相容性
除了 PPIX 衍生物的抗菌作用外,還研究了它們對哺乳動物細胞的細胞毒性。在黑暗中,當濃度高達 1 mg/mL時PPIX 衍生物對細胞是無毒的,表明具有良好的生物相容性(圖8(a),(b))。
2.5 PPIX-PEG與PPIX-PEG-PU的細胞吸收
由于細胞會進行胞吞作用將物質吞入細胞內部,因此我們研究了肝癌細胞對各個原卟啉衍生物的吸收作用,圖9(a)顯示了原卟啉衍生物與肝癌細胞孵育不同時間后細胞的吸附量圖。實驗中的原卟啉衍生物的濃度都為1 mg/mL,實驗結果顯示,在孵育5 min后細胞對PPIX-PEG的吸附量已經達到最大值,并且隨著孵育時間的延長,細胞的吸附量不會有明顯的增加;而對于PPIX-PEG-PU,可以發現在孵育15 min內,細胞的吸附量會隨著孵育時間的延長而增加,15 min后吸附量基本不會發生變化。

圖8 不同濃度的PPIX-PEG和PPIX-PEG-PU對(a)脂肪干細胞和(b)肝癌細胞的生物毒性Fig.8 Cytotoxicity of PPIX-PEG and PPIX-PEG-PU with various concentrations to (a) hASCs and (b) HepG2 cells

圖9 (a) PPIX-PEG和PPIX-PEG-PU與肝癌細胞孵育后細胞的吸附量(b)肝癌細胞與PPIX-PEG和PPIX-PEG-PU(1 mg/mL)孵育20 min后的熒光照片(c)肝癌細胞與PPIX-PEG孵育后并經過Calcein AM和DAPI染色后的激光共聚焦層掃描圖片Fig.9 (a) The amount of PPIX-PEG and PPIX-PEG-PU uptaking after incubating with HepG2; (b) fluorescence images of HepG2 cells after incubation with PPIX-PEG and PPIX-PEG-HDI (1 mg/mL) for 20 min; (c) confocal fluorescence microscopy images of a layer of HepG2 cells scanned with 2 μm steps after incubation in PBS with PPIX-PEG (1 mg/mL) for 30 min and subsequently stained with Calcein AM and DAPI
為進一步了解細胞對于原卟啉衍生物的吸收作用,將細胞與PPIX-PEG和PPIX-PEG-PU的PBS溶液孵育20 min后通過熒光顯微鏡來觀察原卟啉產生的紅色熒光,從圖9(b)的熒光照片來看,孵育20 min后PPIX-PEG很明顯已經進入了細胞,在照片中可以清楚的看到細胞顯示強烈的紅色熒光,且主要分散在細胞質中,且通過圖9(c)的激光共聚焦的層掃照片可以發現PPIX-PEG的紅色熒光與染料Calcein-AM的綠色熒光以及染料DAPI的藍色熒光出現在細胞的同一層面,因此進一步證實了PPIX-PEG可以進入細胞的內部;然而對于與PPIX-PEG-PU孵育20 min后的細胞,通過熒光顯微鏡只觀察到了微弱的紅色熒光,我們通過激光共聚焦顯微鏡也并未發現有紅色熒光與染料分子的熒光出現在同一層面,因此我們猜測由于PPIX-PEG-PU的分子量大不易于通過細胞的胞吞作用進入細胞內部,可能會隨著孵育時間延長其自身會沉淀且吸附于細胞表面,所以才會出現圖9(a)的曲線,但是在染色過程中由于PBS的多次清洗導致其被PBS溶液清洗掉,因此在熒光顯微鏡中只能觀察到極微弱的熒光。

圖10 HepG2細胞與不同濃度的PPIX-PEG和PPIX-PEG-PU孵育20 min后(a)在405 nm激光(b)635nm激光照射5 min后的細胞存活率(*:p<0.05);(c)肝癌細胞與PPIX-PEG和PPIX-PEG-PU (1 mg/mL) 孵育20 min后在405 nm激光下照射不同時間后的存活率(*:p<0.05);(d) 肝癌細胞與PPIX-PEG和PPIX-PEG-PU (1 mg/mL) 孵育20 min后在不同激光照射后與Calcein AM (綠)和PI (紅)染色后的熒光照片,圖中標尺為50 μmFig.10 (a) Viability of HepG2 cells cultured with PPIX-PEG and PPIX-PEG-PU at various concentrations for 20 min and irradiated at 405 nm and (b) 635 nm for 5 min (*:p<0.05); (c) viability of HepG2 cells cultured with PPIX-PEG and PPIX-PEG-PU (1 mg/mL) for 20 min and irradiated at 405 nm for various periods of time (*:p<0.05); (d) fluorescent images of HepG2 cells incubated with PPIX-PEG and polyurethane (1 mg/mL) for 20 min and irradiated under different conditions and stained with Calcein AM (green) and PI (red). Scale bars: 50 μm
2.6 PPIX-PEG和PPIX-PEG-PU對肝癌細胞的光動力滅活分析
在HepG2細胞與PPIX衍生物一起培養后,研究了光照后的細胞毒性。結果表明,在相同條件下,405 nm激光照射對細胞滅活效率高于 635 nm激光照射。在只有高濃度時PPIX-PEG-PU顯示出比PPIX-PEG更高的細胞滅活效率(圖10(a),(b)),這些結果與之前的1O2生成效率實驗結果不太一致,原因可能是PPIX-PEG-PU與PPIX-PEG比不能進入細胞,由于PPIX-PEG會通過細胞的胞吞作用進入細胞,PPIX-PEG-PU只是吸附在細胞表面,在后續的PBS清洗中導致PPIX-PEG-PU的流失,從而降低了PPIX-PEG-PU的有效利用,減弱了其光動力的殺傷效果,而在濃度較高時吸附在細胞表面的PPIX-PEG-PU的量會更多,由于其更強的光動力效果致使對肝癌細胞的殺傷效果會強于PPIX-PEG。從圖10(c)的實驗結果顯示,在高濃度且405 nm激光照射時,PPIX-PEG-PU僅僅照射2 min就滅活了80%的肝癌細胞,而PPIX-PEG400需要照射4 min,說明PPIX-PEG-PU具有更強的光動力效果。

圖11 經各種處理的HePG2細胞的SEM圖像:(a)正常細胞;(b)與PPIX-PEG400孵育的細胞,未照射;(c)與PPIX-PEG400孵育的細胞,然后用635 nm激光照射;(d)與PPIX-PEG400孵育的細胞,然后用405 nm激光照射)。圖中標尺為10 μmFig.11 SEM images of HePG2 cells with various treatments: (a) normal cells; (b) cells incubated with PPIX-PEG400 without irradiation; (c) cells incubated with PPIX-PEG400 then irradiate with 635nm laser; (d) cells incubated with PPIX-PEG400 then irradiate with 405 nm laser. Scale bars: 10 μm
通過細胞染色來對PPIX衍生物對肝癌細胞的的光動力滅活效果進行進一步驗證。幾乎所有與PPIX衍生物孵育并被405 nm激光照射的細胞都被PI染成紅色,沒有細胞質,表明大多數細胞在照射后破裂/死亡。如果使用635 nm照射,則有一些細胞被Calcein AM染成綠色,但大部分細胞已被破壞,證實了405 nm激光照射對細胞滅活效率高于635 nm激光照射。通過圖11細胞的SEM圖像顯示,在405 nm激光照射下幾乎沒有完整的細胞,而當在635 nm下照射時,一些細胞仍然保持它們的細胞膜。
3 結 論
合成了水溶性的PPIX-PEG衍生物以及PPIX-PEG-PU聚合物,研究了PPIX-PEG與PPIX-PEG-PU光致生成單線態氧的情況;探討了應用于光動力滅活細菌以及癌細胞的效果。結果表明:(1)PPIX-PEG-PU中由于聚合物鏈段可以阻礙PPIX單元的π-π堆積,光照下生成最多的單線態氧;(2)PPIX-PEG-PU對E.coli、S.aureus和MRSA表現出優于PPIX-PEG與PPIX的光動力抗菌效率;(3)細胞可以通過內吞作用攝入PPIX-PEG,而難以攝入PPIX-PEG-PU;(4)癌細胞的光動力滅活效率與細胞對光敏劑的攝取有密切聯系,但PPIX-PEG-PU仍具有優于PPIX-PEG的光動力滅活效率;(5)在黑暗條件下PPIX-PEG與PPIX-PEG-PU具有良好的生物相容性。

