兒童肝移植患者術后感染病原菌的分布以及耐藥情況
劉淼 王策 穆紅
1天津醫科大學一中心臨床學院(天津 300192);2天津市第一中心醫院檢驗科(天津 300192)
隨著我國肝移植外科技術的成熟與進步、肝移植圍手術期管理水平的提高、免疫抑制劑等方面的發展,兒童肝移植技術在我國發展迅速。兒童肝移植受者的原發病不同于成年人,主要是各種急慢性終末期肝病和遺傳代謝性疾病,如兒童膽道閉鎖和朗格漢斯細胞組織細胞增生癥等[1]。然而在肝移植術后監護階段,由于患兒年齡較小、接受腹部大手術、各種侵入性治療、術前低營養狀態、術后免疫抑制劑的使用以及其他因素,增加了患兒侵襲性感染的風險[2]。肝移植術后感染是影響移植物存活率以及受者生存率的主要因素之一[3-4]。有研究顯示,接受肝移植的患兒約50%在早期階段發生細菌感染[5]。本研究回顧性分析天津市第一中心醫院肝移植病房收治的肝移植患兒術后感染情況,以期了解兒童肝移植手術后細菌感染的分布情況以及耐藥性,為兒童肝移植術后臨床合理選擇抗菌藥物提供依據。
1 資料與方法
1.1 對象 本研究共納入天津市第一中心醫院肝移植病房2019-2021年收治的0~14周歲的肝移植患兒917例,其中男451例,女466例;臨床送檢標本4 476份,按照《全國臨床檢驗操作規程》以無菌手續采集后,運送至臨床微生物室,注意運送過程中不同細菌按不同溫度要求送檢;標本來源包括膽道、切口,引流管,血液、腹腔和泌尿道等,同一患者相同部位多次分離株不重復計入研究。從實驗室信息系統提取分離患者相關臨床資料。本研究經本院倫理委員會審核同意(批件號:2020N080KY)。
1.2 細菌的培養與鑒定 送檢標本按照《全國臨床檢驗操作規程》要求檢驗操作。采用Vitek-2 compact全自動微生物分析系統(法國生物梅里埃公司)和BACT/ALERT 3D全自動血培養儀(法國生物梅里埃公司)進行菌株培養與鑒定。
1.3 藥敏試驗 藥敏試驗在自動化藥敏測定系統Vitek-2 compact及配套的藥敏卡上進行,采用紙片擴散法(Kirby-Bauer,KB)進行復核,對于少見耐藥或罕見耐藥表型或矛盾耐藥表型采用E-test條或微量肉湯稀釋法復檢。藥敏試驗結果采用美國臨床實驗室標準化協會(CLSI)推薦的執行標準,對分析結果進行判斷,分為耐藥、中介與敏感。
1.4 質控菌株 革蘭氏陰性菌藥敏卡質控菌株:ATCC700603、ATCC25922、ATCC27853、ATCC35218;革蘭氏陽性菌藥敏卡質控菌株:ATCC29212、ATCC29213;細菌鑒定卡質控菌株:ATCC700323、ATCC17666、ATCC700327、ATCC750、ATCC14053。
1.5 統計學方法 采用SPSS 23.0軟件進行統計分析,采用Excel 2003建立數據庫,計數資料用例(%)表示,組間比較采用χ2檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 病原菌的標本來源和構成比 2019-2021年天津市第一中心醫院肝移植病房共送檢917例患兒標本,陽性553例,陰性364例,陽性率60.3%;共送檢標本4 476份,分離出1 220株病原菌,陽性率27.3%,主要分離自血液(45.1%),腹水(30.4%)以及膽汁(9.6%)分泌物。其中革蘭氏陽性菌633株占51.9%,以腸球菌、葡萄球菌為主;革蘭氏陰性菌527株占43.2%,以肺炎克雷伯菌、大腸埃希菌為主;真菌及其他病原菌60株占4.9%。見表1。
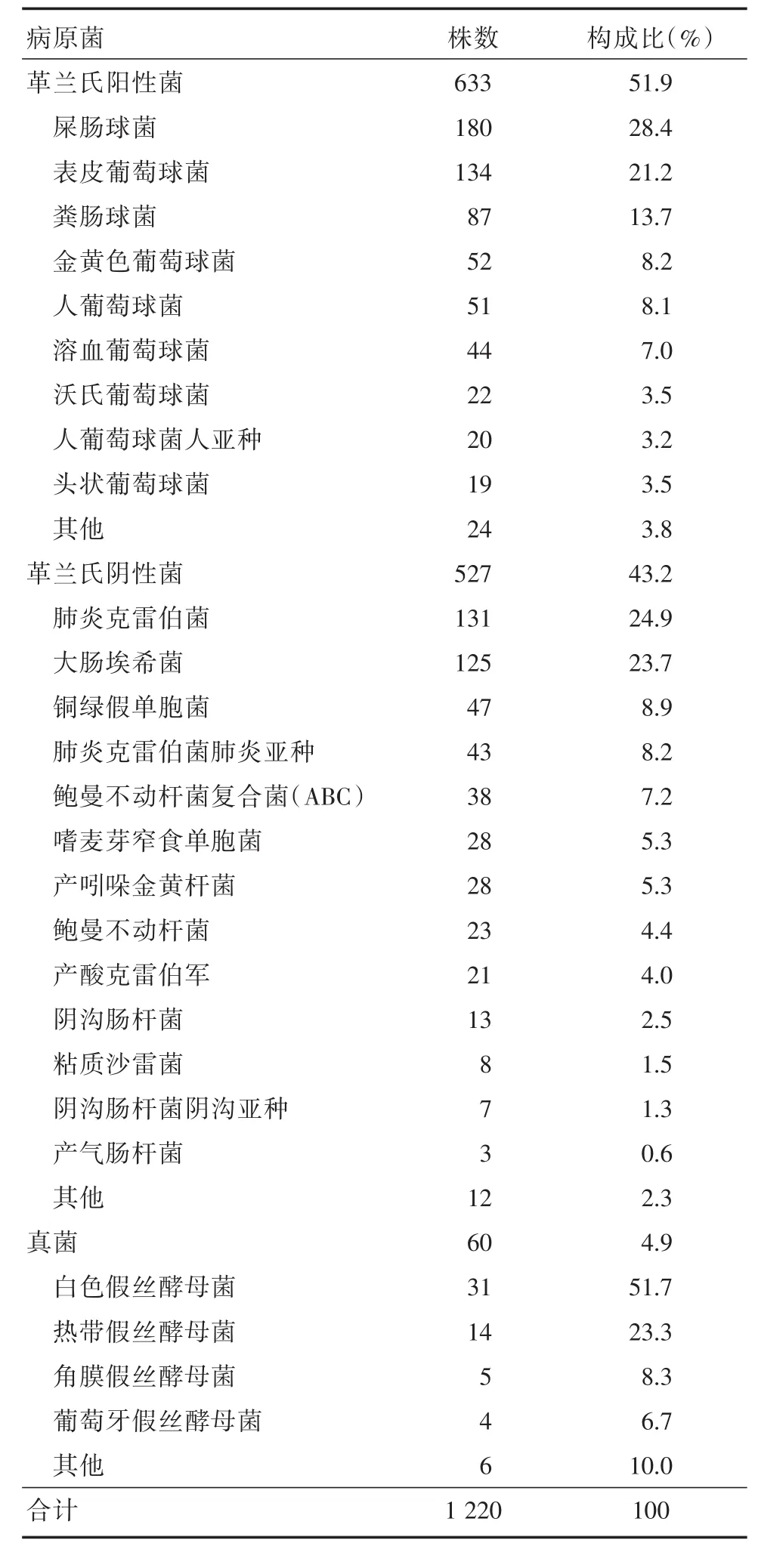
表1 肝移植患兒術后感染病原菌的分布及構成比Tab.1 Distribution and constituent ratio of pathogenic bacteria after liver transplantation in children
2.2 主要病原菌對常用抗菌藥物的耐藥情況
2.2.1 主要革蘭氏陽性菌的耐藥情況 屎腸球菌對克林霉素、青霉素、氨芐西林耐藥率較高,耐藥率達到90%以上;糞腸球菌對克林霉素的耐藥率達到100%;金黃色葡萄球菌對青霉素的耐藥率較高,耐藥率為84.6%;表皮葡萄套球菌對青霉素、苯唑西林的耐藥率最高,耐藥率達到80%以上。見表2。

表2 主要革蘭氏陽性菌的耐藥情況Tab.2 Drug resistance of major Gram-positive bacteria
2.2.2 主要革蘭氏陰性菌的耐藥情況 肺炎克雷伯菌和大腸埃希菌對頭孢呋辛、頭孢曲松的耐藥率較高,耐藥率達到80%以上;銅綠假單胞菌對復方新諾明、替加環素耐藥率達到90%以上;鮑曼不動桿菌復合菌對氨曲南的耐藥率為97.4%。見表3。
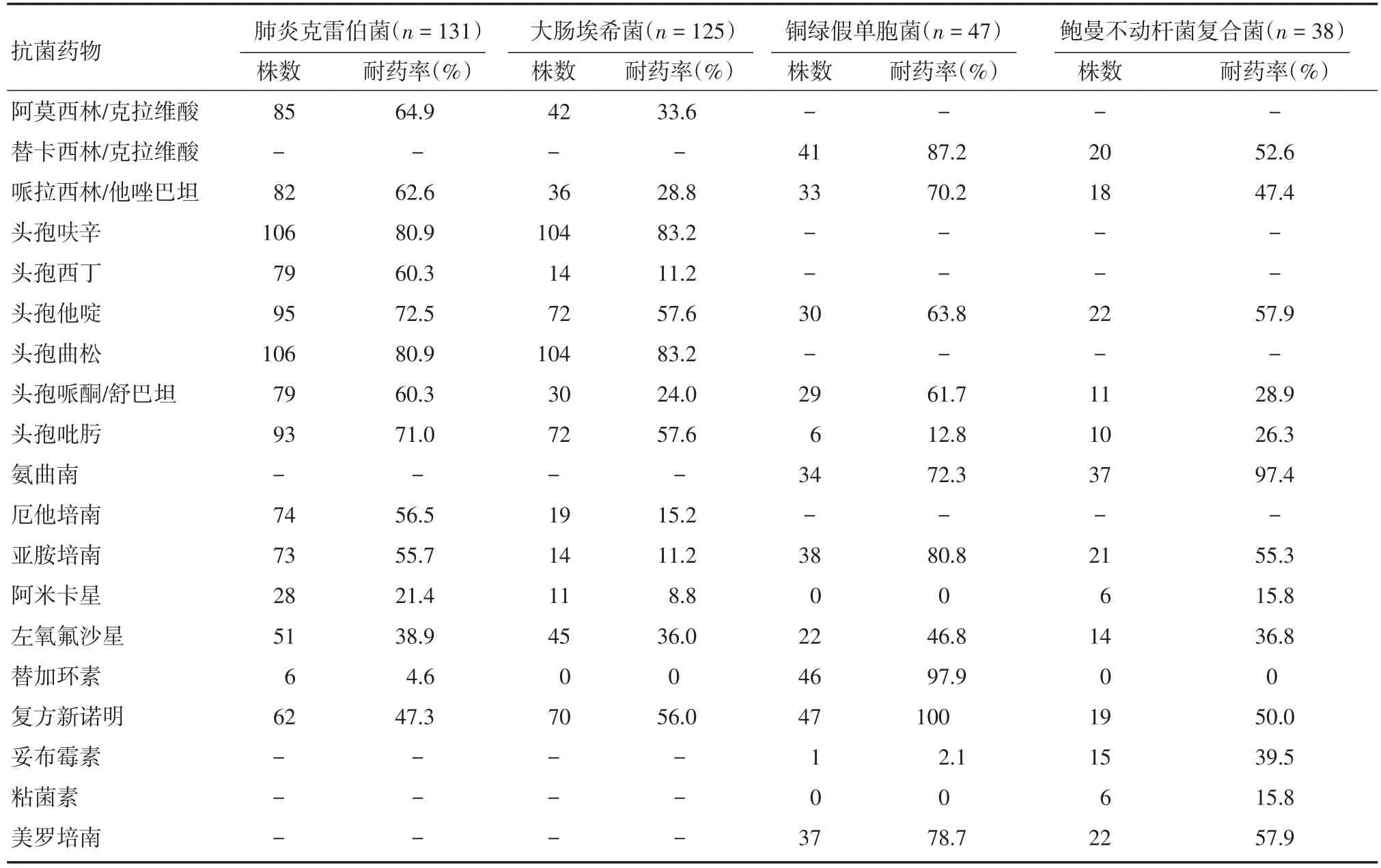
表3 主要革蘭氏陰性菌的耐藥情況Tab.3 Drug resistance of major Gram-negative bacteria
2.3 2019-2021年主要革蘭氏陽性菌檢出率和耐藥率的變化
2.3.1 比較2019-2021年革蘭氏陽性菌檢出率變化 糞腸球菌的檢出率逐年上升,2021年最高達到8.9%,差異有統計學意義(P<0.05);表皮葡萄球菌的檢出率逐年下降,2021年最低達到7.7%,差異有統計學意義(P<0.05);2020年屎腸球菌和金黃色葡萄球菌的檢出率最高,在2021年有所下降,差異均有統計學意義(P<0.05)。見表4。

表4 2019-2021年革蘭氏陽性病原菌檢出率Tab.4 The detection rate of Gram-positive pathogens from 2019 to 2021 例(%)
2.3.2 比較2019-2021年革蘭氏陽性菌耐藥率的變化 2021年屎腸球菌對青霉素和氨芐西林的耐藥率較2019年和2020年有所下降,差異有統計學意義(χ2=8.548,9.364,P< 0.05);2019年和2020年未發現對利奈唑胺耐藥的屎腸球菌,但在2021年耐藥率達到14.8%,差異有統計學意義(χ2=14.649,P<0.05)。2020年糞腸球菌對左氧氟沙星和紅霉素的耐藥率最高,差異有統計學意義(χ2=27.207,6.285,P<0.05)。金黃色葡萄球菌對青霉素的耐藥率總體增加,差異有統計學意義(χ2=7.727,P<0.05)。表皮葡萄球菌對青霉素、苯唑西林、紅霉素、克林霉素、復方新諾明和左氧氟沙星的耐藥性變化比較差異無統計學意義(P>0.05)。見表5。
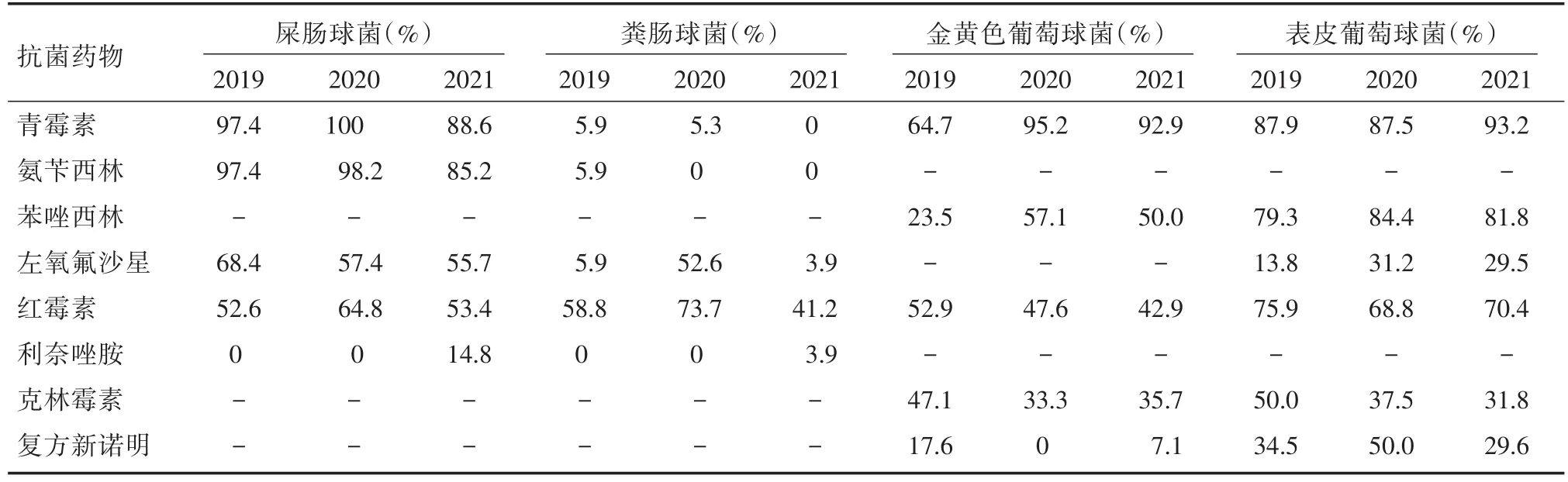
表5 2019-2021年革蘭氏陽性菌對常用抗生素的耐藥率比較Tab.5 Comparison of resistance rates of Gram-positive bacteria to commonly used antibiotics from 2019 to 2021
2.4 2019-2021年主要革蘭氏陰性菌檢出率和耐藥率的變化
2.4.1 比較2019-2021年革蘭氏陰性菌檢出率變化 銅綠假單胞菌和鮑曼不動桿菌復合菌檢出率逐年上升,差異有統計學意義(P<0.05);肺炎克雷伯菌的檢出率總體下降,差異有統計學意義(P<0.05);2021年大腸埃希菌的檢出率最低,差異有統計學意義(P<0.05)。見表6。

表6 2019-2021年革蘭氏陰性病原菌分布Tab.6 The detection rate of Gram-negative pathogens from 2019 to 2021例(%)
2.4.2 比較2019-2021年革蘭氏陰性菌耐藥率的變化 肺炎克雷伯菌對復方新諾明的耐藥率逐年增加,2021年最高,差異有統計學意義(χ2=10.894,P<0.05);對哌拉西林/他唑巴坦、頭孢呋辛、頭孢他啶、頭孢曲松、頭孢哌酮/舒巴坦和頭孢吡肟的耐藥率在2020年最低,2021年再次升高,且高于2019年,差異有統計學意義(χ2=7.229,10.851,8.719,10.851,6.756,7.751,均P< 0.05)。大腸埃希菌對左氧氟沙星、頭孢呋辛、頭孢曲松和頭孢吡肟的耐藥率總體有所增加,差異有統計學意義(χ2=14.446,9.324,9.324,6.995,均P< 0.05);2021年大腸埃希菌對阿莫西林/克拉維酸、頭孢他啶、亞胺培南和阿米卡星的耐藥率最低,差異有統計學意義(χ2=9.141,11.718,8.385,16.585,均P< 0.05)。銅綠假單胞菌對頭孢哌酮/舒巴坦、氨曲南和哌拉西林/他唑巴坦的耐藥率總體增加,差異有統計學意義(χ2=9.359,16.553,12.325,均P< 0.05),2020年銅綠假單胞菌對替卡西林/克拉維酸和左氧氟沙星的耐藥率較2019年有所下降,但在2021年達到最高,差異有統計學意義(χ2=7.776,7.373,P<0.05)。鮑曼不動桿菌復合菌對替卡西林/克拉維酸、哌拉西林/他唑巴坦、頭孢他啶等抗菌藥物的耐藥性變化比較差異均無統計學意義(P>0.05)。見表7。
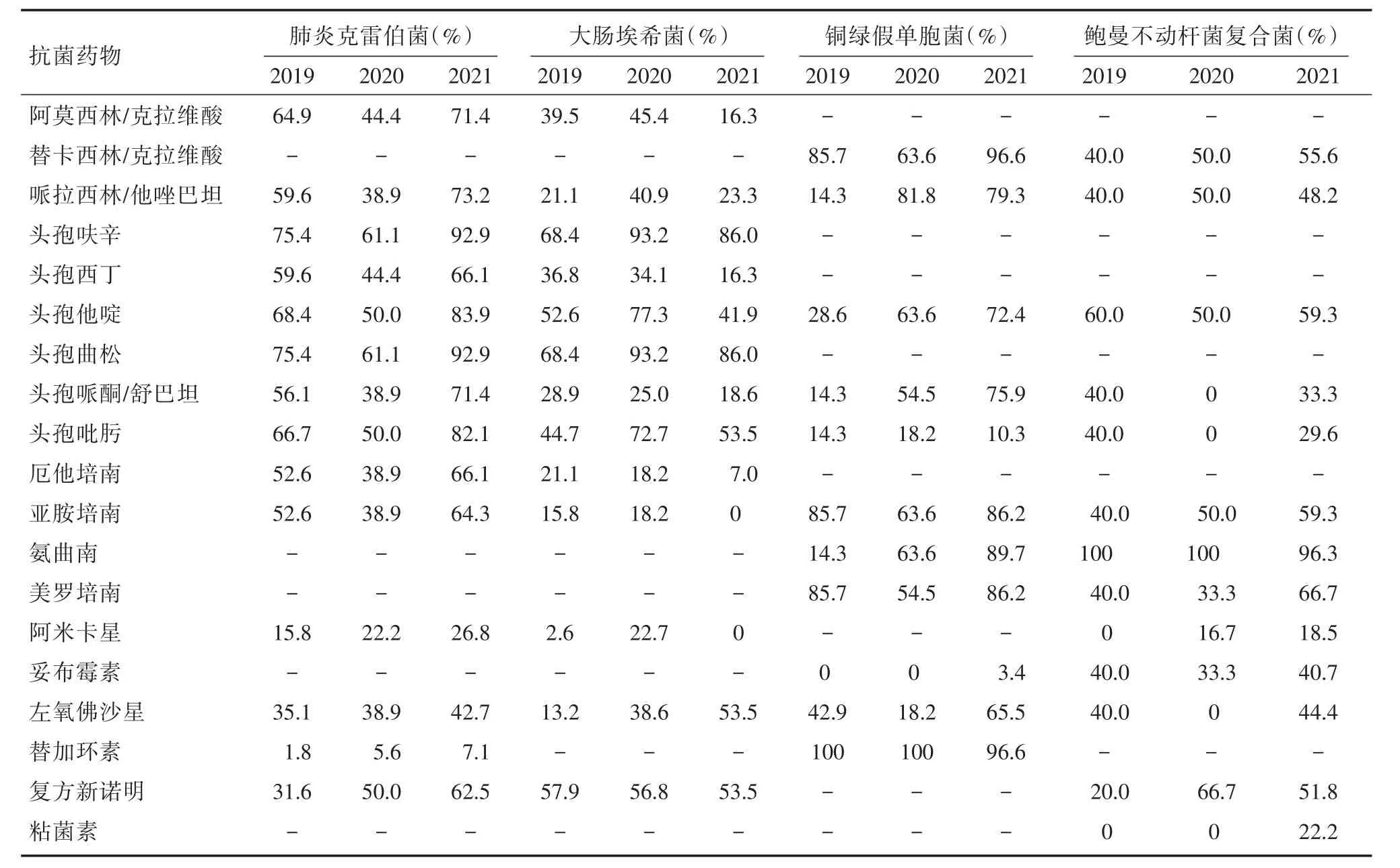
表7 2019-2021年革蘭氏陰性菌對常用抗生素的耐藥率比較Tab.7 Comparison of resistance rates of Gram-negative bacteria to commonly used antibiotics from 2019 to 2021
3 討論
近年來,隨著我國外科技術的逐漸成熟,兒童肝移植在我國發展迅速,一些經驗豐富的移植中心,兒童肝移植術后生存率已達到國際先進水平。國外有關研究顯示,兒童肝移植術后10年以上生存期約為70%[6]。國內報道顯示,在有經驗的肝移植中心,術后5年生存率達到90%[7]。然而,術后感染仍是影響移植物存活率及受者生存率的主要原因[8]。兒童肝移植術后感染發生率高,發生時間早,且有多部位,多菌株混合感染的傾向。細菌是兒童肝移植術后感染的主要病原菌,感染部位多見于腹腔、血液、膽管、下呼吸道等,常見的致病菌為銅綠假單胞菌、屎腸球菌、大腸埃希菌等[9]。目前,國內關于兒童肝移植術后感染的研究尚不多。本研究對917例肝移植患兒臨床資料研究顯示,術后病原菌感染比例為60.3%(553/917),高于國內報道兒童肝移植早期感染發生率[10-11];與國外兒童肝移植術后感染發生率相仿[12-13]。此外,術后感染常累計多個部位,最常見于血流感染與腹腔感染,與國內報道一致[14]。研究顯示兒童肝移植術后感染以革蘭氏陽性球菌為主,占51.9%,革蘭氏陰性菌占43.2%,真菌及其他病原菌占4.9%,與張錚錚等[10]報道不一致,但與中東和歐洲地區兒童肝移植術后感染病原菌統計數據相仿[15-16]。可能與監護情況及醫院感染病原體流行病學差異有關。
革蘭氏陽性菌主要以腸球菌,葡萄球菌為主,屎腸球菌和表皮葡萄球菌占比最高。其中屎腸球菌對克林霉素、青霉素和氨芐西林的耐藥性最高;除對克林霉素和紅霉素顯示較高耐藥外,糞腸球菌總體耐藥率較低。未發現對替考拉寧和萬古霉素耐藥的腸球菌。該結果與POULADFAR等[15]報道兒童肝移植術后感染耐萬古霉素腸球菌檢出占致病腸球菌80%以上結果不一致,與國內相關報道[17]腸球菌的耐藥性相仿,提示國內兒童肝移植腸球菌感染耐藥情況較國外低。腸球菌是一種廣泛分布于自然界的革蘭陽性球菌,是醫院感染重要的條件致病菌,本研究顯示腸球菌的檢出率總體上呈現上升趨勢,且在2021年發現對利奈唑胺耐藥的腸球菌。利奈唑胺作為對腸球菌包括對萬古霉素耐藥的菌株具有較好抑制作用的抗菌藥物,耐藥菌株的出現提示臨床醫生用此類抗菌藥物治療腸球菌屬感染時仍應慎重,盡量將其作為嚴重腸球菌感染時的最后一道防線,從而減少耐藥菌株的出現。表皮葡萄球菌是人體皮膚和黏膜上定居的正常菌群之一,屬于條件致病菌,但由于患兒自身免疫系統尚未建立完善,且肝移植手術需進行侵入性操作,過程復雜,創口暴露時間長,接觸面較廣等因素造成患兒容易出現表皮葡萄球菌感染[18]。但本研究顯示表皮葡萄球菌檢出率逐年下降,且對青霉素、苯唑西林和紅霉素耐藥率較高。2021年金黃色葡萄球菌的檢出率較前兩年有所下降,但對青霉素耐藥率總體升高,這與SUN等[19]和劉敏雪等[20]的研究結果一致,提示發生該類病原菌感染時應慎用此類藥物。均未發現對萬古霉素、利奈唑胺和替加環素耐藥的葡萄球菌。
革蘭氏陰性菌以腸桿菌科為主,銅綠假單胞菌和鮑曼不動桿菌復合菌檢出率逐年上升。由于銅綠假單胞菌毒力大,藥敏變化較快及易形成生物膜,因此對多種抗菌藥物天然耐藥[21],因此兒童感染后可供選擇治療的藥物非常有限,并且近年來兒童感染銅綠假單胞菌的人數呈上升趨勢,因此耐藥率低、副作用小的抗菌藥物如頭孢哌酮/舒巴坦、氨曲南以及哌拉西林/他唑巴坦在兒童中應用增多,導致其耐藥率逐年增加。肺炎克雷伯菌作為醫院感染的重要致病菌之一,臨床上主要采用氨基糖苷聯合頭孢菌素進行治療。本研究顯示肺炎克雷伯菌對頭孢呋辛、頭孢曲松、頭孢他啶和頭孢吡肟耐藥率均>70%,且2019-2021年相比,耐藥率整體呈現上升趨勢,與文獻報道大體一致[22-23]。目前,替加環素對于肺炎克雷伯菌的耐藥率處于較低水平,因此一度被認為是用于難以治療的肺炎克雷伯菌感染的最后手段[24]。大腸埃希菌是臨床分離較多,能引起人體各部位感染的最常見病原菌。從三年總的耐藥分析看,大腸埃希菌對頭孢呋辛、頭孢曲松和頭孢吡肟的耐藥率總體有所增加,這可能與第二、三代頭孢菌素在臨床廣泛使用有關;另外,研究顯示左氧氟沙星耐藥率也在逐年升高,因為喹諾酮類抗菌藥在尿液中濃度較高,常作為泌尿系統感染的一線抗菌藥,這可能是造成耐藥率上升的原因之一。
及時開展肝移植患兒的病原學監測,了解細菌分布和耐藥趨勢,對合理選擇抗菌藥物,預防和控制耐藥菌株的產生,降低肝移植術后感染的發生至關重要。本研究結果顯示兒童肝移植術后病原菌感染的發生率較高,感染部位以血液和腹腔為主。其中腸球菌、葡萄球菌、肺炎克雷伯菌、大腸埃希菌、銅綠假單胞菌和鮑曼不動桿菌復合菌為常見致病菌。臨床上可選用萬古霉素和替考拉寧治療革蘭氏陽性球菌感染,選用替加環素治療肺炎克雷伯菌、大腸埃希菌和鮑曼不動桿菌復合菌感染,選用阿米卡星和粘菌素治療銅綠假單胞菌感染。但是,本研究仍存在一些不足之處,由于資料的收據采用回顧性研究,獲得的術后感染流行病學資料相對比較局限,可能對統計結果造成偏倚。總之,本研究通過分析兒童肝移植術后感染常見的細菌分布及耐藥情況,為臨床防治術后感染,安全合理使用抗菌藥物提供了科學依據。

