八味沉香散含藥血清對H9c2細胞氧糖剝奪損傷的保護機制研究 Δ
宮佰會,岳棟芳,李彩霞,官敏,李永芳 (青海大學醫學院,西寧 810001)
心肌缺血是心血管系統的常見病,嚴重威脅人類生命健康,臨床迫切需要安全有效的藥物防治心肌缺血。八味沉香散是中國傳統藏藥復方之一,其源于藏族醫藥經典著作《四部醫典》。該復方由沉香200 g、肉豆蔻100 g、廣棗100 g、石灰華100 g、乳香100 g、木香100 g、訶子(煨)100 g、木棉花100 g組成,氣芳香,味咸、澀、微苦,具有清心熱、養心、安神、開竅之功效,主要用于熱病攻心、神昏譫語,臨床上主要用于治療冠心病、心絞痛等[1]。作者課題組前期研究發現,八味沉香散能夠降低由于冠狀動脈結扎引起的心肌缺血再灌注損傷和氧化應激反應[2—4]。不同方式的八味沉香散提取液對異丙腎上腺素、垂體后葉素導致的大鼠心肌收縮功能和舒張功能的下降[4—6]、心電圖 J點位移的程度[2,7]等均有顯著的改善作用,可抑制氧化應激反應并促進抗凋亡基因的表達等[8]。血清藥物化學研究發現,給予八味沉香散后大鼠血清中共鑒定出16種非揮發性成分、24種揮發性成分,其中30種為原型化合物的入血成分[9]。本實驗采用血清藥理學方法,進一步研究在氧糖剝奪損傷細胞模型中,八味沉香散含藥血清改善心肌缺血損傷的可能機制,以期為八味沉香散的臨床應用提供實驗依據,促進其現代化研究。
1 材料
1.1 細胞與動物
本研究所用細胞為大鼠H9c2細胞(貨號CL-0089),購自武漢普諾塞生命科技有限公司。SPF級雄性SD大鼠50只,體質量200~220 g,購自西安交通大學[實驗動物使用許可證號:SYXK(青)2020-0001],飼養于青海大學醫學院藥學系實驗中心(正常光照、自由飲食)。本實驗所有操作均符合實驗動物倫理學要求,并通過青海大學動物倫理委員會批準(倫理號2021-01)。
1.2 主要儀器
本研究所用主要儀器有SW-CJ-1F型超凈工作臺(蘇州安泰空氣技術有限公司),51119770DP型酶標儀、Pico21型臺式高速低溫冷凍離心機(美國Thermo Fisher Scientific公司),DMi8型熒光顯微鏡、DMi1型倒置顯微鏡(德國Leica公司),Amersham Imager 600型顯影儀(美國通用電氣公司),CytoFLEX S型流式細胞儀(美國Beckman Coulter公司)。
1.3 主要藥品與試劑
本研究所用主要藥品為八味沉香散,購自西藏神猴藥業有限責任公司(批號20210601),由西藏神猴藥業有限責任公司進行分析與鑒定,符合2020年版《中國藥典》(一部)中的要求。用蒸餾水將八味沉香散配制成0.5、0.7、0.8 g/mL的混懸液,備用。
本研究所用主要試劑為胎牛血清(上海依科賽生物制品有限公司,批號FSP500),DMEM無糖培養基、DMEM培養基(武漢普諾賽生命科技有限公司,批號分別為WH0521A291、WH0021D231),RIPA裂解液、青霉素鏈霉素混合液、磷酸鹽緩沖液(PBS)(北京索萊寶科技有限公司,批號分別為R0010、P1400、20201219),乳酸脫氫酶(lactate dehydrogenase,LDH)檢測試劑盒(南京建成生物工程研究所,批號20201225),肌酸激酶(creatine kinase,CK)試劑盒、超氧化物歧化酶(superoxide dismutase,SOD)試劑盒、丙二 醛(malondialdehyde,MDA)試劑盒、過氧化氫酶(catalase,CAT)試劑盒、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)試劑盒和線粒體呼吸鏈復合酶Ⅰ(respiratory chain complexⅠ,ComplexⅠ)試劑盒(上海科興商貿有限公司,批號分別為 F3651-A、F3262-A、F8503-A、F8502-A、F3642-A、F40416-A),BCA蛋白定量試劑盒、Annexin Ⅴ-FITC/PI細胞凋亡檢測試劑盒、線粒體膜電位檢測試劑盒(JC-1)(上海碧云天生物技術有限公司,批號分別為P0009、C1062L、C2003S),2,7-二氯二氫熒光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)活性氧(reactive oxygen species,ROS)熒光探針(德國Sigma公司,批號4091990),兔源凋亡蛋白B細胞淋巴瘤2(B-cell lymphomaz,Bcl-2)相關X蛋白(Bcl-2-associated X protein,Bax)、胱天蛋白酶3(Caspase-3)、細胞色素C(cytochrome C,Cytc)抗體(美國CST公司,批號分別為2772T、14220T、11940S),兔源核轉錄因子E2相關因子2(nuclear factor erythroid 2-related factor 2,Nrf2)抗體、Kelch樣ECH關聯蛋白1(Kelch ECH association protein 1,Keap1)抗體、血紅素加氧酶1(heme oxygenase 1,HO-1)抗體、硫氧還蛋白(thioredoxin,Trx)抗體、抗凋亡蛋白Bcl-2抗體(美國Abcam公司,批號分別為ab92946、ab139729、ab68477、ab109385、ab196495),NADH 氧化還 原酶輔酶 10(NADH oxidoreductase coenzyme 10,Ndufa10)抗體(美國Thermo Fisher Scientific公司,批號336BEA22),內參兔源β-肌動蛋白(β-actin)抗體(美國Proteintech公司,批號236601-1-AP),辣根過氧化物酶標記的兔抗IgG二抗、SuperECL Plus超敏發光液、CCK-8試劑盒(武漢伊萊瑞特生物科技股份有限公司,批號分別為E-AB-1004、E-IR-R308、E-CK-A362)。
2 方法
2.1 八味沉香散含藥血清的制備
將50只大鼠隨機分為空白血清組(20只)和八味沉香散低、中、高劑量組(每組10只),適應性飼養1周。根據藥品說明書劑量和動物體表面積劑量換算公式換算,八味沉香散灌胃劑量為:低劑量2.5 g/kg,中劑量8 g/kg,高劑量12 g/kg(以每日人用劑量進行換算作為低劑量,以該劑量約3倍、5倍作為中、高劑量),空白血清組大鼠灌胃等量生理鹽水,每日3次,共10 d。在末次給藥30 min后腹主動脈取血,于4 ℃冰箱中靜置2 h,以3 000 r/min離心15 min,吸取血清,0.45 μm過濾器過濾、分裝、封口、標記日期和編號,-80 ℃冰箱中保存備用。
2.2 細胞培養
取H9c2細胞株,觀察細胞形態是否異常,若無異常,于常氧培養箱(37 ℃、5% CO2)中適應環境,棄上清,PBS洗3遍,消化細胞,培養基終止消化并吹打均勻,更換新的培養皿繼續培養。細胞融合度達80%左右開始實驗。
2.3 細胞分組、造模與給藥
待H9c2細胞生長至對數生長期時消化、計數并進行培養,置于常氧培養箱(37 ℃、5% CO2)培養24 h。將細胞分為空白組、模型組和八味沉香散低、中、高劑量組(含藥血清劑量依次為2.5、8、12 g/kg,劑量依據同“2.1”項下)。空白組和模型組細胞培養液中加入20%的空白血清,八味沉香散低、中、高劑量組細胞培養液中加入20%相應劑量的八味沉香散含藥血清。空白組置于常氧培養箱(37 ℃、5% CO2)培養。模型組和八味沉香散低、中、高劑量組置于三氣培養箱(2%O2)培養,待培養箱內氣體濃度達到缺氧條件時開始計時,缺氧時間為8 h(此時若LDH釋放量與空白組比較有顯著性差異表示氧糖剝奪損傷模型建立成功)[10]。
2.4 細胞存活率檢測
采用CCK-8法檢測。H9c2細胞接種于96孔板中,按“2.3”項下方法分組與給藥。缺氧結束后,各組細胞加入CCK-8溶液(總體積的10%)并孵育(37 ℃)1 h,用酶標儀檢測450 nm 波長處吸光度(A)值,按試劑盒說明書方法計算細胞存活率(n=6)。
2.5 細胞生化指標檢測
按“2.3”項下方法對H9c2細胞分組與給藥,缺氧結束后,每孔吸出細胞上清液作為待測樣品(n=6)。按LDH、CK、CAT、MDA、SOD、GSH-Px和ComplexⅠ試劑盒要求加入相應試劑檢測其A值,再根據相應的標準曲線計算對應生化指標的水平。
2.6 細胞形態觀察
選取八味沉香散中劑量(最佳藥物濃度血清,下同)作為藥物組濃度[11],按“2.3”項下所述方法對H9c2細胞處理后,于倒置顯微鏡下觀察細胞狀態(如細胞壁結構、死亡細胞數量)并拍照。
2.7 細胞內ROS檢測
選取八味沉香散中劑量作為藥物組濃度,按“2.3”項下方法對H9c2細胞分組與給藥(n=3)。按照 DCFHDA ROS試劑盒說明書方法進行染色,熒光顯微鏡下觀察并通過流式細胞儀檢測:收集各組細胞并用PBS洗滌2次,結合緩沖液重懸后,加入DCFH-DA探針和適量ROS供氫體,37 ℃孵育30 min后,分別用熒光顯微鏡和流式細胞術進行觀察和檢測H9c2心肌細胞氧糖剝奪損傷后的ROS含量(綠色熒光強度越大,表示ROS含量越高)。
2.8 細胞線粒體膜電位檢測
選取八味沉香散中劑量作為藥物組濃度,按“2.3”項下方法對H9c2細胞分組與給藥(n=3)。按照JC-1試劑盒說明書方法進行染色,熒光顯微鏡下觀察并通過流式細胞儀檢測各組細胞線粒體膜電位:收集各組細胞并用PBS洗滌2次,結合緩沖液重懸后,加入JC-1工作液,37 ℃孵育20 min后,分別用流式細胞儀和熒光顯微鏡檢測H9c2細胞氧糖剝奪損傷后線粒體膜電位情況(紅色熒光代表完整細胞膜,綠色熒光代表細胞膜破損)。
2.9 細胞凋亡檢測
選取八味沉香散中劑量作為藥物組濃度,按“2.3”項下方法對H9c2細胞分組與給藥(n=3)。按照 AnnexinⅤ-FITC /PI 試劑盒說明書方法進行染色,熒光顯微鏡下觀察并通過流式細胞儀檢測各組凋亡率:收集各組細胞并用PBS洗滌2次,結合緩沖液重懸后,加入Annexin Ⅴ-FITC、碘化丙啶染色,37 ℃孵育20 min后,分別用流式細胞儀和熒光顯微鏡檢測細胞凋亡率(綠色熒光代表細胞早期凋亡,紅色熒光代表細胞晚期凋亡)。
2.10 細胞氧化應激和凋亡相關蛋白的檢測
選取八味沉香散中劑量作為藥物組濃度,按“2.3”項下方法對H9c2細胞分組與給藥(n=3)。提取各組細胞總蛋白,用BCA試劑盒進行定量。各組蛋白上樣量10 μL,進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳后轉移至PVDF膜上,用5%脫脂牛奶室溫封閉,然后加入一抗(Keap1、Nrf2、Ndufa10、HO-1、Trx、Bcl-2、Cytc、Bax、β-actin和Caspase-3,稀釋度均為1∶1 000)4 ℃孵育過夜,PBS洗滌3次,加入辣根過氧化物酶標記的IgG二抗(稀釋度為1∶2 000)室溫孵育1 h,PBS洗滌3次,暗室中曝光顯影、定影,用Image J軟件檢測各組蛋白條帶灰度值,以目的蛋白條帶與內參蛋白條帶的灰度值比值表示目的蛋白的表達水平。
2.11 統計學處理
采用GraphPad 9.0軟件進行數據分析,計量資料滿足正態分布以±s表示,多組間比較采用單因素方差分析,進一步兩兩比較使用LSD-t檢驗。檢驗水準α=0.05。
3 結果
3.1 含藥血清對氧糖剝奪損傷模型細胞存活率的影響
與空白組(100%)比較,模型組細胞存活率[(80.85±4.73)%]顯著降低(P<0.01);與模型組比較,八味沉香散低、中、高劑量組細胞存活率[依次為(93.08±2.34)%、(106.02±6.22)%、(89.20±8.01)%]均顯著升高(P<0.01,n=6)。
3.2 含藥血清對氧糖剝奪損傷模型細胞生化指標的影響
與空白組比較,模型組細胞上清液中LDH、CK、MDA水平均顯著升高,CAT、GSH-Px、SOD、ComplexⅠ水平均顯著降低(P<0.01);與模型組比較,八味沉香散低、中、高劑量組細胞上清液中LDH、CK、MDA水平均顯著降低(P<0.01),CAT(低劑量組除外)、GSH-Px(低、高劑量組除外)、SOD、ComplexⅠ(低劑量組除外)水平均顯著升高(P<0.01)。結果見表1。
表1 各組細胞上清液中生化指標比較(±s,n=6)
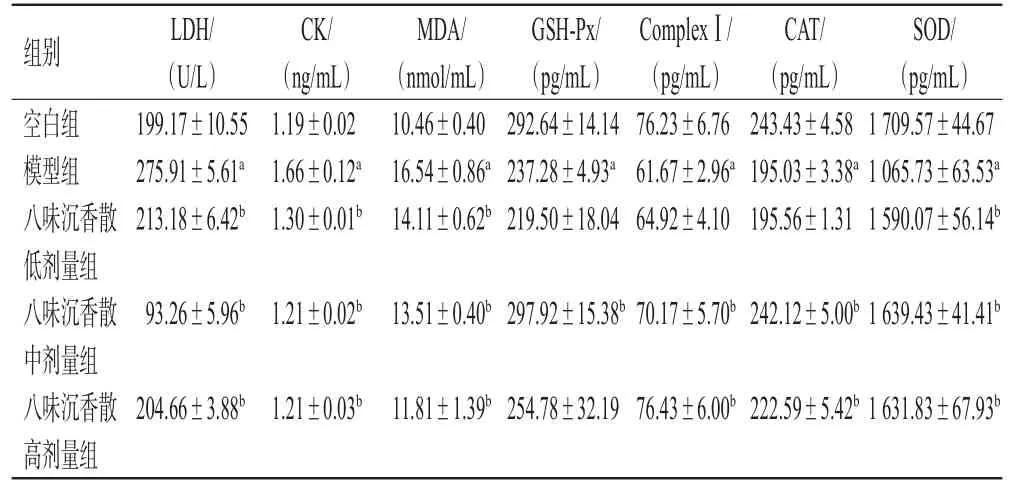
表1 各組細胞上清液中生化指標比較(±s,n=6)
a:與空白組比較,P<0.01;b:與模型組比較,P<0.01
組別空白組模型組八味沉香散低劑量組八味沉香散中劑量組八味沉香散高劑量組LDH/(U/L)199.17±10.55 275.91±5.61a 213.18±6.42b CK/(ng/mL)1.19±0.02 1.66±0.12a 1.30±0.01b MDA/(nmol/mL)10.46±0.40 16.54±0.86a 14.11±0.62b GSH-Px/(pg/mL)292.64±14.14 237.28±4.93a 219.50±18.04 ComplexⅠ/(pg/mL)76.23±6.76 61.67±2.96a 64.92±4.10 CAT/(pg/mL)243.43±4.58 195.03±3.38a 195.56±1.31 SOD/(pg/mL)1 709.57±44.67 1 065.73±63.53a 1 590.07±56.14b 93.26±5.96b 1.21±0.02b 13.51±0.40b 297.92±15.38b 70.17±5.70b 242.12±5.00b 1 639.43±41.41b 204.66±3.88b 1.21±0.03b 11.81±1.39b 254.78±32.1976.43±6.00b 222.59±5.42b 1 631.83±67.93b
3.3 含藥血清對氧糖剝奪損傷模型細胞形態的影響
顯微鏡觀察結果顯示,空白組細胞的細胞壁結構完整、邊緣清晰,死細胞數量較少;模型組細胞的細胞質內顆粒物增多,大多數心肌細胞形狀變得短粗,細胞壁破損明顯、結構不完整,死細胞數量顯著增加,損傷加重。八味沉香散中劑量組細胞的細胞壁結構完整、邊緣清晰,形狀較少改變,死細胞數量較少。結果見圖1。
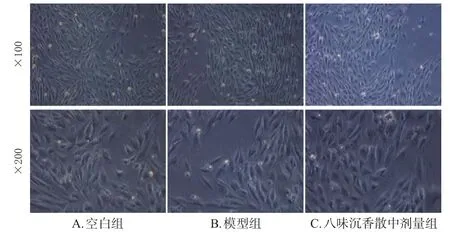
圖1 各組H9c2細胞形態的顯微圖
3.4 含藥血清對氧糖剝奪損傷模型細胞內ROS的影響
與空白組[(33.80±2.82)%]比較,模型組細胞內ROS含量[(68.63±8.66)%]顯著升高;與模型組比較,八味沉香散中劑量組細胞內ROS含量[(35.40±11.44)%]顯著降低(P<0.01)。結果見圖2、圖3。
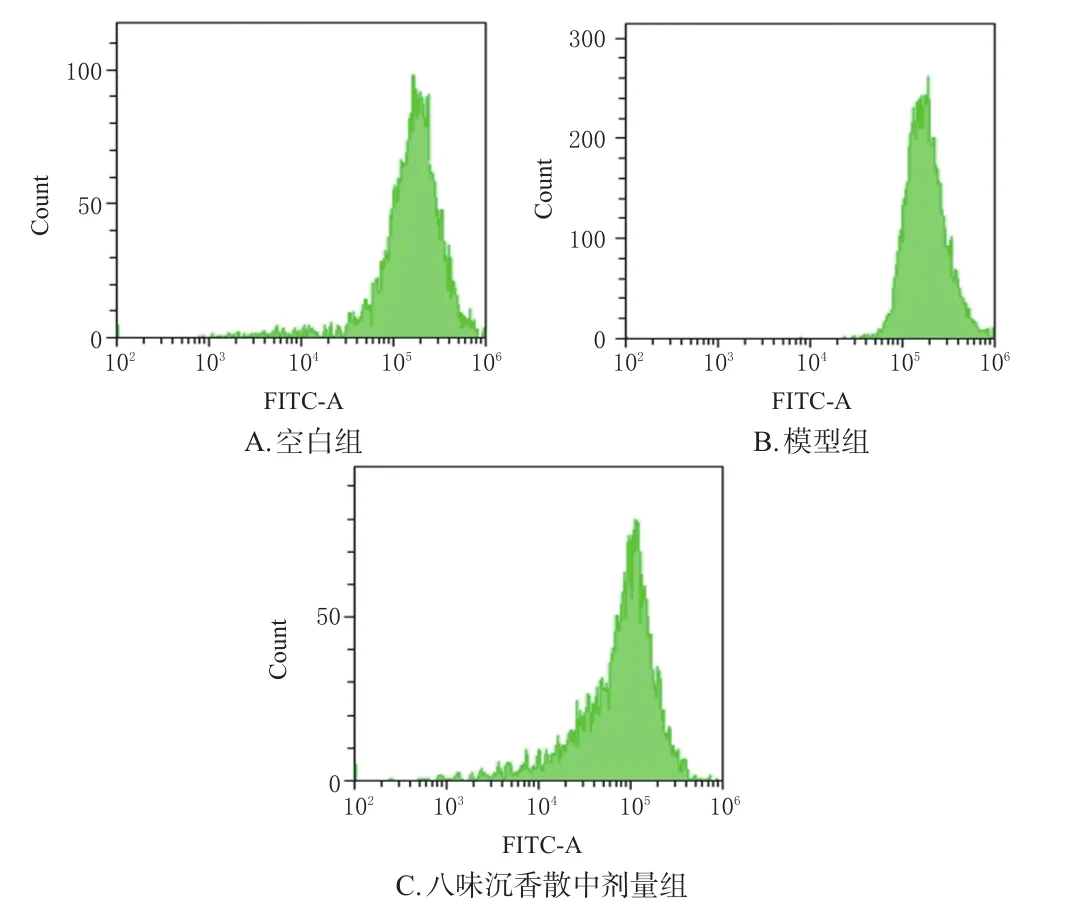
圖2 各組細胞內ROS流式圖
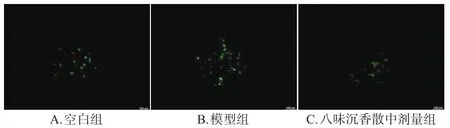
圖3 各組細胞內ROS熒光顯微圖(×40)
3.5 含藥血清對氧糖剝奪損傷模型細胞線粒體膜電位的影響
與空白組[(85.02±0.72)%]比較,模型組細胞線粒體膜電位[(74.70±1.43)%]顯著降低;與模型組比較,八味沉香散中劑量組細胞線粒體膜電位[(87.36±0.59)%]顯著升高(P<0.01)。結果見圖4、圖5。
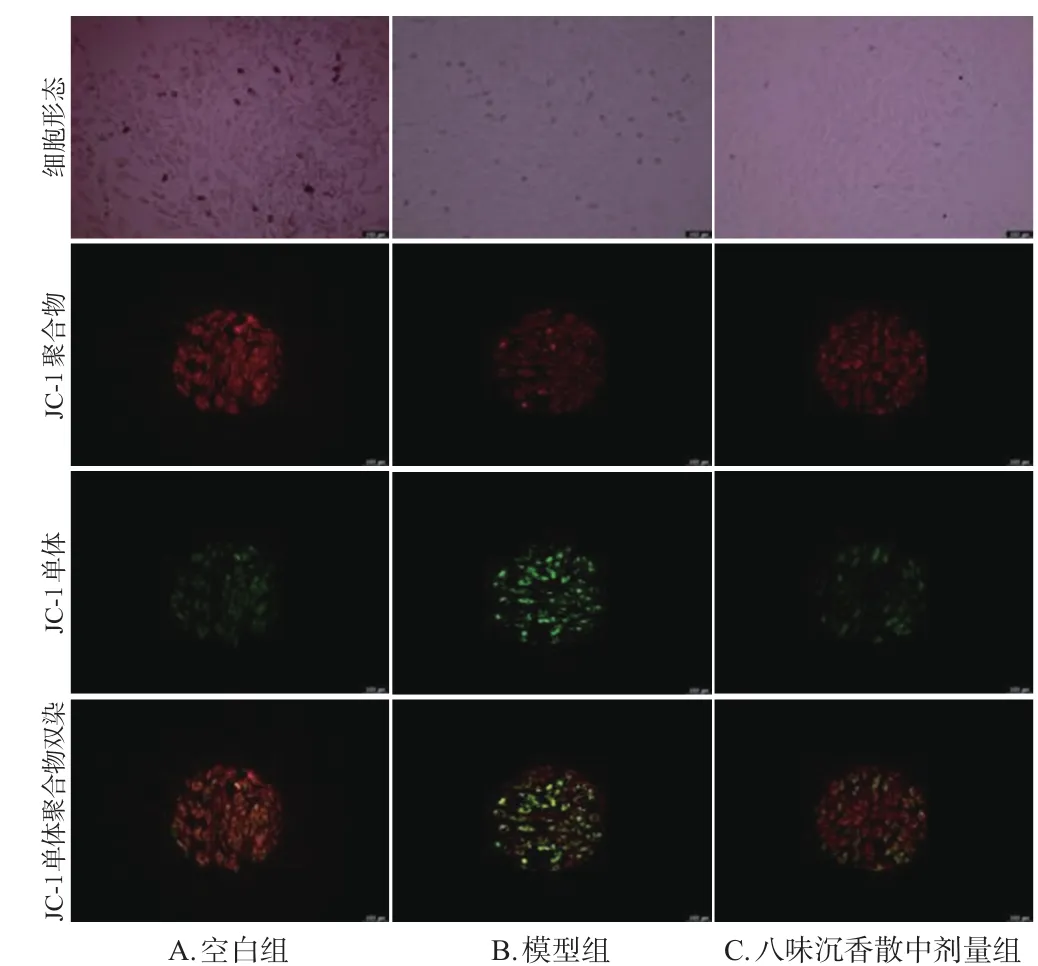
圖4 各組細胞線粒體膜電位熒光顯微圖(×40)
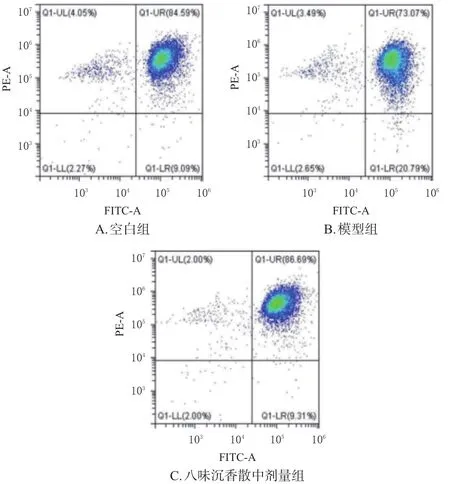
圖5 各組細胞線粒體膜電位流式圖
3.6 含藥血清對氧糖剝奪損傷模型細胞凋亡的影響
與空白組[(17.50±2.35)%]比較,模型組細胞凋亡率[(44.52±3.75)%]顯著升高;與模型組比較,八味沉香散中劑量組細胞凋亡率[(32.50±5.09)%]顯著降低(P<0.01)。結果見圖6、圖7。
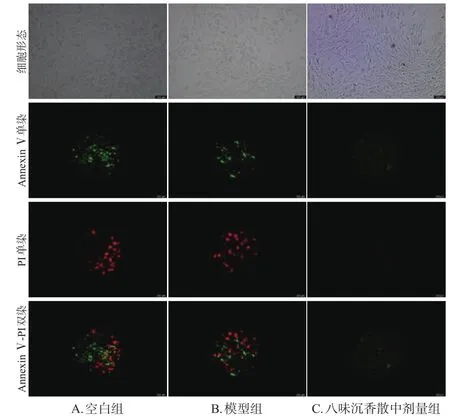
圖6 各組細胞凋亡熒光顯微圖(×40)
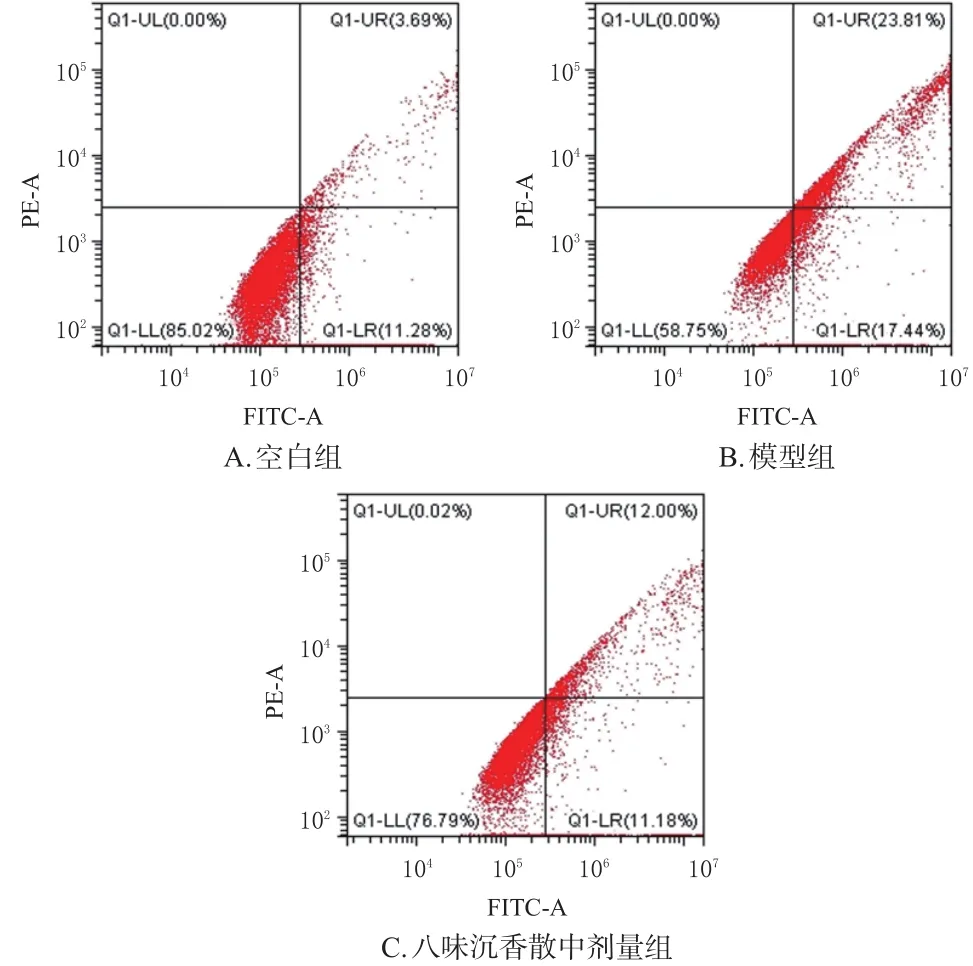
圖7 各組細胞凋亡流式圖
3.7 含藥血清對氧糖剝奪損傷模型細胞氧化應激相關蛋白表達的影響
與空白組比較,模型組細胞中Keap1、Nrf2、Ndufa10、HO-1和Trx的蛋白表達水平均顯著升高;與模型組比較,八味沉香散中劑量組細胞中Keap1、Nrf2、HO-1、Trx的蛋白表達水平均顯著降低(P<0.05)。結果見表2、圖8。
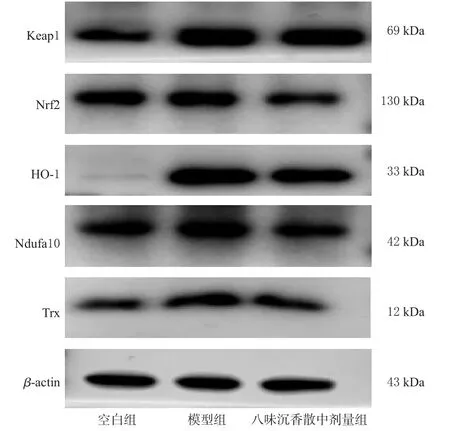
圖8 各組細胞中氧化應激相關蛋白表達的電泳圖
表2 各組細胞氧化應激相關蛋白表達水平的檢測結果(±s,n=3)

表2 各組細胞氧化應激相關蛋白表達水平的檢測結果(±s,n=3)
a:與空白組比較,P<0.05;b:與模型組比較,P<0.05
組別空白組模型組八味沉香散中劑量組Trx 0.55±0.12 1.16±0.14a 0.75±0.19b Keap1 0.71±0.07 1.04±0.09a 0.65±0.03b Nrf2 0.84±0.03 0.96±0.03a 0.55±0.03b HO-1 0.05±0.01 1.18±0.23a 0.82±0.03b Ndufa10 0.72±0.07 1.02±0.08a 0.74±0.11b
3.8 含藥血清對氧糖剝奪損傷模型細胞凋亡相關蛋白表達的影響
與空白組比較,模型組細胞中促凋亡蛋白Cytc、Bax和Caspase-3的表達水平顯著升高,抗凋亡蛋白Bcl-2表達水平顯著降低(P<0.05)。與模型組比較,八味沉香散中劑量組細胞中Cytc、Bax和Caspase-3蛋白表達水平均顯著降低,Bcl-2蛋白表達水平顯著升高(P<0.05)。結果見表3、圖9。
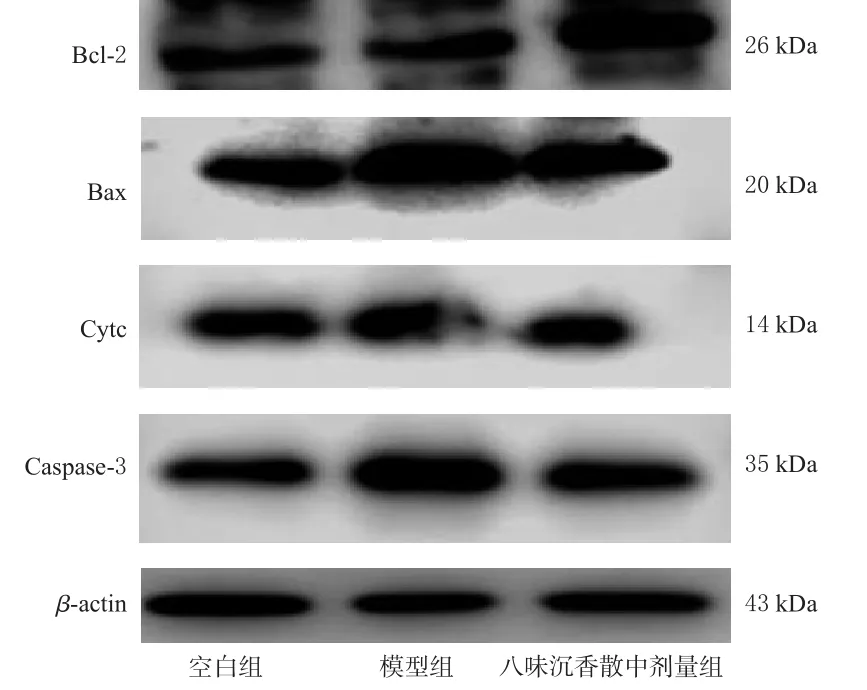
圖9 各組細胞中凋亡相關蛋白表達的電泳圖
表3 各組細胞中凋亡相關蛋白表達水平的檢測結果(±s,n=3)
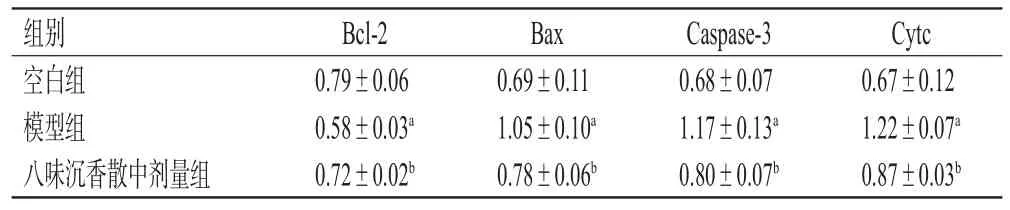
表3 各組細胞中凋亡相關蛋白表達水平的檢測結果(±s,n=3)
a:與空白組比較,P<0.05;b:與模型組比較,P<0.05
組別空白組模型組八味沉香散中劑量組Bcl-2 0.79±0.06 0.58±0.03a 0.72±0.02b Bax 0.69±0.11 1.05±0.10a 0.78±0.06b Caspase-3 0.68±0.07 1.17±0.13a 0.80±0.07b Cytc 0.67±0.12 1.22±0.07a 0.87±0.03b
4 討論
心肌缺血發病機制復雜,氧化應激和細胞凋亡是心肌缺血病理生理學中密切相關的兩部分,自由基損傷和氧化應激是缺血再灌注損傷的關鍵環節并參與了損傷級聯反應的每個步驟[12]。抑制細胞凋亡是心肌缺血治療中的保護策略之一[13]。H9c2細胞被廣泛用于心血管系統疾病藥物作用的研究。氧糖剝奪損傷模型能最大程度模擬心肌缺血病理生理情況下的細胞狀態,是心肌缺血研究的經典細胞模型。基于此,本文建立H9c2細胞的氧糖剝奪損傷模型,探討八味沉香散含藥血清對心肌缺血的保護機制。
“血清藥理學”通過灌胃等方式讓動物服藥并在一段時間后采集血液、分離血清,將血清作為藥源進行觀察。該方法在給藥后,使藥物在體內產生藥物效應,其原有成分可以在體內轉化為活性成分或代謝后失活,或沒有被體內吸收,或通過第二信使而間接起作用[14]。這是目前研究復方中藥、民族藥體外藥理學常用的方法之一,且在一定程度上能反映出藥物的有效作用和分子機制。因此本研究采用血清藥理學方法探討藥物在細胞層面的抗氧化應激、抗凋亡機制。
本課題組前期通過超高效液相色譜-四極桿/靜電場軌道阱高分辨質譜和氣相色譜-質譜聯用技術,對八味沉香散灌胃大鼠后的血清進行鑒定,入血成分中有7種成分具有抗氧化作用,其中秦皮乙素能有效清除自由基[15],綠原酸能夠螯合金屬離子和清除自由基[16],沒食子酸甲酯和沒食子酸乙酯均具有抗氧化損傷活性[17—18],山柰酚具有較強的抗氧化活性[19],槲皮素對因氧化應激導致的疾病有很好的預防和治療作用[20],甲基丁香酚可抑制缺氧/復氧損傷后人腎小管上皮細胞內ROS的釋放[21]。由此推測這些化合物可能是八味沉香散通過抗氧化應激作用發揮保護心肌細胞作用的有效成分。
相關文獻研究表明,八味沉香散含藥血清在不影響細胞存活率的前提下可提高氧糖剝奪損傷的H9c2細胞存活率,這可能與其降低細胞氧化損傷和抑制細胞凋亡相關。當細胞受到缺氧損傷時,細胞膜受損,導致細胞質內的LDH和CK釋放,因此LDH和CK的釋放量與細胞受損程度相關,可作為藥物細胞毒性評價指標。本實驗結果顯示,H9c2細胞氧糖剝奪損傷后,給予八味沉香散含藥血清可抑制LDH和CK的釋放,保護細胞膜完整性。氧化應激是心肌細胞缺血損傷的主要病理機制之一。心肌缺血后持續的氧化應激導致細胞代謝副產物——ROS堆積,而此時在正常生理狀態下機體維持氧化-抗氧化系統平衡的內源性抗氧化劑SOD和GSH等不足以清除ROS[22]。這種失衡導致細胞中調控ROS的相應蛋白、相關氧清除劑和ROS相關因子發生了改變,進而氧化細胞大分子如蛋白質和脂質等,加劇機體損傷。由此本研究進行了氧化應激相關指標的檢測,結果顯示,氧糖剝奪損傷后,ROS大量生成,抗氧化物質CAT、ComplexⅠ、SOD、GSH-Px等被大量消耗,持續生成的ROS自由基作用于脂質發生過氧化反應生成MDA,加劇細胞膜損傷,調控氧化應激的相關蛋白(Keap1、Nrf2、Ndufa10、HO-1和Trx)表達升高;而給予八味沉香散含藥血清可降低細胞內ROS含量,提高以ROS為底物的抗氧化物質CAT、ComplexⅠ、SOD、GSH-Px水平,降低脂質過氧化產物MDA水平,降低氧化應激相關蛋白(Keap1、Nrf2、Ndufa10、HO-1、Trx)表達,初步驗證了八味沉香散含藥血清降低細胞氧化損傷的作用。
ROS簇的形成和積累沒有得到有效清除并攻擊線粒體造成線粒體滲透性轉換孔開放,致使線粒體膜電位下降,并促使細胞色素C和凋亡誘導因子等凋亡蛋白釋放到細胞質中,進而導致內源性細胞凋亡[23];而顯微鏡下可觀察到細胞形態學表現為死細胞數量變多,細胞皺縮變圓,細胞壁邊界不顯著等[24]。因此本研究進一步對細胞凋亡指標進行檢測,結果顯示,給予八味沉香散含藥血清后能夠提高氧糖剝奪損傷的H9c2細胞的線粒體膜電位,并改善細胞壁邊界形態和減少死細胞數量,同時減少Annexin Ⅴ-FITC/PI雙染細胞凋亡的數量,升高抗凋亡蛋白Bcl-2的表達,降低促凋亡蛋白Bax、Cytc、Caspase-3的表達,提示八味沉香散含藥血清具有良好的抗凋亡作用,進一步表明八味沉香散含藥血清對H9c2細胞氧糖剝奪損傷具有保護作用。
綜上所述,八味沉香散對H9c2細胞氧糖剝奪損傷具有保護作用,這一作用是通過平衡氧化應激反應、抑制凋亡的產生而實現的。本實驗仍存在不足之處,如缺乏對藥物量效關系的探究。在后續實驗中,本課題組將結合經典動物模型對八味沉香散量效關系進行探索,進一步探討八味沉香散對心肌缺血的保護作用。

