線粒體活性氧在機械通氣導致的膈肌功能障礙中作用的研究進展
張菊梅,涂 銳,關發升,李學欣,劉 力(西南醫科大學附屬醫院麻醉科,瀘州 646000;通訊作者,E-mail:niuniudoctor@hotmail.com)
機械通氣(mechanical ventilation)是一種挽救生命的干預措施,全球每年有超過1 500萬患者在外科手術和危重疾病中使用機械通氣來提供充足的肺通氣[1]。然而,機械通氣是一把雙刃劍,長期的機械通氣會導致膈肌纖維萎縮和收縮力下降從而引起明顯的膈肌功能障礙,稱為呼吸機誘導的膈肌功能障礙(ventilator-induced diaphragm dysfunction,VIDD)。VIDD不僅對患者生存率和預后有顯著不良影響,也是臨床上導致脫機困難的主要原因,會產生較大的醫療負擔。超過50%的機械通氣患者在氣管插管24 h之內迅速出現VIDD,其發生率與通氣時間的延長、撤機困難、再插管率存在明顯相關性[2]。目前,臨床尚缺乏預防和治療VIDD的相應措施,因此對VIDD發生機制的詳細了解對防治機械通氣誘發的膈肌功能障礙至關重要。雖然導致VIDD發生的機制有多種,但已經確定VIDD的發生發展與線粒體活性氧(reactive oxygen species, ROS)的釋放密切相關,ROS是VIDD發病機制的關鍵上游激活因子,膈肌中活性氧水平的升高進而引起氧化應激損傷是造成膈肌功能障礙的先決條件[3]。長時間的機械通氣會導致線粒體ROS釋放的顯著增加,線粒體是ROS產生的主要來源,而ROS的產生增加與膈肌氧化應激、蛋白水解、自噬與凋亡、線粒體功能障礙等都有緊密聯系[4]。本文綜述了線粒體ROS在呼吸機誘導的膈肌功能障礙中作用的進展,主要包括ROS與氧化應激、ROS與蛋白水解系統(即泛素-蛋白酶體、自噬、半胱天冬酶-3和鈣蛋白酶)之間的相互關系、ROS對胞質磷脂酶A2的激活、活性氧與線粒體功能障礙之間的惡性循環等,希望能為VIDD的治療和預防提供新的幫助。
1 機械通氣時線粒體ROS的產生與氧化應激
1.1 線粒體活性氧
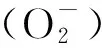
1.2 機械通氣中膈肌的氧化應激反應
正常生理情況下體內氧自由基的產生與清除是平衡的,一旦氧自由基產生過量或抗氧化系統出現障礙,體內氧自由基代謝就會紊亂失衡或者稱為氧化應激。Hyatt等[10]測量了大鼠在機械通氣12 h膈肌過氧化氫和氧化損傷標志物4-羥基壬烯醛(4-hydroxynonenal,4-HNE)表達量明顯高于對照組,同時膈肌肌纖維的橫截面積和肌力低于對照組。膈肌線粒體活性氧的釋放明顯增加,超過了抗氧化體系的處理范圍,造成氧自由基代謝失衡。多聚不飽和脂肪酸是生物膜磷脂的主要成分,氧自由基對其中多個弱鍵和不飽和鍵有非常高的親和力,尤其能使生物膜的多不飽和脂肪酸發生脂質過氧化。細胞膜脂質過氧化,一方面自由基與膜上的酶和(或)受體共價結合,改變膜成分的活性及其結構,另一方面膜上巰基被氧化,造成膜運動過程紊亂,導致膜流動性下降,膜脆性增加,細胞內外離子交換障礙,出現細胞膜變性、通透性和流動性改變,影響細胞膜的結構和功能[11]。Whidden等[12]用抗氧化劑Trolox治療大鼠可以防止機械通氣導致的膈肌蛋白氧化和脂質過氧化。Powers等[4]研究了在使用了線粒體靶向抗氧化劑時,大鼠機械通氣12 h的ROS明顯降低,同時氧化損傷標志物也相應的降低,因此,他們認為機械通氣導致的線粒體活性氧增加會激活氧化應激系統,導致膈肌組織氧化損傷標志物增加,進而導致膈肌受損而引起膈肌功能障礙。
2 機械通氣時線粒體ROS激活膈肌蛋白水解系統
2.1 蛋白水解系統
研究表明,蛋白水解系統,即泛素-蛋白酶體、自噬、半胱天冬酶-3和鈣蛋白酶,在機械通氣延長期間都在膈肌中被激活[8,13]。已經確定機械通氣時膈肌萎縮是由蛋白水解的加速和蛋白合成減少引起,其中蛋白水解增加起主要作用[14]。胞漿蛋白和肌原纖維蛋白的降解都是一個多步驟的過程,需要多種蛋白水解成分的共同作用,包括半胱天冬酶-3、鈣蛋白酶、泛素-蛋白酶體和自噬/溶酶體蛋白水解系統[15]。機械通氣誘導的活性氧釋放增加是激活蛋白水解系統的關鍵事件(見圖1),也導致肌原纖維蛋白降解敏感性增加,使其被氧化修飾從而更易被蛋白水解系統降解。
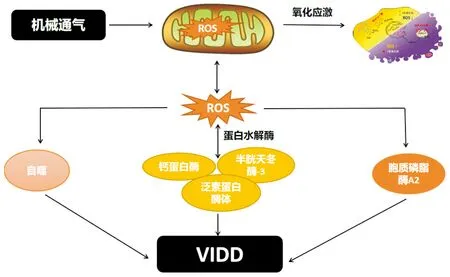
圖1 ROS在呼吸機誘導的膈肌功能障礙中的作用
2.2 機械通氣時線粒體ROS與鈣蛋白酶和半胱天冬酶-3
蛋白水解系統近年來在VIDD被廣泛研究,研究發現在機械通氣中膈肌萎縮的發生與膈肌蛋白的水解是密不可分的,而線粒體活性氧的產生是機械通氣后膈肌蛋白水解系統激活的關鍵上游調節因子[12]。膈肌本身是非常活躍的肌肉,當機械通氣時,膈肌處于廢用狀態,蛋白水解系統被激活,促進膈肌萎縮和肌無力的發生。
鈣蛋白酶是一種半胱氨酸蛋白酶,在許多病理條件下(例如,長時間廢棄和敗血癥等)被激活,鈣蛋白酶長期以來一直被稱為是能夠降解肌肉細胞骨架蛋白的鈣依賴蛋白酶。與鈣蛋白酶類似,半胱天冬酶-3也是一種半胱氨酸蛋白酶,可通過多種信號通路在細胞內被激活[16]。兩者都在機械通氣的膈肌中被上調,鈣蛋白酶和半胱天冬酶系統在蛋白水解上表現出大量協同作用。研究發現,依賴ATP的泛素蛋白酶體途徑參與了機械通氣期間膈肌肌原纖維蛋白的降解過程[12,17]。雖然泛素蛋白酶體途徑可以降解許多細胞蛋白,但這個蛋白水解系統不能降解完整的肌動-球蛋白復合物[18]。由此可見,肌動-球蛋白復合物必須從肌節中解離釋放出來,才能被蛋白酶體系統降解。有證據表明,鈣蛋白酶和半胱天冬酶-3能夠讓肌動-球蛋白解離,鈣蛋白酶能夠降解大量促進肌絲釋放的肌肉蛋白,利于后續肌原纖維的降解[19]。盡管機械通氣期間膈肌中有幾種蛋白水解系統被激活,但鈣蛋白酶和半胱天冬酶-3的激活對機械通氣誘導的膈肌萎縮至關重要。Whidden等[12]發現使用抗氧化劑Trolox減弱機械通氣誘導的氧化應激,同時也阻止了機械通氣期間膈肌中鈣蛋白酶和半胱天冬酶-3的激活。此外,避免機械通氣誘導的氧化應激不僅減少了這些蛋白酶的激活,而且挽救了機械通氣誘導的膈肌肌纖維萎縮和收縮功能障礙。Powers等[7]在大鼠機械通氣12 h前通過使用線粒體靶向抗氧化劑可以降低鈣蛋白酶和半胱天冬酶-3的活性,而沒有使用線粒體靶向抗氧化劑時,鈣蛋白酶和半胱天冬酶-3的活性顯著高于使用了線粒體靶向抗氧化劑組。使用線粒體靶向抗氧化劑減少機械通氣誘導的線粒體ROS釋放可以部分減少膈肌纖維中鈣蛋白酶和半胱天冬酶-3的激活,所以活性氧是機械通氣時激活膈肌中鈣蛋白酶和半胱天冬酶-3所需的上游信號分子。活性氧激活蛋白酶的機制可能是活性氧作為一種氧化劑增加胞質鈣水平,觸發信號通路,激活鈣蛋白酶。
相對而言,蛋白水解系統激活也可以導致在長時間機械通氣中線粒體功能障礙和活性氧釋放增加。研究表明,在大鼠機械通氣的模型中抑制了鈣蛋白酶的活性,阻止了線粒體活性氧的釋放增加,改善了膈肌功能障礙[10]。在機械通氣過程中,線粒體活性氧釋放增加可以激活蛋白水解酶,而蛋白水解酶激活后同樣可以在長時間的機械通氣中促進活性氧的產生增加。蛋白水解酶和活性氧可能存在相互促進的關系,共同導致VIDD的發生。
2.3 機械通氣時線粒體ROS激活自噬
自噬是一個正常的生理分解代謝過程,主要包括胞質蛋白和細胞器的溶酶體降解過程。一般來說,自噬在肌肉組織中以低水平持續發生,涉及溶酶體降解胞質蛋白和細胞器,對于維持功能失調的細胞溶質的分解很重要[20]。在機械通氣延長期間,嚙齒動物和人類的膈肌也會激活自噬,表現為自噬蛋白的表達增多和自噬小體的形成[21]。在VIDD中,自噬是一把雙刃劍。理論上,根據不同的條件,加速的自噬可以對骨骼肌產生保護或有害作用。具體來說,正常肌肉功能需要基礎水平的自噬,特定自噬基因的缺失會導致顯著的功能缺陷。然而,在病理條件下,自噬可以大大增加,以促進有害的蛋白質去除速率。機械通氣誘導的自噬增加,一方面可以去除受損的細胞器,對機體產生保護作用;另一方面可以通過消除肌肉纖維中正常的結構和胞質蛋白來促進膈肌萎縮[22]。機械通氣延長激活了膈肌中的自噬,但自噬在機械通氣中的作用在不同研究中有不同的解釋,可能原因是動物模型、通氣時間和干預方式不同[2,8,23]。研究表明,機械通氣期間膈肌中線粒體ROS的產生是關鍵的自噬基因(即LC3、Atg7、Atg12、Beclin1和p62)表達增加所必需的[24]。目前的研究證明,機械通氣誘導的線粒體ROS產生是膈肌自噬蛋白表達增加的必要條件[25]。Smuder等[8]發現,在對機械通氣的大鼠提前使用線粒體靶向抗氧化肽SS-31既阻止了機械通氣誘導的自噬特異性生物標志物的表達,也阻止了膈肌中自噬小體形成的增加。Smuder等[8]已經預測自噬上調通過消除過氧化物酶體,而導致細胞ROS的增加。相反,自噬抑制減少了機械通氣誘導的橫膈膜ROS的產生,并阻止了由此導致氧化應激刺激自噬的增加,防止了ROS和自噬的進一步增加,阻止了這個正反饋回路。這些結果表明,在機械通氣中,氧化應激和自噬之間存在一種調節交叉作用,通過氧化應激刺激自噬的增加,自噬的增加又導致ROS的產生增多。
2.4 機械通氣時線粒體ROS與泛素-蛋白酶體途徑
泛素-蛋白酶體途徑(ubiquitin-proteasome pathway, UPP)參與調控機體多數生命過程包括生長、發育、基因轉錄、細胞分化凋亡等活動。泛素-蛋白酶體途徑是通過調控蛋白質水平來參與上述生命活動[26]。泛素-蛋白酶體途徑在體內是一種十分高效的蛋白分解途徑,在很多細胞代謝中起調節作用。研究發現,泛素-蛋白酶體途徑參與了機械通氣期間肌原纖維蛋白的降解[27]。研究者在機械通氣時測量了20S蛋白酶體的活性以及膈肌中兩種重要肌肉特異性E3連接酶(Atrogin-1/MAFbx和MuRF-1)的mRNA和蛋白水平。結果表明,通過線粒體靶向抗氧化劑阻止機械通氣誘導的線粒體ROS釋放,可以阻止機械通氣誘導的膈肌20S蛋白酶體活性的增加。此外,數據表明,機械通氣延長導致兩組膈肌Atrogin-1/MAFbx和MuRF-1 mRNA水平顯著升高,目前它們被廣泛作為膈肌纖維萎縮的標志物。然而,線粒體靶向抗氧化劑處理的大鼠明顯鈍化了機械通氣誘導的橫膈膜Atrogin-1/MAFbx和MuRF-1mRNA水平的升高[21,28]。Smuder等[29]發現泛素-蛋白酶體途徑在12 h的機械通氣組是活躍的,用蛋白酶體抑制劑處理機械通氣的大鼠可以部分減弱機械通氣誘導的膈肌收縮力下降,但不能防止機械通氣誘導的膈肌纖維萎縮,蛋白酶體抑制劑對機械通氣誘導的膈肌收縮功能障礙有部分保護作用,但泛素-蛋白酶體途徑激活不是機械通氣12 h內VIDD的主要貢獻者[29]。研究表明氧化應激促進泛素-蛋白酶體途徑功能所需蛋白的表達增加,特別是肌管暴露于過氧化氫足以增加特異性泛素連接酶的表達[27]。因此,活性氧的增加可以通過UPP促進肌肉蛋白質的降解,最后引起膈肌萎縮和功能障礙。研究發現在膈肌中過表達線粒體超氧化物歧化酶2(SOD2)可部分減弱機械通氣誘導的E3泛素連接酶MuRF1和Atroin-1 mRNA表達增加[30]。4-HNE在脂質過氧化級聯過程中形成,4-HNE修飾的蛋白加合物的測量是肌肉氧化損傷的一個極好的生物標志物,機械通氣導致4-HNE修飾的蛋白在大鼠膈肌中的積累顯著增加,然而,用泛素-蛋白酶體抑制劑治療動物未能減少機械通氣誘導的膈肌氧化損傷標志物的增加,也沒有減少ROS的生成[29]。因此,線粒體活性氧的產生可能會促進泛素-蛋白酶體途徑的激活,相反,泛素-蛋白酶體途徑對活性氧產生并沒有影響。
3 線粒體ROS與胞質磷脂酶A2
胞質磷脂酶A2(cPLA2)介導脂質介體的產生,在炎癥和組織損傷、膜通道的活化、信息傳遞、血流動力學以及調節細胞內外代謝中起了重要作用,因此它被認為參與了很多器官系統的穩態調節過程和疾病的發生機制。據報道,胞質磷脂酶A2對感染誘導的線粒體ROS產生和膈肌功能障礙至關重要[31]。Zhou等[32]發現機械通氣12 h誘導了大鼠膈肌cPLA2的激活以及過度線粒體活性氧生成和肌肉無力的發生。膈肌線粒體ROS的形成可能嚴重依賴于cPLA2的激活,可能是因為cPLA2可破壞線粒體膜上的磷脂,造成線粒體功能障礙,產生過量的活性氧。研究發現用特異性抑制劑抑制cPLA2活性可以導致線粒體活性氧水平降低和膈肌力量改善[32,33]。此外,使用線粒體靶向抗氧化劑在機械通氣大鼠體內減弱了呼吸機誘導的線粒體氧化應激并下調了cPLA2活性,抑制cPLA2活化可以減弱呼吸機誘導的蛋白質降解、肌肉萎縮。總的來說,長時間機械通氣后膈肌中線粒體活性氧的產生部分依賴于cPLA2的激活,另一方面,線粒體氧化應激也促進膈肌cPLA2激活。因此,cPLA2和線粒體活性氧之間的正反饋回路可能加速了VIDD的發展[32]。
4 線粒體ROS與線粒體功能障礙
在長時間機械通氣中,線粒體活性氧的產生增加,活性氧與線粒體膜發生過氧化反應,會使線粒體膜的結構完整性受到破壞。ROS攻擊線粒體膜導致線粒體膜通透性的增加,造成線粒體Ca2+內流增多,線粒體Ca2+急劇的升高一方面加速了黃嘌呤脫氫酶和黃嘌呤氧化酶的轉化,增加了ROS的生成,另一方面磷脂酶A2和磷脂酶C被激活使線粒體膜磷脂大量降解,導致線粒體膜內花生四烯酸含量成倍增加,降低電子傳遞鏈的活性,呼吸鏈的損傷使線粒體合成ATP的功能發生障礙,氧化磷酸化功能受損,這樣又導致Ca2+內流、氧自由基生成,形成一個“惡性循環”,結果造成膜運動過程紊亂,導致膜流動性下降、膜脆性增加、細胞內外離子交換障礙,出現細胞膜變性、線粒體腫脹、空泡化、嵴斷裂,通透性和流動性改變,造成線粒體呼吸功能障礙、能量代謝衰竭,膈肌無力的發生[34]。氧化應激在VIDD發病機制中發揮著重要作用,線粒體源性ROS尤其有可能直接損傷線粒體成分,包括mtDNA,而且線粒體生物發生通常伴隨著抗氧化機制的上調。Leduc-Gaudet等[35]通過測量羰基化蛋白來評估氧化應激水平,比較了小鼠機械通氣6 h和使用線粒體靶向抗氧化劑后再機械通氣6 h的氧化應激水平和線粒體功能狀況,數據表明線粒體功能障礙是氧化應激和膈肌收縮力受損之間的聯系。可能是因為線粒體功能障礙導致活性氧的產生增加和氧化應激增加,ATP生成障礙導致收縮力下降。Morton等[36]通過在膈肌中過表達線粒體抗氧化酶超氧化物歧化酶2(SOD2),研究是否對機械通氣誘導的線粒體功能障礙具有保護作用,他們測量了狀態3和狀態4下的線粒體呼吸。在過表達SOD2的機械通氣大鼠中,線粒體呼吸功能得到部分保護,線粒體氧化磷酸化功能得到改善[36]。線粒體功能障礙和活性氧釋放增加是VIDD的標志,也是VIDD的一個成因。
5 小結與展望
線粒體活性氧對機械通氣誘導的膈肌萎縮和收縮功能障礙是必需的,線粒體活性氧在VIDD的發生發展的許多環節都扮演了重要的角色,且各個環節之間相互聯系,共同導致了VIDD的發生。活性氧作為一個關鍵的激活因子,參與了VIDD的蛋白水解、氧化應激、線粒體功能障礙等多個環節。目前,VIDD臨床尚無特異治療方法,本文總結了活性氧在VIDD中發揮的作用,為臨床上線粒體靶向抗氧化劑預防和治療VIDD提供了可能。機械通氣是通過何種機制引起活性氧釋放增加,以及活性氧激活蛋白水解系統的具體分子機制還需要在未來深入研究。由于人類倫理的限定,VIDD機制的研究大多是在動物模型上,但隨著無創膈肌超聲的發展,膈肌功能測定有了更簡便無創的辦法,使更多關于VIDD的臨床研究成為了可能。

