對比腹腔鏡肝切除術與射頻消融術對原發性肝癌患者肝功能、T淋巴細胞亞群水平的影響
陳煌祥
原發性肝癌主要是指肝細胞或肝內膽管細胞發生的癌癥,發病機制尚未明確,可受到多種因素影響,發病率極高[1]。患者臨床典型癥狀為肝區疼痛、乏力、腹脹,若不及時治療,病情進展到終末期,則會出現擴散、轉移,嚴重威脅著患者生命健康[2]。目前,手術是治療肝癌的首選方案,在肝癌早期進行手術治療,可有效延緩疾病進程,取得一定治療效果。其中腹腔鏡肝切除術是臨床常采用的一種治療方法,能夠根治性切除腫瘤病變組織。但由于肝臟手術復雜多變,手術治療難度較大,且采用該術式存在很大視野暴露問題、術中出血量較多,容易產生應激反應,增加手術風險,不利于改善預后[3-4]。近年,隨著微創、介入技術地不斷發展,射頻消融術逐漸得以運用于醫學各領域,并取得較好的效果[5]。有學者指出,對原發性肝癌患者實施腹腔鏡射頻消融術治療,不僅能夠通過物理、化學方法損毀腫瘤病變組織,還能減少創傷,進而減少患者產生應激反應,利于改善預后[6]。基于此,本文將重點探討腹腔鏡肝切除術與射頻消融術對原發性肝癌患者肝功能、T 淋巴細胞亞群水平的影響,并做以下調查報告。
1 資料與方法
1.1 一般資料 選取龍巖市第二醫院2019 年11 月-2021 年11 月收治的64 例原發性肝癌患者作為本次觀察對象,納入標準:參照文獻[7]經臨床病理學診斷確診為原發性肝癌;肝功能分級C 級以下;無門靜脈血栓形成或發生遠處轉移;臨床資料完善。排除標準:手術不耐受;存在既往腹部手術史;存在認知功能異常或意識障礙;其他免疫性疾病。其中2019 年11 月-2020 年11 月治療的患者為參照組(n=32),2020 年12 月-2021 年11 月治療的患者為研究組(n=32)。本次研究通過本院倫理委員會審核。患者本人知情本項研究并簽署同意書。
1.2 方法
1.2.1 參照組 實施腹腔鏡肝切除術治療,主要手術步驟:指導患者取仰臥位,并進行全身麻醉,待麻醉成功后,在患者肋緣下作切口,建立四孔氣腹;隨后利用腹腔鏡探查腫瘤病灶大小及肝臟情況,在探查清楚腫瘤具體位置及形態后,游離肝臟并離斷切除肝臟相應韌帶,再切除腫瘤組織;腫瘤清除后,相應的對患者行血管、膽管結扎處理,并進行肝門靜脈阻斷,隨后做好止血工作,清洗腹腔,留置腹腔引流管,做好創面消毒工作,結束手術治療,送回病房。
1.2.2 研究組 研究組實施腹腔鏡射頻消融術治療,主要手術步驟為:指導患者取仰臥位,并進行全身麻醉,待麻醉成功后,建立氣腹,置入腹腔鏡探查患者腫瘤病灶大小及肝臟情況,在探查清楚腫瘤具體位置及形態后,將射頻治療針置入腫瘤位置底部,并連接射頻治療儀進行射頻治療,初始射頻功率設置為50 W,隨后每2 分鐘增加10 W,直至輸出功率達到90 W 為止,進行射頻治療過程中,需要嚴格控制電機范圍,每次消融時間控制在10 min 左右,并相應的根據患者腫瘤大小具體情況實施單針或是多針治療,以確保整個腫瘤病灶及邊緣1 cm 以上組織被損毀,消融完成后,再次使用腹腔鏡超聲探查消融效果,直至結果滿意后進行退針,最后做創面消毒工作。
1.3 觀察指標及評價標準(1)手術相關指標:詳細記錄兩組術中出血量、手術治療時間、住院時間。(2)疼痛程度:采用視覺模擬評分法(VAS)評分分別于術后12、24、72 h 對兩組疼痛程度進行評分,總分為0~10 分,其中無痛計0 分;患者感覺有輕微疼痛,尚能忍受,計1~3 分;患者感覺疼痛、影響睡眠,計4~6 分;患者感受有強烈的疼痛或疼痛難忍,影響食欲與睡眠,計7~10 分。分值越高表示患者疼痛程度越高[8]。(3)肝功能:分別于手術治療前、手術治療后1 d 清晨取患者3 mL 空腹外周靜脈血,并采用全自動生化分析儀檢測兩組患者谷草轉氨酶(AST)、谷丙轉氨酶(ALT)水平。(4)T 淋巴細胞亞群水平:分別于手術治療前、手術治療后1 d 清晨取患者3 mL 空腹外周靜脈血,并采用流式細胞分析儀檢測兩組患者T 淋巴細胞亞群(CD3+、CD4+、CD8+)水平。
1.4 統計學處理 使用SPSS 23.0 統計學軟件對本次數據進行分析,計量資料用()表示,比較采用t 檢驗;計數資料以率(%)表示,比較采用χ2檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 兩組一般資料比較 參照組:男18 例,女 14 例;年齡43~79 歲,平均(59.49±4.31)歲;肝功能分級:A 級19 例,B 級13 例。研究組:男17 例,女15 例;年齡45~77 歲,平均(59.83±4.43)歲;肝功能分級:A 級20 例,B 級12 例。兩組一般資料對比,差異均無統計學意義(P>0.05),具有可比性。
2.2 兩組手術相關指標比較 研究組手術時間、住院時間均短于參照組,術中出血量少于參照組,差異均有統計學意義(P<0.05),見表1。
表1 兩組手術相關指標比較()
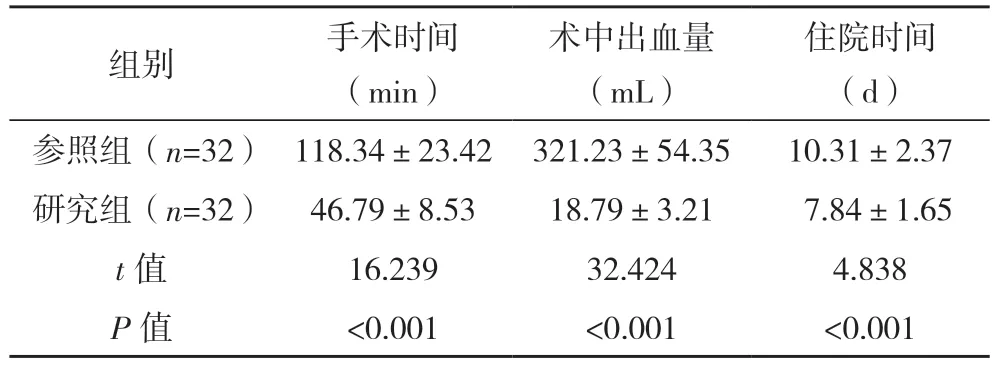
表1 兩組手術相關指標比較()
2.3 兩組疼痛程度比較 研究組患者術后12、48、72 h VAS 評分均低于參照組(P<0.05),見表2。
表2 兩組疼痛程度(VAS評分)比較[分,()]
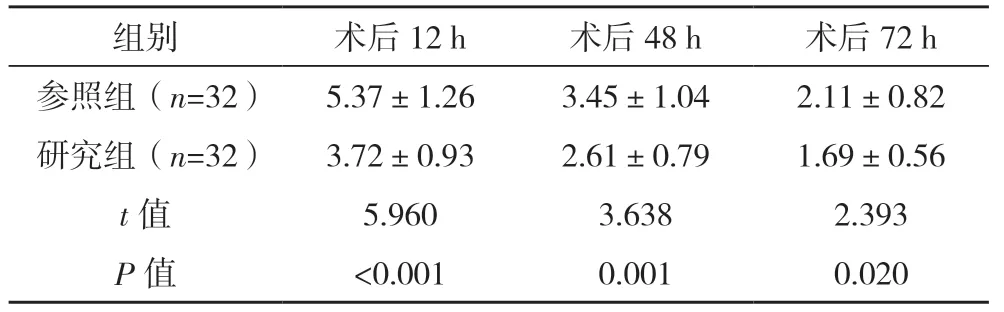
表2 兩組疼痛程度(VAS評分)比較[分,()]
2.4 兩組肝功能比較 術前,兩組AST、ALT 比較差異均無統計學意義(P>0.05);術后1 d,兩組AST、ALT 均有所升高,但研究組AST、ALT 均低于參照組(P<0.05)。見表3。
表3 兩組肝功能比較[U/L,()]

表3 兩組肝功能比較[U/L,()]
2.5 兩組T 淋巴細胞亞群水平比較 術前,兩組CD3+、CD4+、CD8+比較差異均無統計學意義(P>0.05);術后1 d,兩組患者CD3+、CD4+均有所降低,CD8+均升高(P<0.05),且研究組CD3+、CD4+均高于參照組,CD8+低于參照組(P<0.05)。見表4。
表4 兩組T淋巴細胞亞群水平比較[%,()]
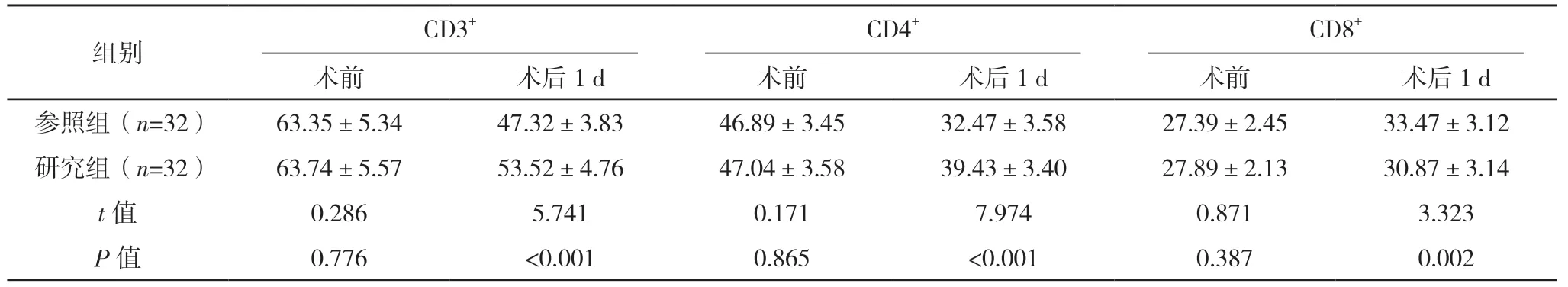
表4 兩組T淋巴細胞亞群水平比較[%,()]
3 討論
肝癌是我國常見的惡性腫瘤之一,發病受環境和內因等多種因素影響,發病率極高,其發病機制還尚未完全明確,嚴重威脅著人民生命健康和生活質量[9-10]。腹腔鏡肝切除術作為臨床常采用的一種治療方法,能夠有效切除腫瘤病變組織,控制癌癥因子轉移,與傳統的開腹式手術治療相比較,具有創傷小、直接、高效等特點[11]。但由于肝臟手術復雜多變,手術治療難度較大,且采用該術式存在很大視野暴露問題,對于切除部位位于肝臟后方或肝臟膈頂部手術視野困難,并且患者一旦出血便很難控制,手術視野一片模糊,便會被迫選用開腹式手術治療,進一步增大患者手術治療風險,不利于改善患者預后[12-13]。因此還需尋找更為安全、有效的術式治療患者,積極改善患者臨床癥狀,控制患者疾病進展[14]。
據文獻[15]研究顯示,對于肝癌患者而言,早期進行相應的手術治療,完全切除腫瘤后擁有較大的治愈機會,或是能有效控制癌癥因子發生轉移,因此早期積極對肝癌患者實施更為有效的治療方式,具有十分重要的意義。在本次研究中,對兩種術式進行比較,實施腹腔鏡射頻消融術治療的患者手術時間、住院時間均短于實施腹腔鏡肝切除術治療患者,術中出血量少于實施腹腔鏡肝切除術治療患者,且術后12、48、72 h VAS 評分均低于實施腹腔鏡肝切除術治療患者。這一結果提示,對原發性肝癌患者實施腹腔鏡射頻消融術能夠有效縮短患者手術時間,減少患者出血量,利于減輕患者疼痛程度。主要原因為:實施腹腔鏡肝切除術治療需要建立氣腹,然后再探查病情進行治療等操作,導致手術治療時間較長,且肝臟區域手術治療復雜,容易增加術中出血量,進而加大手術治療難度及風險,不利于改善患者預后。而射頻消融術作為一種微創介入治療方法,其具有操作簡單、創傷小及出血量少等特點,能夠有效節約治療時間,進而減少患者產生應激反應,利于改善患者預后及減少患者術后疼痛程度[16-17]。
AST、ALT 是檢測患者肝功能的兩個敏感指標,當患者肝功能出現損傷、破壞時,AST、ALT 便會相應的升高[18]。在本次研究中,在進行手術治療后,兩組患者AST、ALT 均有所升高,但實施射頻消融術治療患者AST、ALT 均低于實施腹腔鏡肝切除術治療患者,這一結果提示,對肝癌患者實施手術治療會在一定程度上損傷患者肝功能,但實施射頻消融術對患者肝功能影響較小。主要原因為:實施腹腔鏡肝切除術在術中需要對患者進結扎縫合治療,容易對患者肝臟造成較大損傷,而實施射頻消融術在進行消融腫瘤組織時也會對患者肝功能造成一定損傷,但影響稍小。同時,兩組患者CD3+、CD4+均有所降低,CD8+均提升,且研究組患者CD3+、CD4+均高于參照組,CD8+低于參照組,這一結果提示,對患者實施兩種手術治療均會對患者造成一定損傷,進而影響患者免疫功能,而實施射頻消融術對患者免疫功能影響較小。究其原因可能為實施腹腔鏡肝切除術治療創傷性更大,容易引起患者出現相應的應激反應,進而導致患者機體免疫功能受到抑制[19-21]。
綜上所述,對原發性肝癌患者實施腹腔鏡射頻消融術治療,能夠有效縮短患者手術治療時間,減少患者出血量及減輕患者疼痛程度,并能降低對患者肝功能、免疫功能影響。

