胰蛋白酶和膠原酶灌注法分離提取小鼠原代肝細胞的比較
任文潔,林哲絢
(汕頭大學醫(yī)學院生物分析實驗室,廣東 汕頭 515041)
肝臟是哺乳動物體內(nèi)重要的代謝和解毒器官,參與機體多種生理病理過程[1]。原代肝細胞的培養(yǎng)可用于探索肝臟在物質代謝中的作用,闡明各種肝臟疾病的發(fā)病機制,對研發(fā)新藥物也至關重要。因此獲得高活性和形態(tài)完整的原代肝細胞是進行肝臟體外研究的基礎。原代肝細胞的分離提取方法有直接剪切法、組織塊培養(yǎng)法、胰蛋白酶(胰酶)離體消化法、Seglen灌注法、半原位膠原酶灌注法等[2]。但剪切法,組織塊培養(yǎng)法和胰酶離體消化法所分離得到的肝細胞,存活率不高,機械損傷大,而且酶消化條件不易控制。Seglen灌注法及半原位膠原酶灌注法分離得到的肝細胞存活率高且數(shù)量多,但其操作技巧性較高且需要特殊設備(如精密型蠕動泵),限制了該方法的廣泛應用。本研究在灌注法的基礎上進行改良,建立一種簡單易行,低成本的小鼠原代肝細胞分離方法,并對比胰酶和膠原酶灌注法分離提取的小鼠原代肝細胞。
1 材料與方法
1.1 動物
SPF級C57BL/6J小鼠,雄性,10~16周,體重20~25 g,購自湖南斯萊克景達實驗動物有限公司。常規(guī)喂養(yǎng),溫度18~22℃,濕度50%~60%,12 h白天黑夜循環(huán)。本研究經(jīng)汕頭大學醫(yī)學院實驗動物倫理委員會審核批準。
1.2 主要試劑和儀器
HEPES(上海阿拉丁生化科技股份有限公司);胰蛋白酶(BBI生命科學有限公司);膠原酶D、DNA酶Ⅰ(德國默克集團);蛋白酶、地塞米松(美國Sigma公司);胰島素(上海麥克林生化科技有限公司);胎牛血清(美國賽默飛世爾科技公司);青鏈霉素、Percoll細胞分離液、糖原PAS染色試劑盒(北京索萊寶科技有限公司);DMEM高糖培養(yǎng)基(美國Hyclone公司);臺盼藍、Alexa Fluor 488標記山羊抗兔IgG(H+L)、熒光染料Hoechst 33258(上海碧云天生物技術有限公司);山羊抗兔角蛋白-18抗體(武漢三鷹生物技術有限公司)。卡默爾微型蠕動泵(上海卡川爾流體科技有限公司);細胞培養(yǎng)箱(美國Thermo公司);Imager A1相差倒置熒光顯微鏡、Imager A2正置熒光顯微鏡(德國蔡司公司)。
1.3 溶液配制
胰酶灌注液Ⅰ:EDTA 0.5 mmol/L,HEPES 25 mmol/L,D-Hanks液20 mL。胰酶灌注液Ⅱ:胰酶0.125%,HEPES 15 mmol/L,D-Hanks液10 mL。 膠 原 酶 灌 注 液 Ⅰ :EDTA 0.5 mmol/L,D-Hanks液10 mL。膠原酶灌注液Ⅱ:蛋白酶E 3.2 mg,Hanks 8 mL。膠原酶灌注液Ⅲ:膠原酶D 4.8 mg,Hanks液12.5 mL。清 洗 液:DNA酶Ⅰ0.02 mg/mL,格氏平衡鹽溶液50 mL。純化液:50% Precoll細胞分離液。鼠尾膠原Ⅰ:鼠尾13 μL,0.02 mol/L冰醋酸10 μL,無菌水1 mL。完全培養(yǎng)基:胰島素0.5 μg/mL,地塞米松100 nmol/L,青鏈霉素1%,胎牛血清10%,DMEM高糖培養(yǎng)基200 mL。
1.4 方法
1.4.1 胰酶兩步灌注法(1)準備:灌注液以及DMEM高糖培養(yǎng)基于42℃水浴鍋中預溫30 min[3],準備好動物實驗臺以及手術器械,并在無菌操作臺上照射紫外線30 min。蠕動泵管道以胰酶灌注液Ⅰ循環(huán)運行,防止氣泡產(chǎn)生。(2)灌注:CO2窒息法處死小鼠并將其泡在酒精內(nèi)10~20 s。轉移至無菌操作臺。解剖小鼠,暴露腹腔以及整個胸腔。結扎下腔靜脈肝上段,從下腔靜脈水平進針。開啟灌注,并在門靜脈處剪一個小口。灌注流速3 mL/min;消耗胰酶灌注液Ⅰ15 mL,流出液體澄清,即停止灌注。將泵管轉移至胰酶灌注液Ⅱ中,繼續(xù)灌注,消耗胰酶灌注液Ⅱ10 mL。肝臟逐漸腫脹,并用玻璃分針輕按肝臟,凹陷且回彈速度慢,即可。(3)分離:用鑷子夾住連接各個肝葉的纖維束聚集部位,順著結締組織剪切,將肝臟浸入含3 mL 10%胎牛血清的玻璃皿中以終止灌注,再加入10 mL清洗液。輕輕剝離肝葉包膜,再用鑷子夾住纖維束,搖動以分散殘留的細胞。將細胞懸液過濾,即得到肝細胞懸液。(4)純化:將已過濾的肝細胞懸液轉移至50 mL離心管中,低溫低速離心(4℃,50×g,3 min)。棄上清,加入15 mL清洗液并進行3次輕吹打,重復離心3次。棄上清,加入10 mL完全培養(yǎng)基重懸細胞,并緩慢加入到10 mL的純化液中,離心(4℃,400×g,10 min),棄上層,剩下的細胞沉淀即為肝實質細胞,加入5 mL完全培養(yǎng)基重懸細胞。
1.4.2 膠原酶灌注法與胰酶兩步灌注法相同,灌注液不同。灌注:灌注流速3 mL/min,待膠原酶灌注液Ⅰ消耗9 mL時,停泵。更換至膠原酶灌注液Ⅱ中,繼續(xù)灌注,消耗8 mL(或15 mL)。停泵,更換至膠原酶灌注液Ⅲ中,消耗11 mL(或21 mL)。若需要更多的細胞數(shù)量,可增加灌注體積及時間[3]。分離:將分離的肝臟放入裝有膠原酶灌注液Ⅲ的離心管中,密封并放入42℃預溫5 min。將肝臟浸入含10%胎牛血清培養(yǎng)基的培養(yǎng)皿中進行撕肝,經(jīng)200目濾網(wǎng)過濾,濾液即為肝細胞懸液。
1.4.3 細胞計數(shù)及臺盼藍染色細胞懸液稀釋10倍后,與臺盼藍以9∶1(體積比)混勻,顯微鏡下進行細胞計數(shù)。細胞折射率較強的圓形細胞為肝實質細胞,被染為藍色的細胞為死細胞。計算細胞存活率(活細胞數(shù)/細胞總數(shù)×100%)。
1.4.4 肝細胞形態(tài)學觀察分離的肝細胞接種于鼠尾膠原Ⅰ預處理的含完全培養(yǎng)基的培養(yǎng)板,于37℃、5%CO2、濕度95%的培養(yǎng)箱中培養(yǎng)。24 h后更換培養(yǎng)基。分別于分離6 h、12 h、24 h、48 h,3 d,7 d后在倒置顯微鏡下觀察并拍照。
1.4.5 肝細胞的鑒定通過糖原PAS染色法[4]及CK-18免疫熒光細胞化學染色[5]鑒定肝細胞。PAS染色法簡要步驟如下。將純化后的原代肝細胞爬片,高碘酸避光氧化,再經(jīng)希夫試劑室溫避光染色,蘇木素復染,自來水沖洗,晾干,鏡檢拍照。CK-18免疫熒光細胞化學染色簡要步驟如下。細胞爬片培養(yǎng)24~48 h后,棄上清,4%多聚甲醛室溫固定。PBS沖洗3次,0.2%Triton X-100滲透。PBS洗3次,1%BSA封閉30 min。山羊抗兔CK-18抗體4℃孵育過夜,Alexa Fluor 488標記山 羊 抗 兔IgG(H+L) 抗 體37℃ 孵 育1 h。Hoechst 33258(5 μg/mL)室溫孵育10 min,60%緩沖甘油封片,熒光顯微鏡觀察拍照。對照組用PBS替代一抗。
1.4.6 細胞活性的檢測采用MTT法檢測細胞活性。將新鮮提取的小鼠原代肝細胞以5×103/孔接種于96孔板中,分別于接種6 h、12 h、24 h、48 h、3 d、7 d后進行MTT實驗。棄掉培養(yǎng)基,加入含MTT(5 mg/mL)的DMEM高糖培養(yǎng)基110 μL(體積比為1∶10)培養(yǎng)4 h,棄培養(yǎng)基,加入150 μL二甲基亞砜避光震蕩10 min,用酶標儀檢測各孔吸光度值D(570 nm)。每組設6個復孔,實驗獨立重復3次。
1.5 統(tǒng)計學方法
應用SPSS 25.0統(tǒng)計軟件進行分析,符合正態(tài)分布的計量資料以表示,組間比較用獨立樣本t檢驗;不同酶灌注法分離的肝細胞接種不同時間的細胞活性比較采用重復測量方差分析。以P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 兩種分離方法的提取過程比較
胰酶灌注法經(jīng)過兩步灌注后,肝臟土灰色并呈現(xiàn)腫脹狀態(tài),輕按肝葉回彈速度慢。在進行撕肝時,肝葉成塊狀,不易形成糜狀。過濾前后,溶液渾濁程度低(圖1A)。膠原酶灌注法經(jīng)過三步灌注后,肝葉逐漸塌軟,輕按肝葉回彈速度慢或基本不回彈。撕肝時肝葉呈糜狀,溶液渾濁程度高(圖1B)。經(jīng)過低溫低速離心3次并純化后,兩種方法均可獲得肝實質細胞。
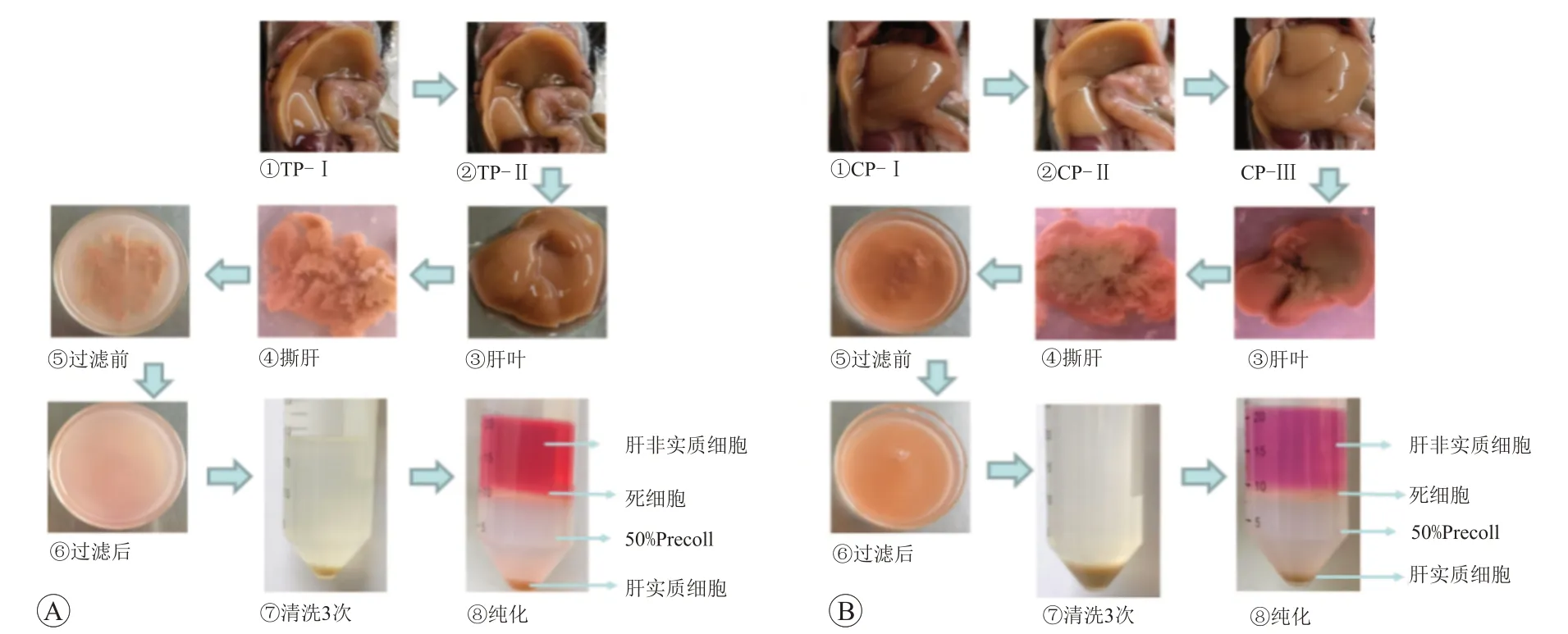
圖1 不同酶灌注法分離提取肝細胞過程
2.2 細胞數(shù)量與存活率
與胰酶灌注法相比,膠原酶灌注法分離提取的肝細胞數(shù)量明顯更多(P<0.05),見表1。肝細胞懸液經(jīng)純化后,兩種方法分離所得細胞存活率均可達到90%以上。臺盼藍染色觀察到剛分離的活細胞呈圓形或橢圓形,細胞體透亮、飽滿,而被染為藍色的為死細胞(圖2)。
表1 兩種灌注法分離所得肝細胞數(shù)量及存活率的比較(n=6,)

表1 兩種灌注法分離所得肝細胞數(shù)量及存活率的比較(n=6,)
1)與胰酶灌注法比,P<0.05。
方法胰酶灌注法膠原酶灌注法細胞總數(shù)(個/10 μL)63.0±7.4 119.5±20.51)活細胞數(shù)(個/10 μL)58.5±7.0 109.0±16.9死細胞數(shù)(個/10 μL)4.0±2.5 10.5±6.7存活率/%93.0±2.0 93.0±5.0

圖2 肝實質細胞的臺盼藍染色(×100)
2.3 肝細胞形態(tài)學觀察
接種6 h后,肝細胞基本貼壁,呈鋪路石狀,細胞邊界清晰,可見單核或雙核。接種24 h后,肝細胞有向外延伸的趨勢,胞體明顯增大、平展并呈不規(guī)則多角形。培養(yǎng)3 d后,肝細胞形成條索狀或島狀結構,相鄰的細胞彼此連接更加緊密(圖3)。細胞貼壁7 d后,細胞間融合成片,界限消失,未見明顯細胞核。兩種酶灌注法分離出的肝細胞在形態(tài)上無明顯差異。
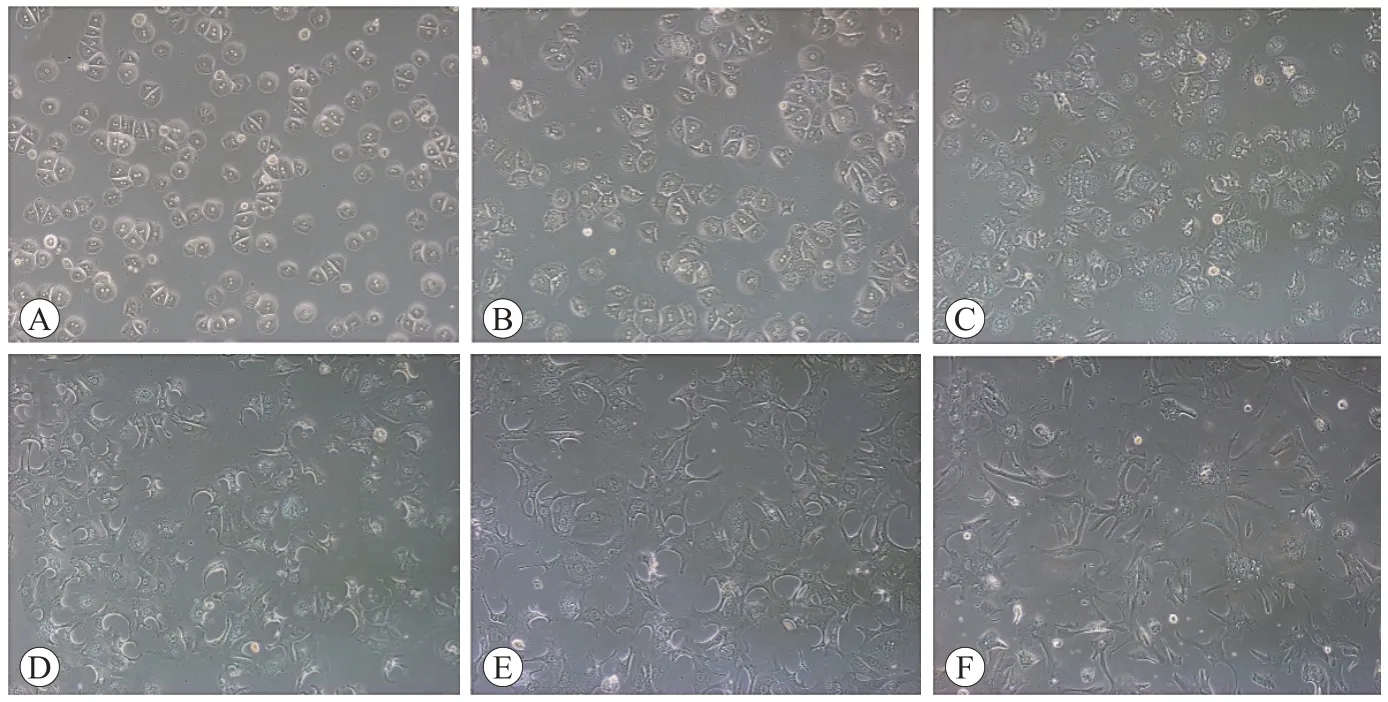
圖3 原代肝細胞培養(yǎng)不同時間的形態(tài)圖(×100)
2.4 肝細胞鑒定
肝細胞培養(yǎng)24 h經(jīng)PAS染色后可見細胞胞質呈紫紅色,并呈均質或顆粒狀分布(圖4)。免疫熒光染色結果表明,陽性細胞胞質可觀察到綠色熒光(圖5)。兩種酶灌注法分離出的細胞經(jīng)鑒定并計數(shù),獲取的原代肝細胞純度均>90%。

圖4 原代肝細胞的PAS染色(×200)

圖5 原代肝細胞的抗CK-18免疫熒光染色(× 200)
2.5 不同培養(yǎng)時間的肝細胞活性
重復測量方差分析結果表明小鼠原代肝細胞培養(yǎng)48 h后,膠原酶灌注法分離的細胞吸光度值高于胰酶灌注法(F=5.501,P<0.001);不同酶灌注法分離提取的細胞在接種12 h時吸光度值達到最大值,并隨接種時間的延長,細胞吸光度值逐漸下降(F=628.787,P<0.001);不同酶灌注法和接種時間之間存在交互效應,胰酶灌注法分離的細胞吸光度值下降幅度高于膠原酶灌注法(F=52.527,P<0.001),見圖6。
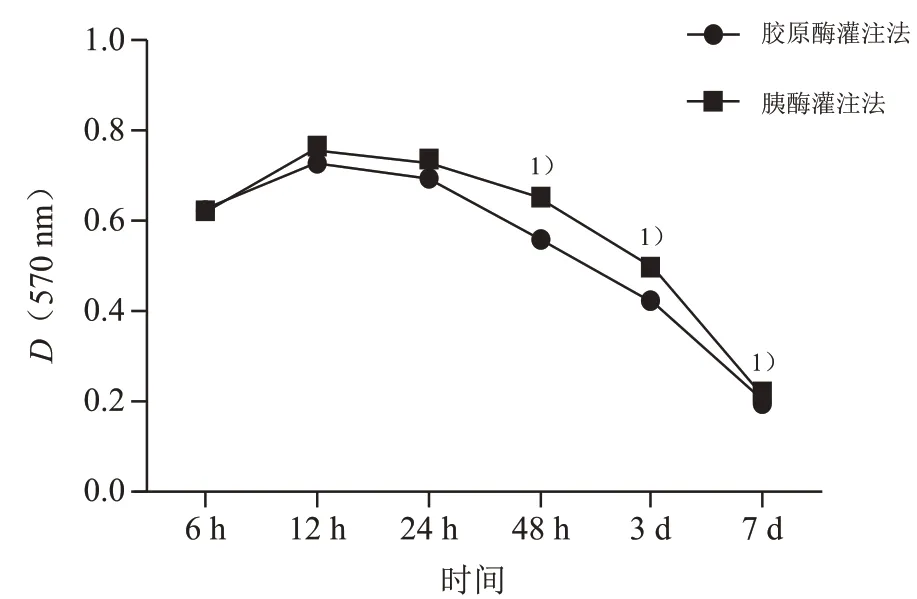
圖6 原代肝細胞接種不同時間的細胞MTT顯色吸光度值
3 討論
原代肝細胞比永生化的肝細胞系更真實地反映肝細胞的生理反應,因而廣泛地應用于肝臟毒理學、藥理學、生理學等各方面的研究[6]。原代肝細胞的分離提取是肝細胞體外培養(yǎng)的關鍵步驟,獲取高活性,高純度以及形態(tài)完整的肝細胞是原代肝細胞分離提取的核心目標。國內(nèi)外研究者建立了多種原代肝細胞分離培養(yǎng)的方法,但存在操作復雜、技術性高、實驗條件高、成本高以及低活性,低產(chǎn)率等問題[7]。例如直接剪切法對細胞的機械損傷大,導致細胞存活率和獲得率低;組織塊培養(yǎng)法操作復雜,剪切以及剔除組織塊時易造成污染,肝細胞爬出時間長且純度不高;胰酶離體消化法的消化時間及用量不易控制,消化過度形成絮狀組織塊,不易剔除導致純度不高,消化不充分導致獲得率低;Seglen 灌注法操作技術高,流程多且繁瑣,膠原酶成本高等。本研究根據(jù)實驗室現(xiàn)有條件對經(jīng)典兩步灌注法進行改良,使用0.125%胰酶進行消化,得出最佳消化用量為10 mL,細胞獲得率,活性及純度高,且成本低。本研究根據(jù)文獻[3],減少膠原酶用量,縮短灌注時間及操作流程,既可獲得大量肝細胞,細胞純度及存活率均滿足體外原代肝細胞實驗要求,也大大降低了成本。同時,本研究對胰酶和膠原酶灌注法分離提取小鼠原代肝細胞的形態(tài)、活性、純度、細胞數(shù)量及存活率進行了比較。
胰蛋白酶是一種絲氨酸蛋白水解酶,作為肽鏈內(nèi)切酶,可水解賴氨酸或精氨酸羧基端,從而可使細胞間的蛋白質水解,細胞離散。然而,膠原蛋白是細胞外基質的主要成分,因其穩(wěn)定而保守的三螺旋結構,不易被普通蛋白酶降解。膠原蛋白酶D 是一種膠原蛋白水解酶,具有解離組織以釋放單個細胞的作用,但價格較高。在本研究中,胰酶灌注法先用含EDTA 的D-Hanks 溶液灌注以去除血細胞和螯合肝細胞間的鈣離子,破壞肝細胞間的橋粒連接;再用含胰酶的D-Hanks 溶液進行灌注,以利于肝細胞的分離,可獲取肝細胞量為(3~7)×106/只。經(jīng)反復試驗得出最適胰酶濃度為0.125%,最適灌注體積為10 mL。膠原酶灌注法同樣先以EDTA 灌注減少細胞間的黏附;其次鏈蛋白酶E 聯(lián)合膠原酶灌注以充分消化肝組織。Hanks 溶液的Ca2+可激活膠原酶D,使用含膠原酶D 的Hanks 溶液灌注充分消化細胞間的連接以及纖維組織,獲得肝細胞(2~8)×107/只。不管使用何種蛋白酶,在灌注過程中,均需控制灌注用量及時間,避免消化不充分或消化過度,從而保持高活性和高產(chǎn)率。
原代肝細胞的培養(yǎng)條件較高。在本研究中,將新鮮提取的肝細胞接種于Ⅰ型鼠尾膠原包被的培養(yǎng)皿(培養(yǎng)板),可促進肝細胞貼壁,避免細胞聚集成團生長。在高糖DMEM 培養(yǎng)基中加入10%胎牛血清和胰島素,既滿足細胞生長需求,又可增加肝細胞的貼壁率,促進核蛋白磷酸化以及鐵的攝入[8]。原代肝細胞培養(yǎng)時,地塞米松可促進肝細胞線粒體再生,并提高肝細胞穩(wěn)定性[9]。本研究中兩種分離方法獲得的肝細胞在相同培養(yǎng)條件下,培養(yǎng)不同時間的細胞形態(tài)變化基本一致;通過臺盼藍染色,糖原染色和抗CK-18 免疫熒光細胞化學染色鑒定,存活率及純度均達到90%以上。顯然,膠原酶的消化更有利于獲得大量肝細胞,這與膠原酶作用機制有關,而胰酶灌注法雖得率較低,但仍可獲得活性、純度較高的原代肝細胞,因其成本更低,也不失為一種較好的替代方法。
綜上所述,本研究建立了簡單易行,低成本的酶灌注法,分離提取的肝細胞可在一定條件下保持穩(wěn)定的活性,可應用于與肝細胞相關的多種體外實驗研究。

