嬰兒巨細胞病毒感染性肝炎病毒載量與γ-GGT的相關性及其對預后預測價值
陳思敏,劉鵬飛,陸立東,張新宇
(1.江南大學附屬醫院兒科,江蘇 無錫 214000;2.江蘇省江陰市人民醫院消化內科,江蘇 無錫 214000)
巨細胞病毒(cytomegalovirus,CMV)感染性肝炎是兒科常見疾病之一,臨床多表現為黃疸、肝脾腫大,患兒可出現不同程度肝功能損傷,病情嚴重者可發展為肝衰竭,甚至可導致死亡[1-2]。相關資料顯示CMV原發感染多發生于嬰幼兒期,嬰幼兒期CMV抗體陽性率在60%~90%[3-4]。早期預測CMV感染性肝炎患兒預后情況,指導臨床早期開展急救管理,對改善CMV感染性肝炎患兒預后意義重大。目前國內外研究多側重報道CMV感染性肝炎患兒治療情況[5-6],與CMV感染性肝炎患兒預后敏感的因素尚缺乏報道,探討該問題可能為臨床早期治療CMV感染性肝炎提供更多醫療靶點,以便改善患兒預后,因此臨床迫切需要探索安全、高效、客觀預警CMV感染性肝炎患兒預后的生化標志物。肝臟是CMV侵犯人體的靶器官之一,損傷CMV感染性肝炎患兒肝功能,CMV-DNA是反映病毒復制活躍的重要指標,CMV損傷人體免疫功能,促進CMV感染性肝炎患兒病情進展[7]。γ-谷氨酰轉移酶(γ-glutamyltransferase,γ-GGT)是反應人體肝功能常用指標之一,是細胞抗氧化系統中的一員,γ-GGT異常高表達的患兒肝功能損傷嚴重,加之CMV損傷免疫細胞功能,導致持續肝臟炎癥、巨噬細胞激活,促進細胞外基質蛋白過多積累,可能出現肝纖維化、肝衰竭[8]。基于前人研究,筆者推測CMV病毒載量及γ-GGT水平與CMV感染性肝炎患兒預后有關,適合作為評估CMV感染性肝炎患兒的敏感指標,但目前尚缺乏CMV病毒載量及γ-GGT水平與CMV感染性肝炎患兒預后的關系驗證及預警效能的前瞻性研究報告,鑒于此,本研究針對上述問題開展研究,現報告如下。
1 資 料 與 方 法
1.1一般資料 選取2018年4月—2021年6月醫院收治的CMV感染性肝炎患兒163例為研究對象,其中男性84例,女性79例,月齡5~14個月,平均(10.49±1.58)個月。
本研究已經醫院倫理委員會審批通過。
納入標準:①符合《兒童巨細胞病毒性疾病診斷和防治的建議》[9]中CMV感染性肝炎診斷標準者;②參與本研究的家長是患兒長期照護者;③首次確診的原發感染者;④家長簽署研究知情同意書。
排除標準:①伴有孤獨癥譜系障礙、精神發育遲滯者;②伴有自身免疫性疾病者;③伴有傳染性疾病、嚴重軀體疾病者;④伴有先天性畸形、膽道發育異常、內分泌疾病、遺傳綜合征者;⑤伴有嚴重免疫缺陷、血液系統疾病者;⑥近期使用過免疫抑制劑類、激素類藥物及影響肝臟功能藥物者;⑦伴有EB病毒、支原體、風疹病毒、流感病毒等其他病毒感染者;⑧自然失訪者。
1.2方法
1.2.1治療方法 參照《兒童巨細胞病毒性疾病診斷和防治的建議》[9],根據個體情況給予所有患兒抗病毒、抗感染、護肝、利膽、退黃等對癥治療。
1.2.2收集資料 收集所有患兒基本資料及治療前生化指標,包括性別、年齡、身高、體重、出生方式、喂養方式、家族疾病史及黃疸、肝腫大、脾腫大情況,血氨、總膽紅素(total bilirubin,TBIL)、丙氨酸轉氨酶(alanine aminotransferase,ALT)、天冬氨酸轉氨酶(aspartate aminotransferase,AST)、總膽汁酸(total bile acids,TBA)、膽堿酯酶(cholinesterase,CHE)、白蛋白、血小板、白細胞、凝血酶原時間(prothrombin time,PT)、活化部分凝血活酶時間(activated partial thromboplastin time,APTT)、凝血酶時間(thrombin time,TT)、免疫球蛋白(IgG、IgM、IgA)、CD3+、CD4+、CD8+、CD4+/CD8+,干擾素γ(interferon-γ,IFN-γ)、白細胞介素4(interleukin-4,IL-4)、γ-GGT、CMV-DNA載量。
1.2.3γ-GGT、CMV-DNA載量測定方法 采集患兒治療前采集靜脈血液5 mL,用全自動生化分析儀(濟南澤凱醫療器械有限公司,URIT-8401型)檢測γ-GGT含量。采用熒光定量PCR法測定血液中CMV-DNA載量,靜脈血液離心處理(3 500 r/min離心10 min,離心半徑12 cm),收集血漿,采用核酸提取儀(法國梅里埃Easy-MEG型)、病毒載量檢測儀(瑞士羅氏TaqMan96型)、CMV-DNA載量檢測試劑盒(中山大學達安基因股份有限公司)、PCR擴增儀(瑞士羅氏LightCycler 96型)定量測定CMV-DNA病毒載量,試驗嚴格參照試劑盒說明操作。
1.2.4近期預后情況 所有CMV感染性肝炎患兒入院治療后隨訪6個月,將患兒出現肝硬化、肝衰竭、死亡等不良事件者納入預后不良組,否則納入預后良好組。
1.3統計學方法 應用SPSS18.0統計軟件處理數據。計量資料采用t檢驗;計數資料采用χ2檢驗;采用Pearson方法分析相關性;繪制ROC曲線;影響因素的分析采用Logistic回歸分析模型。P<0.05為差異有統計學意義。
2 結 果
2.1CMV感染性肝炎患兒病毒載量與γ-GGT的相關性 163例CMV感染性肝炎患兒CMV-DNA病毒載量為(7.28±0.97)×105拷貝/mL,γ-GGT為(82.29±10.13)U/L。Pearson相關性分析顯示CMV感染性肝炎患兒CMV-DNA病毒載量與γ-GGT水平呈正相關(r=0.701,P=0.000)。
2.2CMV感染性肝炎患兒近期預后情況 163例CMV感染性肝炎患兒隨訪期間27例(16.56%,27例/163例)出現預后不良,其中16例肝硬化、8例肝衰竭、3例死亡,剩余136例(83.44%,136例/163例)患兒預后良好。
2.3預后不良組及預后良好組基本資料 預后不良組及預后良好組患兒的性別、年齡、身高、體重、出生方式、喂養方式、家族疾病史、黃疸、肝腫大、脾腫大、血氨、TBIL、ALT、AST、TBA、CHE、白蛋白、血小板、白細胞、PT、APTT、TT、IgG、IgM、IgA、CD3+水平對比差異均無統計學意義(P>0.05),預后不良組的CD4+、CD4+/CD8+水平均低于預后良好組(P<0.05),預后不良組的CD8+、IFN-γ、IL-4、γ-GGT、CMV-DNA載量均高于預后良好組(P<0.05)。見表1。
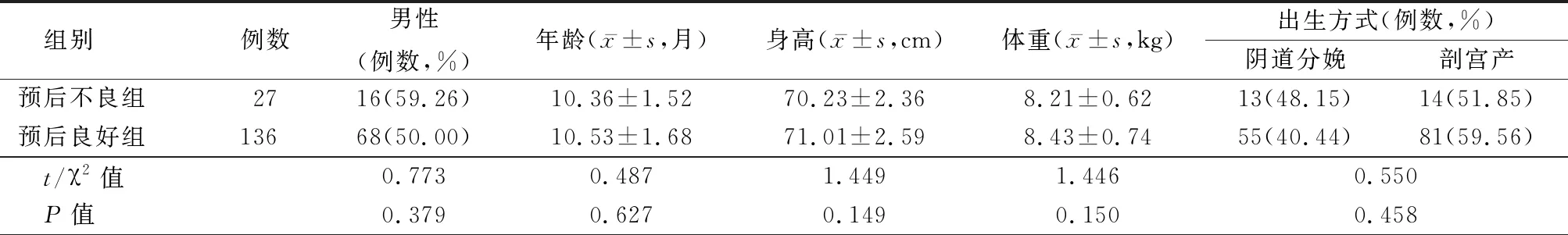
表1 預后不良組及預后良好組基本資料比較
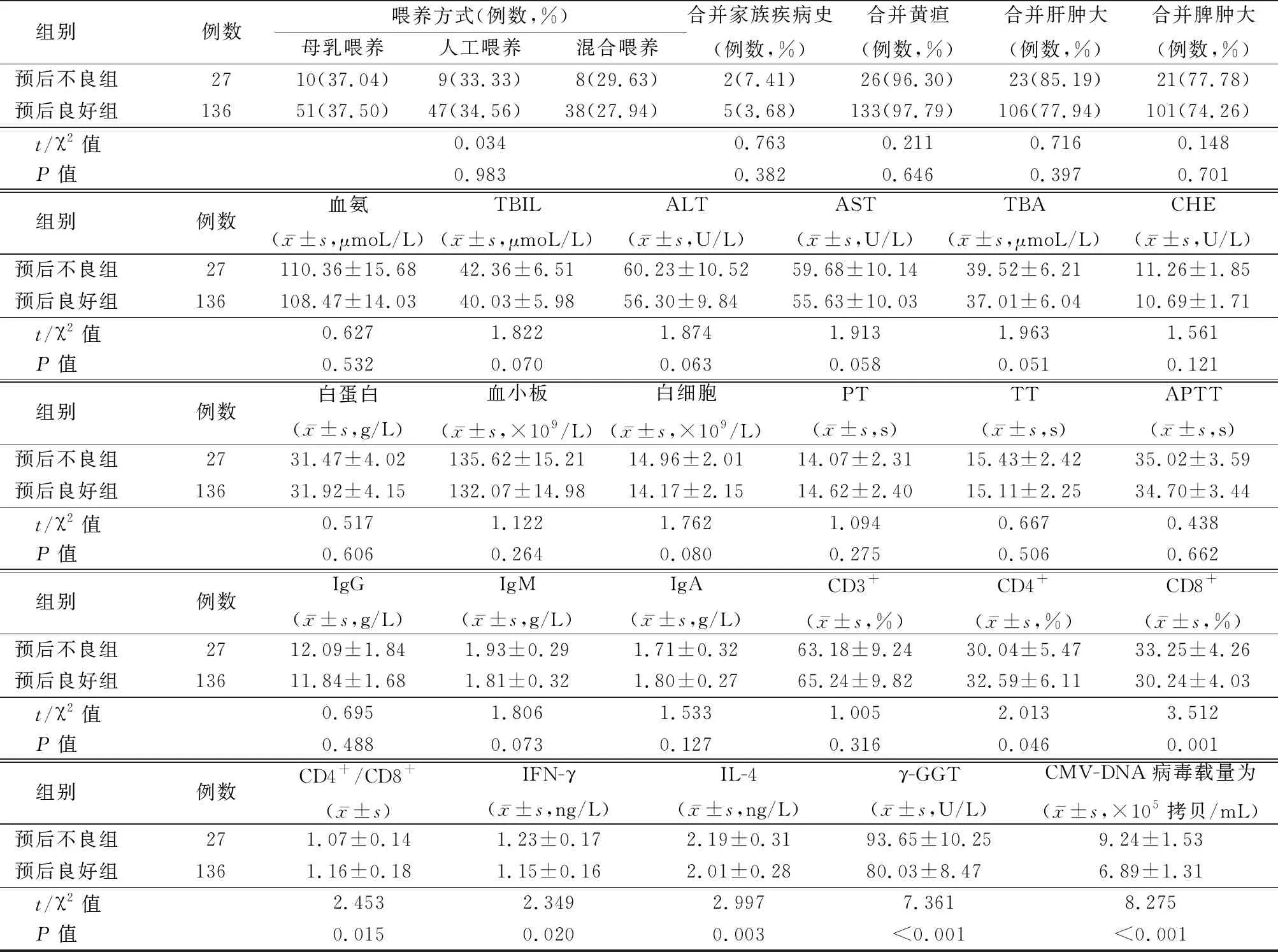
表1 (續)
2.4影響CMV感染性肝炎患兒近期預后的多因素分析 以CMV感染性肝炎患兒近期預后為因變量(預后良好=0,預后不良=1),CD4+、CD4+/8+、CD8+、IFN-γ、IL-4、γ-GGT、CMV-DNA載量為自變量(賦值為連續變量),進行Logistic回歸分析,多因素分析顯示CD4+/CD8+(OR:6.019,95%CI:2.477~14.629)、γ-GGT(OR:4.486,95%CI:1.846~10.903)、CMV-DNA載量(OR:5.859,95%CI:2.411~14.240)是影響CMV感染性肝炎患兒近期預后的危險因素(P<0.05),見表2。
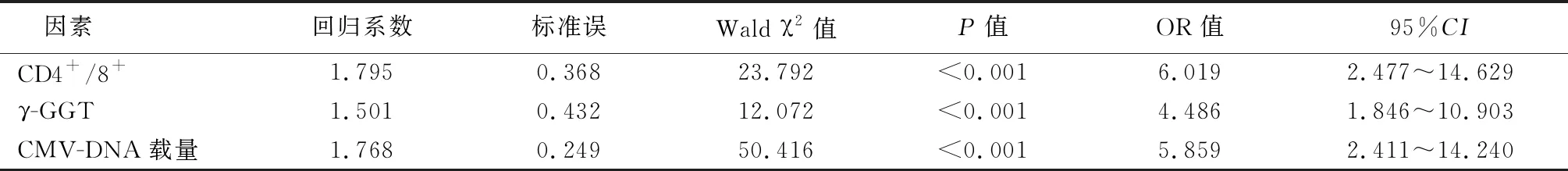
表2 影響CMV感染性肝炎患兒近期預后的多因素分析
2.5CMV-DNA載量與γ-GGT預測CMV感染性肝炎患兒近期預后的價值 ROC曲線分析結果顯示,CMV-DNA載量與γ-GGT預測CMV感染性肝炎患兒近期預后的敏感度分別為77.78%(95%CI:57.27~90.62)、74.07%(95%CI:53.41~88.13)、74.07%(95%CI:53.41~88.13),特異度分別為79.41%(95%CI:71.45~85.67)、77.21%(95%CI:69.07~83.77)、90.44%(95%CI:83.90~94.61),AUC分別為0.766(95%CI:0.671~0.862)、0.758(95%CI:0.656~0.861)、0.898(95%CI:0.835~0.962)。見表3,圖1。
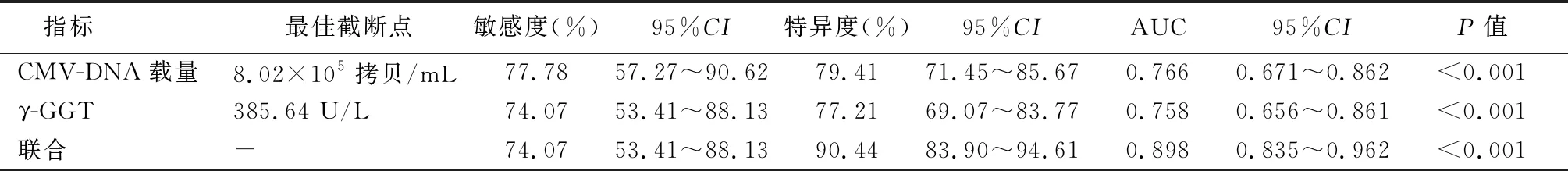
表3 CMV-DNA載量與γ-GGT預測CMV感染性肝炎患兒近期預后的價值分析
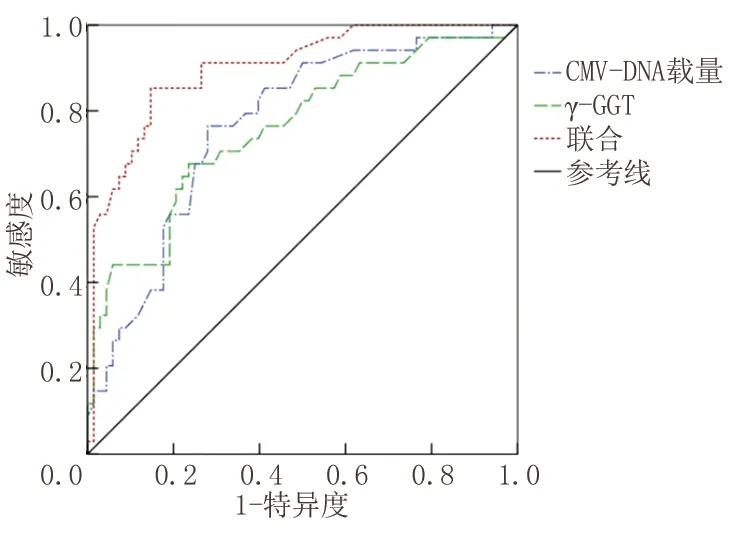
圖1 CMV-DNA載量與γ-GGT預測CMV感染性肝炎患兒近期預后的ROC曲線
3 討 論
目前CMV感染性肝炎患兒的治療仍較棘手,在給予抗病毒、抗感染、保護臟器等對癥治療的情況下,其預后情況仍不容樂觀[10-11]。臨床醫師早期精確評估CMV感染性肝炎患兒預后情況,盡早給予對癥、高效的治療措施,是控制CMV感染性肝炎病情進展、改善預后的重要保障。目前臨床尚缺乏高效、安全、客觀評估CMV感染性肝炎患兒預后的生化標志物,探索早期預測患兒預后的生化標志物成為臨床醫師關注的焦點。人體感染CMV后,巨噬細胞經歷形態學、免疫表型和代謝轉化過程,具有干性、遷移改變、侵襲性增強和為病毒增殖提供細胞周期,促進原發性CMV和繼發性細菌感染,CMV復制越活躍,病毒傳播不被分離越強,機體免疫功能損傷越嚴重,均可促進CMV感染性肝炎患兒病情進展,影響其預后[12-13]。γ-GGT是反映肝功能的重要指標之一,肝臟組織是CMV侵入的首要靶器官,肝功能損傷情況與CMV感染性肝炎患兒預后緊密相關。筆者認為CMV感染性肝炎患兒CMV病毒載量與其肝功能指標γ-GGT有關,二者均可影響患兒預后,但目前尚缺乏其關系驗證的報道,本研究通過開展前瞻性研究探討了該問題,希望尋找出早期預測MV感染性肝炎患兒預后的敏感指標,以期為CMV感染性肝炎的預防、治療、預后提供有力指導方針臨。
本研究Pearson相關性分析顯示CMV感染性肝炎患兒CMV-DNA病毒載量與γ-GGT水平呈正相關,提示CMV感染性肝炎患兒CMV-DNA病毒載量與其肝功能指標γ-GGT關系密切,CMV-DNA病毒載量越高的患兒肝功能損傷可能越嚴重。Logistic多因素回歸分析顯示CD4+/CD8+、γ-GGT、CMV-DNA載量影響是CMV感染性肝炎患兒近期預后的危險因素,提示并印證CMV感染性肝炎患兒CMV-DNA載量、γ-GGT水平與其預后有關。T淋巴細胞是CMV病原體侵入機體后攻擊的主要靶細胞之一,CD4+T淋巴細胞在抗病毒免疫反應中發揮重要作用,可介導其他效應細胞的擴增或功能,或直接發揮抗病毒作用。CMV感染性肝炎患兒CD4+T淋巴細胞減少,CD4+/CD8+T淋巴細胞比值偏移現象,損傷人體免疫功能,導致機體細胞免疫功能降低,免疫細胞清除CMV能力降低,CMV-DNA載量高,并進一步加劇免疫功能損傷,并形成惡性循環,進一步促進CMV復制,活動性原發性感染CMV病毒持續存在,CMV以肝細胞、胃腸平滑肌、上皮細胞等多種細胞為靶細胞,可這導致多個組織器官感染、損傷,促進CMV感染性肝炎患兒病情進展,影響患兒預后。Jabbari等[14]研究指出,CMV可特異性殺傷CD4+T淋巴細胞,促進CMV病毒復制,造成病毒性肝炎病情蔓延。
γ-GGT是一種膜結合酶,對谷胱甘肽合成至關重要,被認為是肝細胞損傷的生物標志物[15]。γ-GGT主要由肝細胞線粒體合成,多位于肝內膽管上皮中,主要從膽道排泄,血液中的γ-GGT主要來源于肝臟,肝功能正常人群血液中含量相對較低,在各種肝膽疾病中γ-GGT異常高表達,對評估肝細胞損害有較高價值。Gan等[16]研究指出,病毒性肝炎、肝硬化患者血液中γ-GGT水平異常升高。γ-GGT異常高表達的CMV感染性肝炎患兒肝損傷嚴重,CMV病毒可通過直接損傷肝細胞及誘發免疫反應導致肝細胞損傷,使肝臟遭受累加性損害,導致肝細胞廣泛變性、壞死,最終導致膽汁淤積性肝硬化損傷,加重CMV感染性肝炎患兒病情,增大其預后不良風險。ROC曲線分析結果顯示,CMV-DNA載量與γ-GGT預測CMV感染性肝炎患兒近期預后的敏感度分別為77.78%、74.07%、74.07%,特異度分別為79.41%、77.21%、90.44%,AUC分別為0.766、0.758、0.898,CMV-DNA載量與γ-GGT聯合預測CMV感染性肝炎患兒近期預后的特異度、AUC最大,提示CMV-DNA載量與γ-GGT聯合預測CMV感染性肝炎患兒近期預后效能良好,作為早期預測CMV感染性肝炎患兒近期預后的客觀生物標志物具有一定價值。
綜上所述,CMV感染性肝炎患兒病毒載量與γ-GGT水平有關,CMV病毒載量、γ-GGT可影響患兒預后情況,二者聯合預測CMV感染性肝炎患兒預后效能良好。本研究不足之處在于為單中心研究,隨訪時間有限,后期希望能夠擴大樣本量、延長隨訪時間進一步佐證本研究結論。

